联合含瘤周肿瘤全体积CT影像组学特征及临床相关独立预测因子列线图预测肺腺癌淋巴血管侵犯
陈巧玲,冯 峰*,李曼曼,薛 婷,彭 慧,石 健,朱兴华,段绍峰
(1.南通大学附属肿瘤医院放射科,2.病理科,江苏 南通 226000;3.GE医疗,上海 210000)
肺腺癌是肺癌最常见组织学亚型,手术切除是治疗早期肺腺癌的有效方法,而淋巴血管侵犯(lymphovascular invasion, LVI),即肿瘤细胞侵犯肿瘤周围小静脉、小动脉或小淋巴管而形成微转移,是影响肺腺癌切除术后转归的重要危险因素[1],可反映肿瘤侵袭性生物学行为[2]。对于LVI阳性肺腺癌患者,术前行新辅助化学治疗可降低术后复发率[3];相比亚肺叶切除术,行肺叶切除术、扩大淋巴结清扫范围有利于改善预后[4]。术前准确判断肺腺癌有无LVI有助于临床制定治疗方案,但目前主要依靠术后病理检查诊断LVI。基于肺腺癌原发灶CT影像组学特征可预测LVI[5-6];而原发肿瘤周围肺组织亦会参与肿瘤浸润与转移[7]。本研究观察基于肿瘤全体积(gross peritumoral tumor volume, GPTV)CT影像组学特征和临床相关独立预测因子构建的联合模型列线图预测肺腺癌LVI的价值。
1 资料与方法
1.1 一般资料 回顾性分析2013年1月—2018年5月142例于南通大学附属肿瘤医院经手术病理证实的单发肺腺癌患者,男84例,女58例,年龄41~86岁,平均(63.0±8.4)岁;均经术后病理证实有无LVI,于术前2周内接受胸部CT扫描且图像符合诊断要求。排除标准:①肺腺癌长径<1 cm;②合并其他恶性肿瘤;③术前接受抗肿瘤治疗。按7∶3比例将患者随机分为训练集(n=100)和验证集(n=42),分别含40例LVI阳性、60例LVI阴性及17例LVI阳性、25例LVI阴性患者。
1.2 仪器与方法 采用Siemens SOMATOM Sensation 64排CT机行胸部平扫,管电压120 kV,管电流自动调制,层厚及层间距均为5 mm,螺距1.0,矩阵512×512,准直1.0 mm;以流率2.5~3.0 ml/s经静脉注射对比剂碘海醇(300 mgI/ml)1.5 ml/kg体质量后行增强扫描,延迟25 s及50 s采集动脉期及静脉期图像,参数同上。
1.3 图像分析 重建肺窗 (窗宽1 500 HU,窗位-600 HU)和纵隔窗图像(窗宽350 HU,窗位40 HU)。由分别具有5年及10年以上胸部影像学诊断经验的主治及副主任医师各1名共同阅片,记录病灶最大径、成分、淋巴结转移、分叶征、毛刺征、强化程度及临床分期。选取病灶中心层面实性部分测量CT值,以动脉期与平扫CT值的差值≥20 HU为明显强化[8],<20 HU为无明显强化。
1.4 提取和选择影像组学特征 由上述2名医师分别参照文献[9]方法,结合平扫纵隔窗所示强化情况观察肿瘤轮廓、内部坏死空洞区域,于增强动脉期肺窗图像上确定肿瘤边界,尽可能将气体、骨质和胸壁等组织均排除在靶区外,并以ITK-SNAP 3.8.0软件(www.itksnap.org)沿肿瘤边界勾画肿瘤全体积(gross tumor volume, GTV)作为ROI。应用开源软件MITK(v2021.02, https://www.mitk.org)以区域增长方法将GTV自动向周围分别扩增3 mm、6 mm和9 mm,获得相应GPTV的ROI,即GPTV3、GPTV6及GPTV9,见图1。意见存在分歧时,经讨论达成一致。
利用开源工具Pyradiomics软件分别提取、计算靶区GTV、GPTV3、GPTV6和GPTV9的影像组学特征。以组内相关系数(intra-class correlation coefficient, ICC)评估2名医师提取影像组学特征的一致性,保留一致性较好(ICC>0.75)者。以最大相关最小冗余方法及最小绝对收缩和选择算法(least absolute shrinkage and selection operator, LASSO)逻辑回归法对特征降维,分别根据最优超参数λ值筛选最佳影像组学特征,构建预测肺腺癌LVI的GPTV3、GPTV6及GPTV9影像组学模型,并计算其影像组学评分(radiomics score, Radscore)。采用10折交叉验证,基于每个独立交叉测试结果评估模型诊断效能,以筛选最佳模型。
1.5 统计学分析 采用SPSS 26.0统计分析软件和R 语言(version 4.2.0)。以中位数(上下四分位数)表示不符合正态分布的计量资料,行Mann-WhitneyU检验;以χ2检验比较计数资料。将单因素分析显示差异有统计学意义的临床因素纳入多因素logistic回归,筛选肺腺癌LVI临床相关独立预测因子,并建立临床模型。基于最佳影像组学模型的Radscore和临床相关独立预测因子构建联合模型,绘制其列线图。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估模型诊断效能;以DeLong检验评估其AUC差异。采用Hosmer-Lemeshow检验评估联合模型列线图的拟合优度,以决策曲线分析(decision curve analysis, DCA)评估联合模型列线图的临床实用性。P<0.05为差异有统计学意义。
2 结果
2.1 构建临床模型 LVI阳性与阴性肺腺癌患者性别、吸烟和毛刺征差异均有统计学意义(P均<0.05),其余参数差异均无统计学意义(P均>0.05)。见表1。多因素logistic回归分析显示,性别[OR=3.09,95%CI(1.12,8.54)]、吸烟[OR=2.28,95%CI(0.90,5.80)]和毛刺征[OR=0.27,95%CI(0.09,0.74)]均为肺腺癌LVI的独立预测因子(P均<0.05),故以之建立临床模型。
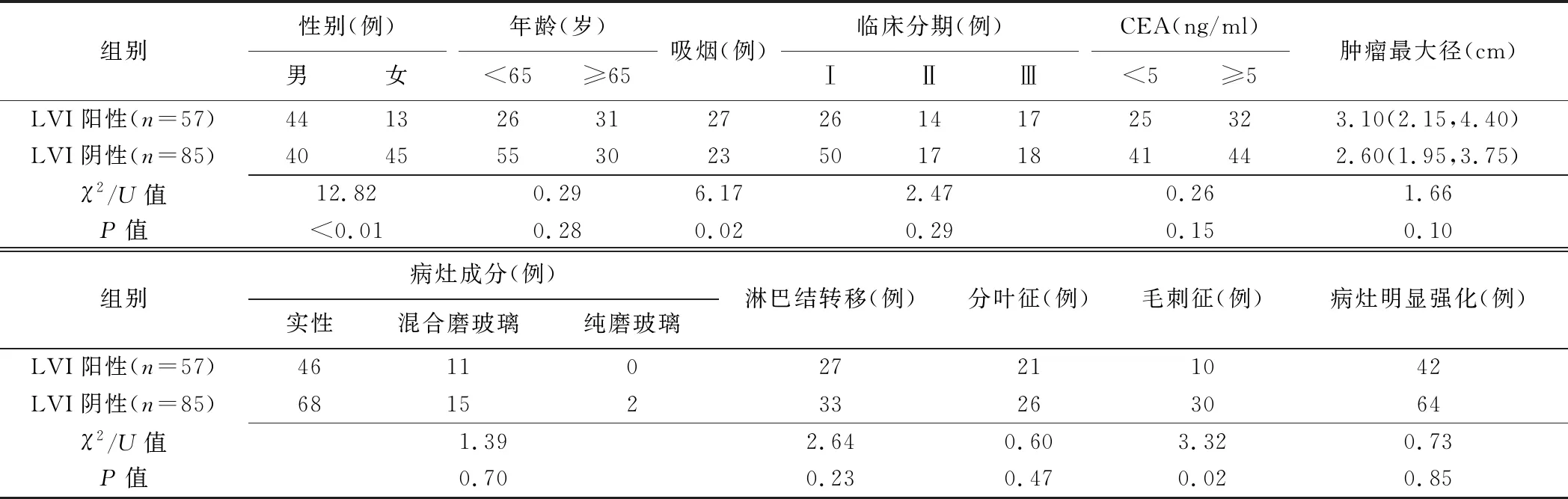
表1 LVI阳性与阴性肺腺癌患者一般资料及病灶CT表现比较
2.2 构建影像组学模型 分别基于GTV、GPTV3、GPTV6及GPTV9提取1 218个影像组学特征,以ICC>0.75为标准,分别保留952、1 060、988及973个,经LASSO回归分别选出7、16、10及8个最佳影像组学特征(图2),以之构建GTV、GPTV3、GPTV6及GPTV9模型。
2.3 评估模型效能 GTV、GPTV3、GPTV6和GPTV9模型预测训练集肺腺癌LVI阳性的AUC分别为0.79、0.82、0.80及0.77,在验证集分别为0.72、0.77、0.72及0.72。GPTV3模型在训练及验证集的AUC均高于GTV(Z=3.74、2.62,P均<0.01)、GPTV6(Z=2.40、2.06,P均<0.05)及GPTV9模型(Z=3.03、2.59,P均<0.01)。以GPTV3模型为最佳影像组学模型,基于其Radscore及临床相关独立预测因子构建的联合模型的列线图见图3。
训练集中,联合模型列线图及GPTV3模型预测肺腺癌LVI的AUC(0.86、0.82)均高于临床模型(0.73,Z=2.66、2.23,P<0.01、P=0.03),而联合模型列线图与GPTV3模型的AUC差异无统计学意义(Z=1.57,P=0.12);验证集中,联合模型列线图及GPTV3模型的AUC(0.73、0.77)均高于临床模型(0.61,Z=2.31、2.54,P=0.02、P<0.01),而联合模型列线图与GPTV3模型的AUC差异无统计学意义(Z=0.88,P=0.38),见表2及图4。训练集及验证集中,联合模型列线图的拟合度均良好(χ2=9.23、5.86,P=0.32、0.66)。训练集中,阈值取0.40~0.90时,联合模型列线图的净收益大于临床模型及GPTV3模型;验证集中,阈值取0.20~0.50时,联合模型列线图与GPTV3模型的净收益相当,且均大于临床模型。见图5。

表2 临床模型、GPTV3模型及联合模型列线图预测肺腺癌LVI的效能
3 讨论
肿瘤周围区域(病灶边界与正常肺组织之间的过渡区)包含大量反映肿瘤侵袭性的生物学信息,CT图像中的肿瘤周围3~9 mm区域可提供与肺腺癌异质性相关的影像组学信息[10-11]。本研究基于增强动脉期肺窗CT图像勾画GTV的ROI,并分别向外扩增3 mm、6 mm和9 mm获得相应GPTV的ROI,各于其中筛选出7、16、10及8个最佳影像组学特征,以构建影像组学模型;其中各含6、10、7、6个小波变换类(wavelet)影像组学特征,与既往文献[5]相似。相比GTV、GPTV6及GPTV9模型,本组GPTV3模型预测肺腺癌LVI效能最佳,为最佳影像组学模型,提示含瘤周3 mm的GPTV可提供更多反映肺腺癌LVI的相关信息[12]。
本研究发现性别、吸烟和毛刺征是肺腺癌LVI的临床相关独立预测因子,并据此建立临床模型。毛刺征由肺肿瘤及肺间质构成,代表肿瘤细胞浸润周围结缔组织和淋巴管[13];CT显示肺腺癌存在毛刺征常提示肿瘤恶性程度较高,肿瘤细胞增殖较活跃,易侵犯血管或淋巴管。本研究肺腺癌LVI与临床分期之间无明显相关,与既往报道[14]结果不同,推测与样本量较小有关。本研究结合临床相关独立预测因子及GPTV3模型的Radscore构建联合模型,并绘制列线图将之可视化,以综合评估肺腺癌LVI;其预测训练集和验证集肺腺癌LVI的AUC与GPTV3模型差异均无统计学意义,提示临床相关独立预测因子对联合模型列线图的贡献小于GPTV3模型的Radscore,与既往研究[5]结果类似。临床模型在训练集和验证集的AUC均小于GPTV3模型及联合模型列线图;阈值取0.2~0.4时,临床模型的临床净获益小于GPTV3模型及联合模型列线图,而后二者相当。
综上,基于GPTV3影像组学特征及临床相关独立预测因子的联合模型列线图可有效预测肺腺癌LVI。本研究的主要局限性:①为回顾性研究,样本量较小,且排除了长径<1 cm病灶,可能存在选择偏倚;②以半自动方式勾画病灶ROI,有待开发全自动软件用于分割肿瘤。

