全脑CT灌注成像诊断小体积急性脑梗死及其评估病灶体积与弥散加权成像的相关性
赵 松,张智琴,刘 岩,何业举,季 光,刘 丹*
(1.河北医科大学第二医院医学影像科,3.神经内科,河北 石家庄 050000;2.河北中医学院中西医结合学院医学影像教研室,河北 石家庄 050000)
急性脑梗死(acute cerebral infarction, ACI)病灶体积与预后相关。颅脑MR弥散加权成像(diffusion weighted imaging, DWI)可准确评估ACI灶体积,但不能评估脑组织缺血半暗带区。缺血半暗带指脑梗死核心相同血管供血区内、梗死灶周围的血流低灌注区,及时改善灌注可恢复正常;准确、快速评估ACI缺血半暗带具有重要临床意义。全脑CT灌注(CT perfusion, CTP)可准确评估脑组织缺血程度和范围、判断核心梗死区及缺血半暗带,为血管内治疗ACI提供影像学依据[1]。CTP诊断ACI的效能较高,敏感度为82%,特异度为96%[2],但对于体积较小病灶,其敏感度明显降低[3-4],而低剂量双源CTP的敏感度可达72.1%[5]。本研究观察全脑CTP对小体积ACI(体积≤8 ml)的诊断价值,以及CTP参数图与DWI评估的ACI灶体积的相关性。
1 资料与方法
1.1 一般资料 回顾性分析2020年8月—2021年10月就诊于河北医科大学第二医院的58例临床诊断ACI患者,男36例、女22例,年龄45~80岁、中位年龄67岁;均接受常规颅脑CT、CTP及其后72 h内DWI检查。纳入标准:①既往无脑梗死病史;②颅内无肿瘤性及慢性缺血性病变;③DWI证实ACI,且病灶体积≤8 ml。排除标准:①严重肝、肾功能障碍;②碘对比剂过敏。
1.2 仪器与方法
1.2.1 CT及CTP 采用Philips Brilliance iCT 256层螺旋极速CT机行头部扫描,管电压100 kV,管电流250 mA,层厚及层间距均为5 mm;采用高压注射器经肘静脉以流率5 ml/s团注非离子型对比剂碘普罗胺(370 mgI/ml)1.0~1.5 ml/kg体质量并跟注生理盐水40 ml、延迟4 s后行CTP,管电压80 kV,管电流250 mA,z轴覆盖范围16 cm,连续采集40 s,层厚5 mm,层间距5 mm,生成480幅图像。扫描结束后对CTP原始数据进行重建,层厚2.5 mm。
1.2.2 MR 采用GE Signa HDxt 3.0T MR仪,配备8通道头部线圈,采集头部常规图像后行DWI检查,TR 6 000 ms,TE 24 ms,层厚5 mm,层间距1 mm,b值为1 000 s/mm2。
1.3 图像分析 由2名具有8年神经影像学诊断经验的主治医师独立分析图像,意见不一致时经与另1名影像科主任医师会诊决定。将CTP数据导入后处理工作站,以健侧大脑前、中动脉为输入动脉,上矢状窦为输出静脉,利用动态时间-密度曲线生成脑血容量(cerebral blood volume, CBV)、脑血流量(cerebral blood flow, CBF)、平均通过时间(mean transit time, MTT)及达峰时间(time to peak, TTP)灌注彩图,软件自动显示异常灌注脑区;适当调节各参数色带阈值[6],使ACI灶边缘锐利,于每层手动勾画病灶范围,分别计算ACI灶体积,即所有层面异常灌注面积之和与层厚的乘积。参考文献[7]方法,设置CBV绝对值<2.0 ml/100 g及相对MTT(relative MTT, rMTT)>145%,评估ACI灶有无缺血半暗带,并获得核心梗死区;分别于图像各层核心梗死区及缺血半暗带手动勾画1~3个面积约10 mm2的圆形或椭圆形ROI,测量其CTP参数值,通过自动镜像技术生成健侧ROI各参数值,取其均值为最后结果。
以DWI高信号区为ACI灶,如异常高信号被正常脑组织分离,则判定为多个病灶,反之为单个病灶;手动勾画病灶ROI,计算ACI灶体积:ACI灶体积=所有各层异常高信号区面积之和×(层厚+层间距)。
观察CTP各参数图及DWI所示ACI灶,记录病灶部位、数目,并计算其体积。
1.4 统计学分析 采用SPSS 21.0统计分析软件。以DWI诊断结果为标准,计算CTP及各参数彩图检出ACI灶的敏感度。采用Kappa检验分析CTP与DWI检出ACI灶的一致性。以±s表示计量资料,采用t检验比较组间灌注参数的差异。以线性回归分析各灌注参数所测ACI灶体积与DWI显示ACI灶体积之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 CTP及其参数图诊断ACI灶 DWI共于58例中检出70个小病灶。CTP共检出41例、55个小病灶,其中8个为假阳性病灶,诊断敏感度为67.14%(47/70);CBV、CBF、MTT及TTP图检出ACI灶的敏感度分别为37.14%(26/70)、42.86%(30/70)、62.86%(44/70)及64.29%(45/70),见表1。一致性检验显示,CTP图与DWI诊断ACI灶的Kappa=0.33(P<0.05)。
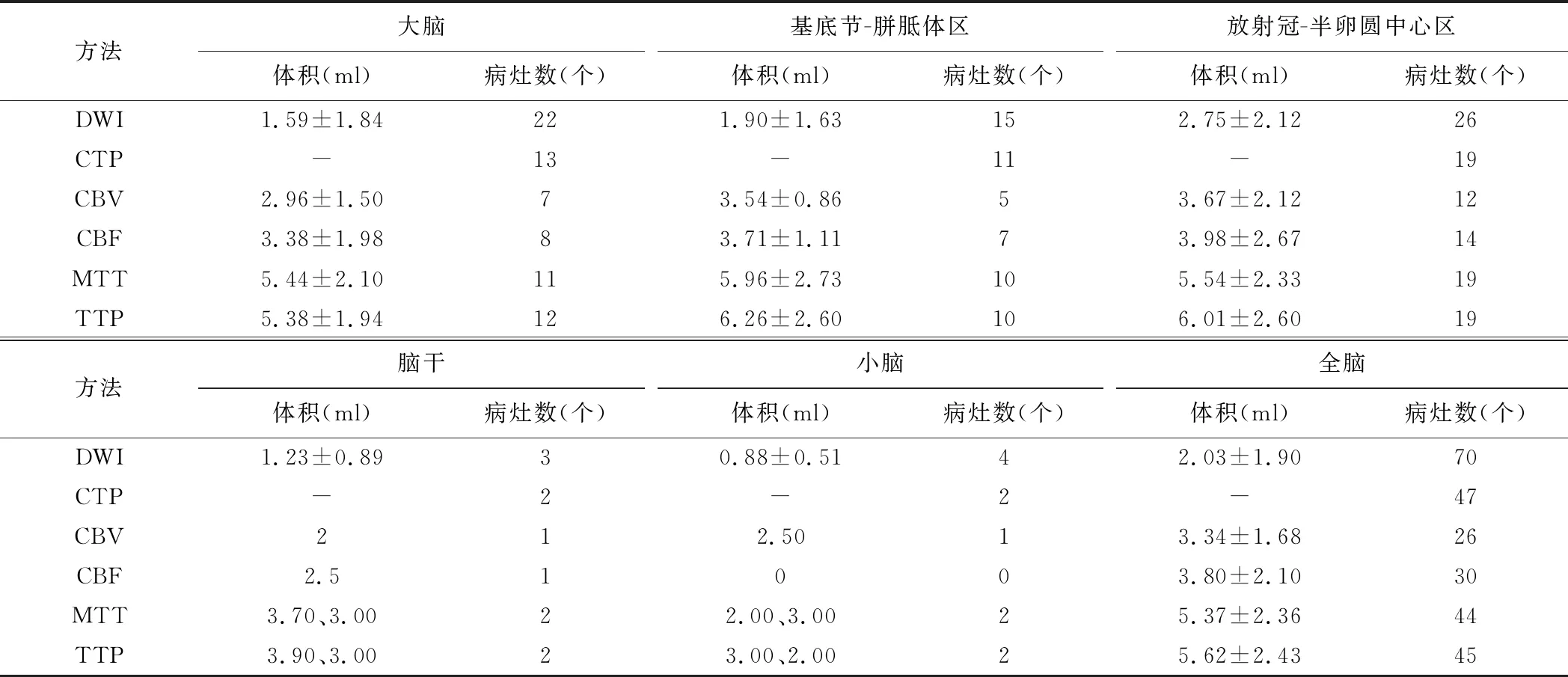
表1 比较CTP及灌注参数图于58例患者检出的ACI小病灶
2.2 核心梗死区及缺血半暗带灌注参数 70个ACI灶中,38个存在缺血半暗带。ACI灶核心梗死区CBV、CBF及MTT与其镜像区及缺血半暗带差异均有统计学意义(P均<0.01),TTP差异均无统计学意义(P均>0.05);ACI灶缺血半暗带CBF、MTT及TTP与镜像区差异均有统计学意义(P均<0.01),CBV差异无统计学意义(P>0.05)。见图1、2及表2。
表2 ACI灶核心梗死区及缺血半暗带与其镜像区的CTP灌注参数比较(±s)
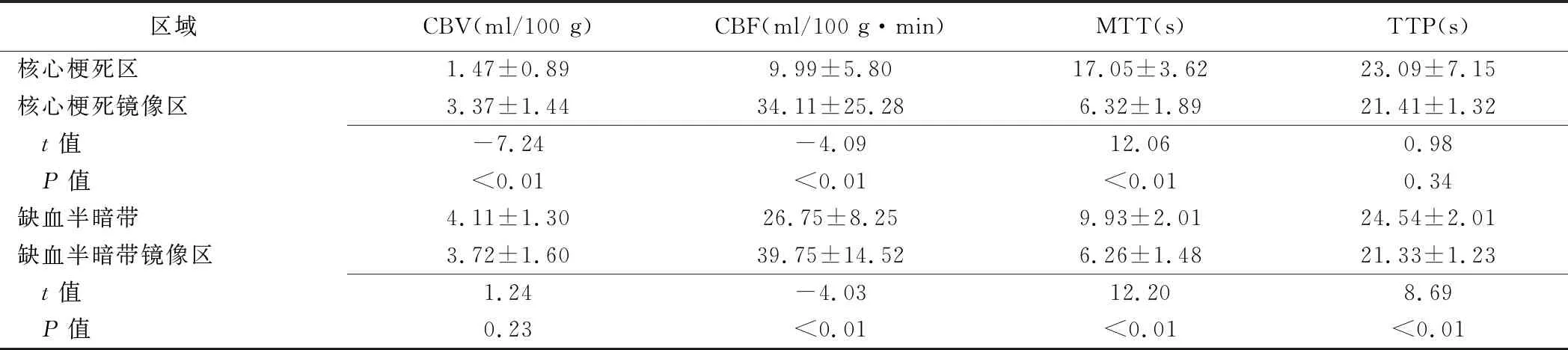
表2 ACI灶核心梗死区及缺血半暗带与其镜像区的CTP灌注参数比较(±s)
注:核心梗死区与缺血半暗带上述参数比较,t值分别为-7.52、-7.46、7.65、-0.86,P值分别为<0.01、<0.01、<0.01、0.40
区域CBV(ml/100 g)CBF(ml/100 g·min)MTT(s)TTP(s)核心梗死区1.47±0.899.99±5.8017.05±3.6223.09±7.15核心梗死镜像区3.37±1.4434.11±25.286.32±1.8921.41±1.32 t值-7.24-4.0912.060.98 P值<0.01<0.01<0.010.34缺血半暗带4.11±1.3026.75±8.259.93±2.0124.54±2.01缺血半暗带镜像区3.72±1.6039.75±14.526.26±1.4821.33±1.23 t值1.24-4.0312.208.69 P值0.23<0.01<0.01<0.01
2.3 相关性分析 CBV、CBF、MTT及TTP图估测的ACI灶体积(x)与DWI结果(y)均呈线性相关(R2=0.87、0.84、0.74、0.76,P均<0.01),回归方程分别为y(DWI)=-0.014+1.091x(CBV)、y(DWI)=0.461+0.814x(CBF)、y(DWI)=-1.122+0.713x(MTT)及y(DWI)=-1.287+0.701x(TTP)。
3 讨论
颅脑CTP能早期反映脑实质血流灌注、判断缺血部位及范围[8];CTP测量脑组织灌注定量参数可及时、准确地检出ACI。CTP诊断ACI的敏感度达80.1%,特异度为57.9%[9]。THIERFELDER等[10]观察小体积ACI,发现CTP对直径<15 mm病灶的敏感度为30.9%,而对>15 mm者的敏感度为62.2%,提示病灶直径影响CTP对ACI灶的敏感度。本研究以DWI为标准观察58例ACI 70个小病灶,CTP图共检出47个真阳性病灶,敏感度为67.14%(47/70);CTP定量参数图中,TTP图的敏感度最高(64.29%,45/70);CTP图与DWI检出小体积ACI灶的一致性一般(Kappa=0.33),可能与本研究纳入病灶体积小、样本量亦小有关。
CTP各参数图所示病灶是否匹配对评估缺血半暗带具有重要意义,通常将CBV与MTT的错配区域设定为缺血半暗带[11]。CTP参数值有利于定量分析缺血半暗带范围,为评估血管内机械血栓切除术可否使ACI患者获益提供客观依据。根据灌注参数图,在心梗死区CBF和CBV均减低、MTT和TTP均延长;而在缺血半暗带,CBF下降、MTT及TTP延长,但CBV与其镜像区无显著差异甚至升高[12];但单纯依靠灌注参数图所见判断缺血半暗带范围缺乏客观定量依据。本研究以CBV绝对值<2.0 ml/100 g及rMTT>145%为标准评估ACI灶核心梗死区及缺血半暗带,并定量分析其参数值,发现前者 CBV、CBF、MTT与其镜像区及缺血半暗带差异均有统计学意义、TTP无明显差异,后者 CBF、MTT、TTP与其镜像区差异均有统计学意义、CBV差异无统计学意义,与既往研究[13]结果相符,而核心梗死区TTP大于缺血半暗带则与其不一致;分析原因,可能本组均为小体积ACI灶,且灌注彩图与DWI所示梗死区并不完全对应,手动选取ACI灶ROI可能造成误差。
ACI致残率较高,准确评估其体积有助于准确评估病情及预后。CTP量化ACI异常灌注病变体积与MRI异常灌注的一致性较高,与DWI显示核心梗死区体积相关性最高[14];以CBF与DWI测量的核心梗死区面积具有良好相关性[15]。本研究结果显示CBV、CBF、MTT及TTP图与DWI评估的ACI灶体积均呈线性相关,CBV、CBF估测结果与DWI较接近。
综上,全脑CTP有助于诊断小体积ACI,利用其定量参数可评估ACI灶核心梗死区及缺血半暗带;CTP参数图与DWI评估的ACI灶体积具有良好相关性。本研究的局限性:①仅纳入小体积ACI,手动勾画异常灌注区ROI,难免存在误差;②脑干及小脑病灶数较少,未能分析发病部位对CTP参数的影响。

