牛支原体与大肠杆菌混合感染病例的实验室诊断
梅世慧, 王 娜, 毕文文, 张峻杰, 何广霞, 曾成容, 周碧君,2,3*, 王开功,2,3, 文 明,2,3
(1. 贵州大学动物科学学院,贵州 贵阳 550025; 2. 贵州省动物疫病研究室,贵州 贵阳 550025; 3. 贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025)
牛支原体(Mycoplasmabovis,MB)是介于细菌和病毒之间的最小原核生物,是引起牛支原体肺炎的主要病原,以呼吸困难、咳嗽、气喘等症状最为常见[1,2],还能引起乳腺炎、肺炎、关节炎、结膜炎、角膜炎等病症[3]。牛支原体病呈全球性流行,近年来我国贵州、内蒙古、西藏、宁夏等地陆续出现关于本病的报道,给养牛业造成很大的损失[4~6]。2021年7月16日,贵州省黔西南布依族苗族自治州某养牛场牛群出现高热、咳嗽及死亡病例,临床症状及病理变化疑似牛支原体或其他细菌感染。为确诊病因,采集病死牛肺脏组织进行实验室检测,现报道如下。
1 材料与方法
1.1 检测病料无菌条件下采集该场病死牛的肺脏组织1份作为检测病料,用冰袋运输至实验室,4 ℃冰箱保存备用。
1.2 主要试剂细菌基因组DNA提取试剂盒(购自天根生化科技有限公司);DL 2 000 DNA Marker、2×TaqPCR Master Mix(均购自TaKaRa公司);细菌16S rDNA通用引物、牛支原体TU基因引物[均购自生工生物工程(上海)股份有限公司];药敏试纸片、麦康凯培养基、LB琼脂、营养琼脂(均购自杭州微生物试剂有限公司)、琼脂粉(购自索莱宝生物科技有限公司)。
1.3 主要仪器双槽梯度PCR仪(型号:T20,杭州朗基科学仪器有限公司)、电泳凝胶成像仪(SYNGENE公司)、台式高速冷冻离心机(型号:ScanSpeed 1730R,丹麦LABOGENE公司)、OLYM-PUS 生物显微镜(型号:CX33,上海普赫光电科技有限公司) 。
1.4 细菌分离培养及鉴定
1.4.1 细菌分离培养无菌条件下取病死牛肺脏组织接种于鲜血琼脂培养基,37 ℃恒温箱培养 24 h,观察菌落生长情况。挑取单个典型菌落接种于营养琼脂培养基,37 ℃恒温箱纯培养24 h,并接种于麦康凯琼脂培养基,37 ℃培养24 h。挑取纯培养的单个菌落进行革兰氏染色镜检。
1.4.2 细菌鉴定及药敏试验以细菌基因组DNA提取试剂盒提取的细菌DNA为模板,使用细菌16S rDNA通用引物[7](F:5’-AGAGTTTGATCCTGGCTCAC -3’;R:5’-GGTTACCTTGTTACGACTT-3’;预扩增片段1 500 bp)进行PCR扩增。PCR反应体系 25 μL:2×TaqMaster Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA(254.61 ng/μL)2 μL,灭菌双蒸水8.5 μL。反应程序:94 ℃预变性 5 min;94 ℃变性 1 min,55 ℃退火1 min,72 ℃延伸 90 s,共35个循环;72 ℃终延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳检测,并送至生工生物工程(上海)股份有限公司测序。测序结果进行同源性比对、进化树分析,并用10种药敏试纸片对分离菌进行药物敏感性试验。
1.5 牛支原体核酸检测
1.5.1 组织样品DNA的提取取病死牛肺脏组织1 g 于灭菌研钵中,加入PBS 1 mL研磨制备匀浆,8 000 r/min 离心2 min,提取上清液,用DNA提取试剂盒提取组织总DNA,用于牛支原体核酸检测。
1.5.2 牛支原体核酸检测以提取的组织总DNA为模板,采用PCR方法对目的基因(牛支原体TU基因)进行扩增。PCR反应体系25 μL:2×TaqMaster Mix 12.5 μL,上、下游引物(P1:5’-GCTCAAGCAGGTGA CAACGCAG-3’;P2:5’-TCCAACTGTTCTACCACCTT CACGG-3’;预扩增片段351 bp;浓度均为10 μmol/L)各1 μL,模板DNA(103.45 ng/μL)2 μL,灭菌双蒸水8.5 μL。反应程序:94 ℃预变性 5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃终延伸10 min。取PCR产物8 μL于含核酸染料的1.2%琼脂糖凝胶上电泳,凝胶成像系统观察结果。
2 结果
2.1 细菌分离培养鉴定结果
2.1.1 培养菌落及菌体特征分离菌在鲜血琼脂培养基上生长呈半透明、表面光滑、圆形菌落(见图1);在麦康凯琼脂培养基上生长呈微红色、表面光滑湿润、边缘整齐、圆形菌落(见图2)。革兰氏染色镜检细菌为两端钝圆的革兰氏阴性短小杆菌(见图3)。
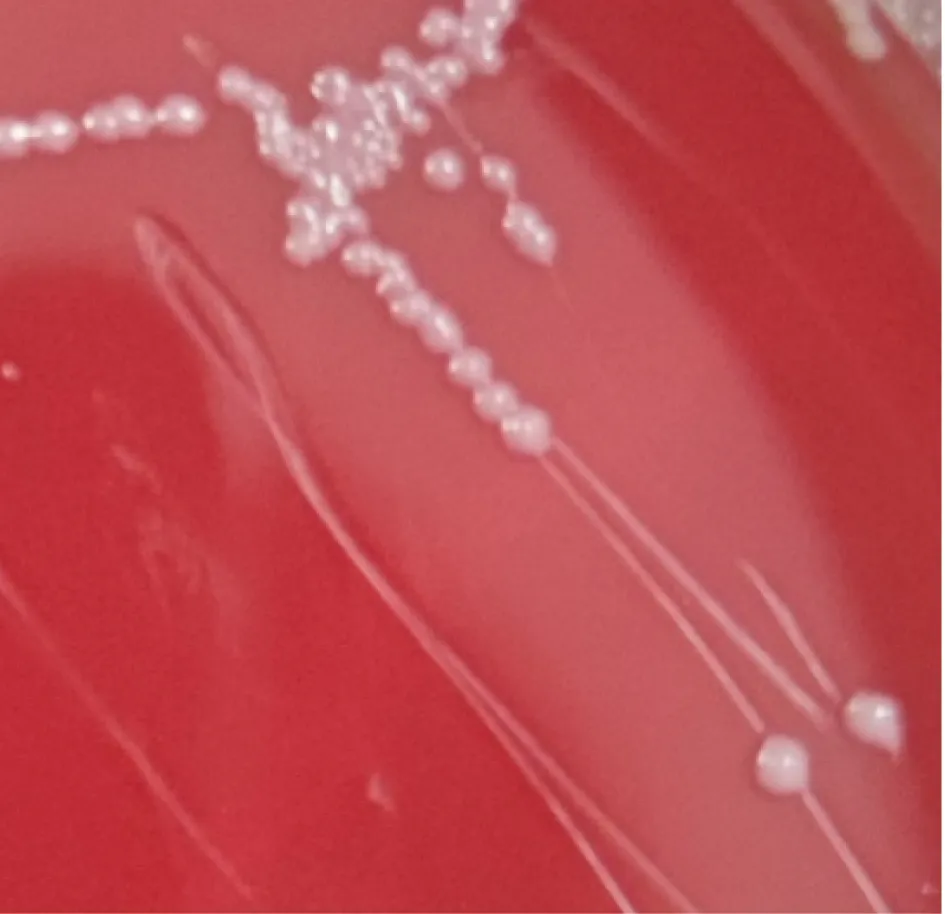
图1 鲜血琼脂培养基生长菌落
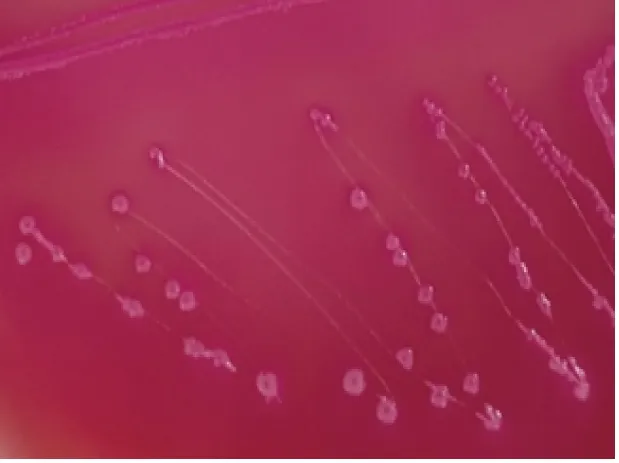
图2 麦康凯琼脂培养基生长菌落
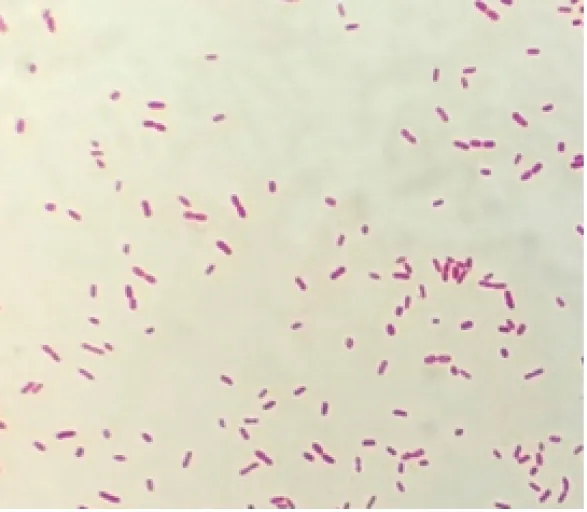
图3 革兰氏染色镜检菌体特征(10×100)
2.1.2 细菌鉴定及同源性分析分离菌PCR扩增出 1 500 bp目的条带(见图4)。应用Megline 7.1.0(44)软件将分离菌株(命名为QX202107株)测序结果与10株大肠杆菌参考菌株(OK493608.1、MN208117.1、MN208177.1、MN208097.1、KJ477005.1、MN208098.1、MN208215.1、MN208212.1、MN704427.1、MN208129.1)DNA序列进行同源性比对和系统进化树分析,结果与10株大肠杆菌的同源性均在98%以上,与KJ477005.1同源性达到99.8%,亲缘关系最近(见图5、图6)。
2.1.3 药物敏感性药敏试验结果显示:该分离菌对氨苄西林、头孢唑啉、头孢呋辛高度敏感,对卡那霉素、哌拉西林中度敏感,对新霉素、头孢哌酮、米诺环素、庆大霉素、红霉素耐药(见表1)。
2.2 牛支原体核酸检测结果病死牛肺脏组织经PCR扩增出351 bp目的条带(见图7),表明其肺脏组织中存在牛支原体感染。

M:DL 2 000 DNA Marker; 1:分离菌图4 分离菌16S rDNA PCR检测结果

图5 分离菌(QX202107株)与10株大肠杆菌同源性比对结果
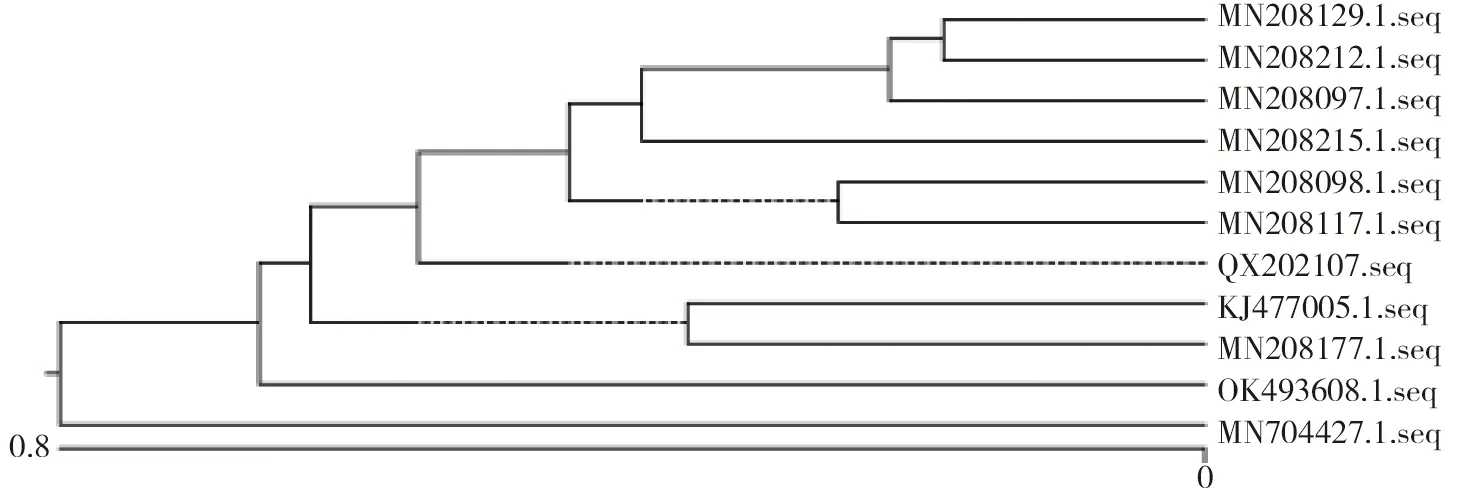
图6 分离菌(QX202107株)与10株大肠杆菌系统进化树分析

表1 分离菌药敏试验结果

M:DL 2 000 DNA Marker; +:阳性对照; -:阴性对照; 1:肺脏组织图7 牛支原体PCR检测结果
3 结论
通过细菌分离培养鉴定、牛支原体核酸检测,诊断牛场病例为牛支原体与大肠杆菌混合感染;分离的大肠杆菌对氨苄西林、头孢唑啉、头孢呋辛高度敏感,可使用该类药物进行治疗。
4 讨论
4.1牛支原体是引起牛呼吸系统疾病综合征、中耳炎、结膜炎和关节炎综合征以及生殖系统疾病的重要病原之一[8,9]。相关报道显示,美国的牛支原体感染率高达70%,欧洲25%~33%的牛肺炎症状与牛支原体有关;我国自2008年首次报道该病后,陆续有14个省(区)检测到牛支原体病原,并造成很大的经济损失[10~12]。牛支原体病应用抗生素治疗效果差,现阶段尚无有效的药物进行防治[13]。近年来虽然有关于牛支原体弱毒疫苗、灭活疫苗及亚单位疫苗的相关研究,但尚无有效的牛支原体疫苗可作为商业推广应用[14]。牛支原体病要以预防为主,其发病原因主要与应激和环境卫生有关[15]。因此平时要注重圈舍的环境卫生,定期消毒、清理粪便和垫草。此外,养殖场应尽量坚持“自繁自养”的原则,如必须从外地引入种牛,应在运输时做好饲喂和管理工作,减少应激反应[16]。
4.2牛支原体病可继发或并发多种细菌、病毒感染,从而引发以呼吸道症状为主的综合症候群[17]。如:仝晓丹等[18]报道黑龙江省某牛场的牛副流感3型病毒与牛支原体混合感染;王方国等[19]对西藏那曲地区牦牛呼吸道疾病综合征5种细菌病原的感染情况调查结果显示,牛支原体可与多杀性巴氏杆菌、溶血曼氏杆菌、睡眠嗜组织菌混合感染;吴翠兰等[20]对广西地区2016—2017年牛呼吸道疾病综合征病原学调查研究发现,该地区牛呼吸道疾病主要以牛支原体、大肠杆菌、肺炎克雷伯氏菌引发的混合感染为主。贵州省近年来养牛产业快速发展,关于本病的报道也陆续出现,且大多为牛支原体与其他病原的混合感染。如:蔺俐仲等[21]发现贵州牛支原体与巴氏杆菌发生混合感染;徐春志等[22]、尹德晶等[15]发现贵州牛支原体与附红细胞体混合感染。此次黔西南布依族苗族自治州某养牛场发生牛支原体与大肠杆菌混合感染,原因可能为病牛感染支原体后抵抗力下降,继发大肠杆菌感染。大肠杆菌属于条件性致病菌,防制的关键在于加强饲养管理,在养殖过程中做好各个环节的卫生消毒[23]。此外,大肠杆菌存在不同程度的耐药性,所以在临床治疗中应根据药敏试验结果进行用药。

