肺鳞癌合并肺肉瘤样癌变治疗1 例及文献复习
龙运芝 张湘燕 邵松军 汪国雨
1.贵州医科大学研究生院,贵州贵阳 550004;2.贵州医科大学附属人民医院 贵州省人民医院呼吸与危重症医学科,贵州贵阳 550002
最新国际癌症机构研究数据显示,肺癌是癌症中发病率与死亡率最高的恶性肿瘤[1]。肺癌按组织病理学分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),NSCLC 约占肺癌的85%,NSCLC 又包括腺癌、鳞癌和大细胞癌等多种类型,其中鳞癌占20%~30%,腺癌约占40%[2]。肺肉瘤样癌(pulmonary sarcomatoid carcinoma,PSC)属于NSCLC 中罕见的组织类型,兼有癌和肉瘤的组织学特性,占原发性肺癌的0.1%~0.4%,发现时多已发生转移,为晚期,预后不佳[3-4]。经查阅和复习相关文献,现对贵州医科大学附属人民医院(以下简称“我院”)呼吸与危重症医学科近期收治的1 例诊断为肺鳞癌合并肺肉瘤样癌变的患者相关临床资料进行整合分析,以期提高临床医生对该混合型肿瘤的认识。
1 病例资料
患者65 岁,男,因“咳嗽、咳痰20 余天”于2020 年11 月13 日入我院呼吸与危重症医学科住院治疗。有长期吸烟史,20 支/d,50 余年,未戒烟。体格检查:全身浅表淋巴结未触及。双肺呼吸音稍粗,双肺未闻及干湿性啰音。心脏及腹部查体无阳性体征。辅助检查:(2020 年11 月15 日)胸部+腹部CT 增强扫描示考虑右肺中叶中央型肺癌并右肺中叶阻塞性肺炎,右肺门淋巴结转移(图1)。颅脑MRI 平扫+增强示左侧脑室前角旁、左侧基底节区及桥脑多发软化灶并胶质增生。浅表淋巴结B 超示左颈部淋巴结最大为1.7 cm×0.4 cm,左锁骨上淋巴结最大为0.95 cm×0.34 cm。呼吸道血清肿瘤标志物示鳞状细胞癌相关抗原2.12 ng/ml,癌胚抗原2.4 ng/ml,神经元特异性烯醇化酶11.0 μg/ml,胃泌素释放肽前体56.2 pg/ml。电子支气管镜检查示右中叶开口新生物(图2)。支气管镜(右中叶)活检病理:支气管黏膜慢性炎伴较多组织变性、坏死,局灶见少许上皮样及退变梭形异型细胞,怀疑肿瘤。结合免疫组织化学染色考虑鳞状细胞癌,局灶倾向肉瘤样癌分化。免疫组织化学染色标记结果:CK 广(+)、P40(+)、P63(+)、Vimentin(梭形细胞+)、CK7(少数细胞+)、NapsinA(-)、TTF-1(-)、CD56(局灶+)、Syn(-)、CgA(-)、SMA(-)、Desmin(-)、S-100 多克隆(-)、CD34(血管+)、Ki-67(5%~30%+)(图3)。最终诊断:右侧原发性肺鳞癌(局灶倾向肉瘤样癌分化)并右肺门、左侧颈部、锁骨上淋巴结转移(T3N3MxⅢC 期)。治疗上予卡铂+白蛋白结合型紫杉醇联合卡瑞利珠单抗治疗,经上述方案治疗4 个周期后复查患者肺部增强CT结果提示肿瘤较前缩小(图4),考虑治疗有效。该患者目前仍在继续治疗和随访中。
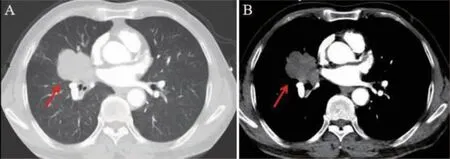
图1 肺部CT 检查结果
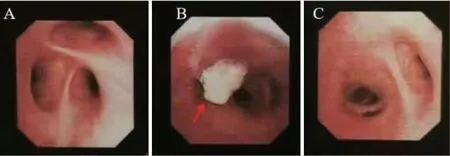
图2 电子支气管镜检查结果
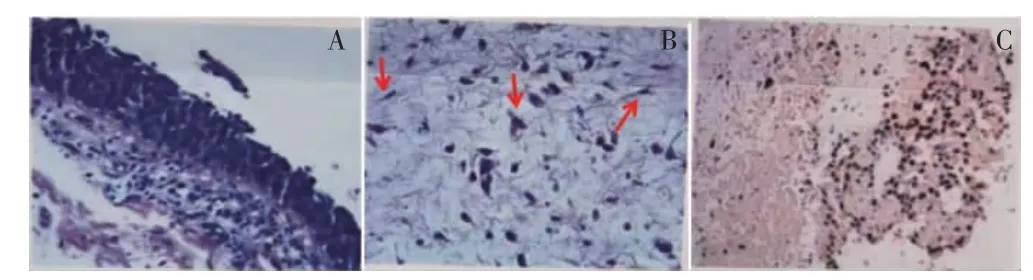
图3 支气管镜病理检查结果
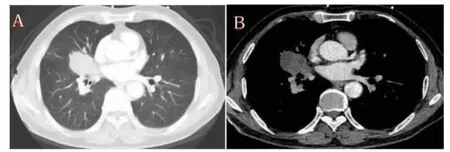
图4 经4 周期化疗后复查胸部CT 检查结果
2 讨论
肺癌严重威胁人们的健康。鳞状细胞肺癌(squamous-cell lung cancer,SqCLC)是一种相对惰性的恶性肿瘤,发现时多为晚期,且多为中央型,易合并其他心肺疾病,靶向治疗的突变罕见,使得SqCLC 治疗困难[5]。相较于其他NSCLC,SqCLC 存在更高的潜在出血风险,抗血管药物具有局限性,虽然免疫治疗可能使部分患者受益,但免疫治疗可选择的治疗药物相对较少,相关药物的临床研究尚未成熟,传统的以铂类为基础的化疗不良反应大,因此肺鳞癌的预后比肺腺癌差[2,5-6]。PSC 是一种由上皮组织和间叶组织混合形成的恶性肿瘤,以组织中含有肉瘤成分或肉瘤样分化成分(梭形细胞和/或巨细胞)为特征,具有低分化,进展迅速的特点,极少见,占原发性肺癌的0.1%~0.4%[3-4]。依据世界卫生组织对肺部肿瘤组织学分类[7-8],PSC 被分为以下5 种亚型:梭形细胞癌、癌肉瘤、多形性癌、巨细胞癌和肺母细胞瘤。美国癌症数据库资料显示[9],多数PSC 发现时已为晚期,AJCC 分期Ⅲ期、Ⅳ期分别占24%、48%,相较于其他NSCLC,PSC 的预后更差、进展更快。
PSC 同时含有癌和肉瘤成份,上皮和间质成份混合存在,并可形成移行过渡区,提示上皮和间充质分化的整体连续谱系[10]。基于PSC 的组织特点,上皮细胞和间质细胞生物学标志物均表达,因此可用免疫组织化学检测进行诊断以及鉴别。常见的上皮细胞学生物标志物主要为细胞角蛋白(cytokeratin,CK)、细胞角蛋白5/6(CK5/6)、P40 等;而间质细胞生物学标志物主要为波形蛋白(vimentin)、结蛋白(desmin)等[11-12]。本病例免疫组织化学结果显示:CK 广(+)、P40(+)、P63(+)、Vimentin(梭形细胞+)、CK7(少数细胞+)等均呈阳性表达,免疫组织化学结果提示鳞状细胞癌,局灶倾向肉瘤样癌分化,同时具有上皮细胞成分和间质细胞成分,与文献报道PSC 特点一致[11-12]。
本例病理诊断鳞状细胞癌,局灶倾向肉瘤样癌分化,为罕见混合癌,对这一类特殊的肺癌进行诊断和治疗,尤为棘手。PSC 恶性程度高、病情进展快、预后较差,有研究对PSC 患者的回顾性分析发现,预后与肿瘤大小、是否转移、有无远处转移、TNM 分期及是否能手术等因素有关,早期手术治疗可能是目前最优的治疗方案[13-14]。对于PSC 患者,首选的治疗方法是根治性手术切除,但多数患者发现时已处于肿瘤晚期,已无手术机会;即使部分患者早期发现并及时行根治性手术治疗,但术后仍存在高复发风险[15]。PSC对铂类为基础的化疗不敏感,随着分子生物学进展,靶向治疗及免疫治疗逐渐成为PSC 患者的新希望。有研究对114 例PSC 标本行高通量分析显示[16],最常见的突变为Kirsten 鼠肉瘤病毒癌基因(27.2%)、P53基因(22.2%)、表皮生长因子受体基因(22.2%)。而另一项实验结果也提示[17],Kirsten 鼠肉瘤病毒癌基因、P53 基因突变是PSC 最常见的突变,且突变负荷高于其他NSCLC。PSC 的突变研究为靶向治疗奠定了基础,上述突变均为PSC 的治疗提供了思路。免疫治疗是PSC 的另一优选,有文献报道程序性死亡配体1(programmed death-ligand 1,PD-L1)在绝大部分的PSC组织中表达,并且在PSC 肉瘤区域表达高于癌区域[18]。有研究者通过免疫组化和RNA 原位杂交方法比较PD-L1 在NSCLC 原发灶和转移灶的表达,发现PD-L1表达阳性率相似[19],程序性死亡受体-1(programmed cell death 1,PD-1)及其配体PD-L1 构成的PD-1/PD-L1 通路激活,可导致肿瘤细胞免疫逃逸,促进肿瘤进展,而抑制该通路,或许可以成为治疗PSC 的新方案[20]。
目前靶向治疗成为NSCLC 的治疗热点,尤其是肺腺癌,但是对于SqCLC,虽然基因组研究已得到客观的数据,但基因变异复杂,表皮生长因子受体基因突变率低,间变性淋巴瘤激酶融合基因重排率低,靶向治疗并未成为SqCLC 的一线治疗方案[21]。免疫治疗已成为晚期肺鳞癌患者除外放化疗及靶向治疗之外的又一重要选择。近期的研究发现,抗PD-1 受体帕博利珠单抗联合卡铂+紫杉醇或白蛋白结合型紫杉醇可提高肺鳞癌患者的疾病无进展生存期和总生存期[22],PD-L1 抗体阿替利珠单抗联合卡铂+白蛋白结合型紫杉醇方案也使PD-L1 高表达的肺鳞癌患者的无进展生存期和总生存期得到改善[23]。通过对比分析上述帕博利珠单抗联合化疗以及阿替利珠单抗联合化疗方案,帕博利珠单抗在无进展生存期和总生存期上表现更好,尤其在PD-L1 低或者阴性亚组中更为明显[24],上述研究数据表明,PD-1/PD-L1 通路可用于肺鳞癌,而PSC 含有上皮细胞癌成份,且PD-L1 在PSC 表达升高,阻断该通路可能对PSC 有益。
3 小结
本例患者SqCLC 及PSC 并存,且目前已无手术机会[25],治疗上存在巨大挑战。结合肿瘤特点及目前NSCLC 治疗进展,试着选择卡铂+白蛋白结合型紫杉醇化疗联合PD-1 抗体卡瑞利珠单抗免疫治疗,经上述方案治疗4 个周期后复查患者肺部增强CT 结果提示肿瘤较前缩小,考虑治疗有效。此患者仍在继续治疗和随访中。从该病例上学习到,肺癌有多种病理类型,且可能混合存在,在药物的选择上需充分考虑适应证及禁忌证,且临床医师应积极学习新知识,掌握学术前沿,在面对罕见病时结合文献复习依据用药,积极追踪治疗结果,为后续类似疾病治疗提供临床经验。

