煤层原位微生物群落结构和功能预测研究
牛 显,牛 煜,索永录
(1.西安科技大学 能源学院,陕西 西安 710054;2.内蒙古工业大学 矿业学院,内蒙古 呼和浩特 010051;3.山西大学 电力与建筑学院,山西 太原 030006)
煤炭是远古植物残骸经生物化学和地球化学复杂作用,逐渐形成的固体有机岩石[1]。在生物化学作用下,成煤的植物残体受到微生物及自然因素的作用首先被分解,纤维素分解成单糖类,木质素氧化成复杂的、结构多变的腐殖酸及水能溶解的苯环衍生物,并逐渐转化成为腐殖质[2],最终在覆盖沉积物和自然条件下形成煤炭。在此演化过程中,微生物是重要参与者。当下,学者们致力于探寻高效降解菌剂去模拟和放大该生物化学过程,以实现原位生物流态化采煤[2]。现有研究已证实微生物菌群与环境因素密切相关[3],但它们在煤层环境中如何分布且参与煤炭降解仍然是未知的。因此,明确不同埋深环境中优势菌和一般菌种的丰度差异,对于理解、改进并构建原位降解的复合菌剂、实现高效原位生物转化具有重要意义。
目前,煤层原位微生物群落研究主要集中于生物成因煤层气方向,研究样本取自煤矿煤样和水样,实验手段主要有16S rRNA基因文库、高通量测序、功能基因克隆文库、PCR-DGGE指纹图谱分析、实时定量PCR等分子生态学方法。其中,高通量测序以其测序量大、精准度高、成本低廉等优势,已经成为了微生物多样研究普遍适用的测序方法[4]。2007年,Shimizu等[5]首次报道了日本北部煤层中的微生物多样性,并利用16S rRNA基因文库技术对埋深843~907m煤层水样的细菌和古细菌多样性进行了研究,得到了产甲烷菌属。Rathi等[6]利用16S rRNA基因扩增方法研究了印度煤层水中微生物群落的组成;其中,细菌群落以变形菌门和厚壁菌门类群为主,古细菌群落以广古细菌门类群为主。郭红光等[7]采用高通量测序技术研究了中国柳林煤层水及储层煤岩中微生物群落多样性,发现不同采样位置的菌群存在较大差异,甲烷叶菌属是主要产甲烷菌。苏现波等[8]利用高通量测序技术全面的研究了不同地区煤样中微生物的多样性,结果表明细菌群落主要以厚壁菌门、变形菌门为主,古细菌群落主要以广古细菌门为主;同时,发现随煤阶升高细菌和古细菌群落的多样性与丰富度呈下降趋势,产甲烷菌属主要为甲烷囊菌属、甲烷杆菌属和甲烷叶菌属。
煤储层微生物菌群研究的样本主要是煤矿开采后的煤样和水样,而地质钻孔原位取样却很少。煤矿开采后采集的煤样和水样不可避免的受到人为因素影响,不能代表真实的原位煤储层菌群组成。地质钻孔取样相对保障了煤层的原位环境,是探研原位煤层微生物菌群组成的有效方式。同时,煤层微生物菌群功能预测和真菌群落组成方面的研究也较少。基于上述研究现象,本文以高通量测序法对不同埋深近原位煤样的微生物群落(细菌、古细菌和真菌)多样性,菌群组成与差异,以及菌群功能预测三方面进行了研究,为煤炭原位微生物降解和生物成因煤层气方面的研究提供有价值的生物信息。
1 材料与方法
1.1 煤样采集与理化性质
2021年4月,煤样采集于内蒙古色连二号煤矿东翼K3地质钻孔。煤样属不粘煤,其显微煤岩组分以镜质组为主,含量47.9%~92.4%,最大反射率Rmax为0.445%~0.5216%。K3钻孔勘深431.94m,在可见煤层-254m、-262.5m和-317m处,选择三组完整度较好的柱状煤样,依次编号为NF1-1,NF1-2,NF1-3。通过乙醇冲洗和再次取芯以减少地质钻孔水的干扰。采出样先用75%乙醇喷洗外表面,然后迅速装入无菌袋封口,低温箱运回实验室。在无菌超净台中,分别将三组样品沿中心破碎,取样品内芯,视为近原位煤样。然后,分别取内芯样品32.8g装入50mL无菌离心管,进行后续测试分析。依据国标GB/T 30732—2014和GB/T 31391—2015进行煤炭工业指标和元素分析。
1.2 DNA提取和PCR扩增
按照DNA提取试剂盒说明书抽提样本DNA,并用超微量紫外分光光度计检测DNA浓度和纯度,1.2%琼脂糖凝胶电泳质检DNA。在PCR仪上,细菌利用292F(5’-ACTCCTACGGGAGGCA GCA-3’)和480R(5’-CGGACTACHVGGGTWTCT AAT-3’)引物对V3-V4区进行PCR扩增;古细菌利用387F(5’-TGYCAGCCGCCGCGGTAA-3’)和480R(5’-YCCGGCGTTGAVTCCAATT-3’)引物对V4-V5区进行PCR扩增;真菌利用296F(5’- CCAGCASCYGCGGTAATTCC-3’)和480R(5’- ACTTTCGTTCTTGATYRA -3’)引物对18SV4区进行PCR扩增。PCR扩增程序:98℃预变性2min,28个循环(98℃变性15s,55℃退火30s,72℃延伸30s),最后72℃延伸10min。
1.3 扩增产物磁珠纯化回收
在25μL PCR产物中加入体积0.8倍的磁珠,充分震荡悬浮后,磁力架上吸附5min,吸出上清;再次加入20μl 0.8倍磁珠洗涤液,震荡充分悬浮后,磁力架上吸附5min,小心吸出上清液;然后,添加200μL 80%乙醇,倒置磁力架上,充分吸附后吸出上清液,静置室温5min;待酒精挥发和磁珠出现裂缝后,25μL洗脱液洗脱,并将PCR管放在吸附架上充分吸附5min,取上清液保存。
1.4 测序文库构建
利用荧光定量仪对PCR产物进行荧光定量,并根据测序量要求进行混合。测序文库构建:①文库制备试剂盒中的End Repair Mix 2切除DNA序列5’端的突出碱基,同时添加一个磷酸基团、补齐3’端的缺失碱基;②在DNA序列的3’端添加A碱基以防止DNA片段自连,同时保证目标序列能与测序接头相连(测序接头3’端有一个突出的T碱基);③在序列5’端添加含有文库特异性标签(即:Index序列)的测序接头,使DNA分子能被固定在Flow Cell上;④采用核酸纯化磁珠筛选去除接头自连片段,纯化添加接头后的文库体系;⑤对上述连上接头的DNA片段进行PCR扩增,从而富集测序文库模板,并采用磁珠再次纯化文库富集产物;⑥2%琼脂糖凝胶电泳对文库做最终的片段选择与纯化。
1.5 高通量测序
基于测序平台完成文库测序。测序步骤:①在生物分析仪上,采用安捷伦高灵敏度DNA试剂盒,完成文库质检(单峰且无接头);②在荧光定量系统上,采用检测试剂盒,完成文库定量(浓度2nM以上);③合格的各上机测序文库梯度稀释后,根据所需测序量比例混合,并经NaOH变性为单链上机测序;④利用MiSeq测序仪进行双端测序,试剂为MiSeq Reagent Kit V3。为了保证测序质量,最佳测序长度和插入片段范围应为200~450bp。
1.6 数据处理与分析
依据高通量序列筛选要求,利用FLASH软件将成对序列拼接成一条序列,经Trimmomatic软件的质控过滤,去除不合规序列,校正序列方向,完成对原始双端测序数据的优质序列筛选。利用QIIME2软件,按DADA2算法和默认参数进行序列去噪(相当于100%相似度聚类),生成ASVs(amplicon sequence variants)特征序列和特征表。采用QIIME2的classify-sklearn算法,对每个ASVs的特征序列使用预先训练好的Naive Bayes分类器进行物种分类及注释。其中,细菌和古细菌16S rRNA基因选用Silva数据库(Release132,http://www.arb-silva.de)注释,真菌18S rRNA基因选用本地化Fungene数据库(RDP整理来源于GeneBank的功能基因数据库)注释。
基于QIIME2软件,结合R语言工具包、GraPhlAn、Krona软件,对抽平后的ASV表进行分类学物种组成、Alpha多样性及物种差异进行分析。最后,依据PICRUSt2分析软件,结合功能单元PCoA分析,对基因功能潜能进行了预测。其中,功能数据库注释选用MetaCyc(统计二级功能通路丰度)和KEGG(统计二级功能通路丰度)数据库。
2 微生物群落结构和功能预测
2.1 煤样分析
结合地质资料,NF1-1、NF1-2和NF1-3煤样分别属侏罗系中下统延安组(J1-2y)第三岩段(J1-2y3)2-1下号煤层(平均厚度2.16m)、第二岩段(J1-2y2)3-1号煤层(平均厚度1.62m)和第一岩段(J1-2y1)6-1上号煤层(平均厚度1.17m)。三组样品的工业分析和元素分析见表1。
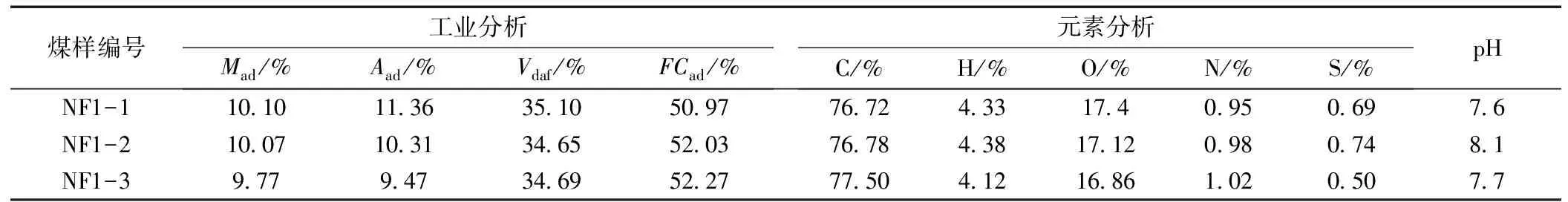
表1 煤样的工业分析和元素分析
2.2 微生物群落Alpha多样性
经测序,3个样本的细菌16S rRNA共得到218392条高质量序列量,古细菌16S rRNA得到304092条,真菌18S rRNA得到372460条。按最小序列抽平,保证样品间的可比性。在100%序列相似度下,细菌、古细菌和真菌分别划分出1663个、150个和180个ASV数。各样本文库覆盖度均达到99%以上,表明样本中绝大多数的微生物能够被获得和检测出来。此外,采用随机抽样方法构建稀释曲线,3样本的稀释曲线最终趋于平缓,说明样本所得数据量满足绝大多数物种。
对3个样本进行Alpha多样性分析结果见表2。Chao1和Observed species指数表征丰富度,两指数值越大群落丰富度越高;Shannon和Simpson指数表征多样性,Shannon指数值越大、Simpson指数值越小,则群落多样性越高;Pielou指数表征均匀度。
2.2.1 群落丰富度
在群落丰富度中(表2),对比不同埋深煤样(-254m、-262.5m和-317m)的Chao1和Observed species指数,发现微生物群落丰富度为细菌>真菌>古细菌,这与前人研究一致[9]。其中,古细菌和真菌Chao1和Observed species指数值随着煤样埋深的增加而减小,说明其真菌和古细菌群落丰富度随煤样埋深增大而降低。煤样NF1-2细菌的Chao1指数值641.8和Observed species指数值639.9最大,说明NF1-2煤样中的细菌群落丰富度最高。基于总体群落角度,微生物群落丰富度随煤样埋深增加而降低。这可能是埋深增加改变了煤层环境,特别是地压增大,导致了总群落丰富度降低;而埋深较浅煤样可能受外界环境因素大,如水文地质的影响,则群落丰富度高。Raudsepp[10]通过煤层优势群与环境优势群的对比,验证了水文地质对煤层中微生物的丰富度有显著的影响;此外,学者们还分析了煤层裂隙水的微生物功能,也表明了地下微生物的流动性[11]。
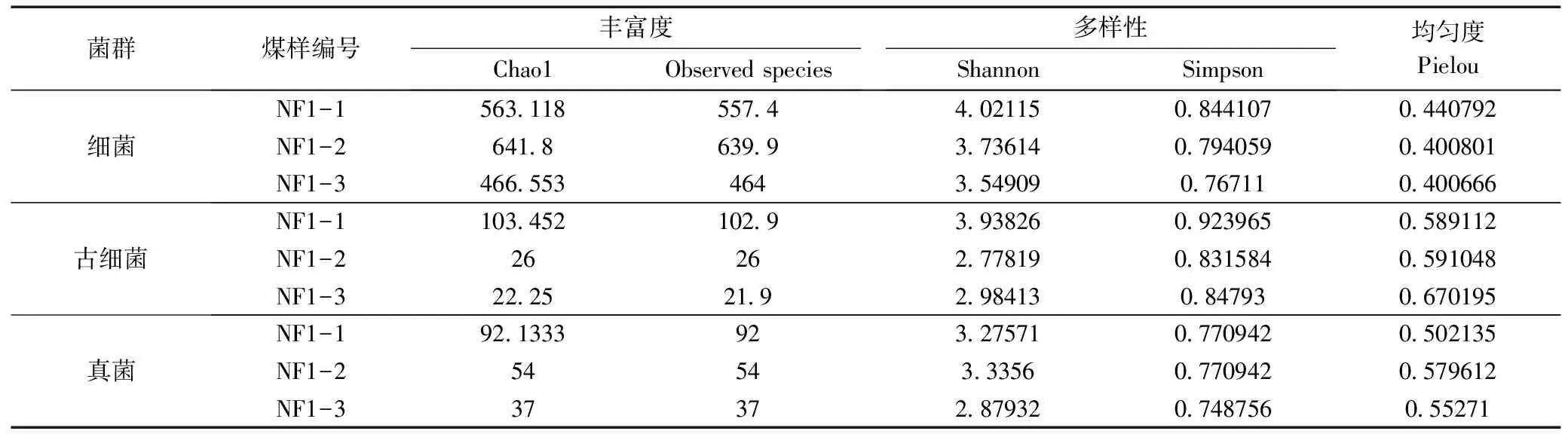
表2 微生物群落Alpha多样性指数
2.2.2 群落多样性
在群落多样性中,各煤样细菌、古细菌和真菌的Shannon和Simpson指数值见表2。经数据分析,群落多样性指数随煤样埋深无显著规律,各群落内的Pielou指数值差别不大,均匀度不显著。这说明3个煤样在各细菌、古细菌和真菌菌群内多样性差异不大,且与样品埋深无显著关系。这也表明煤样可能受外界干扰因素小,使3个煤样菌群多样性和均匀度不显著。Li等[3]针对不同埋深(-118m和-20m)混合样品(煤炭+土壤)生物群落多样性进行了研究,得到了细菌多样性差异随埋深变化大,而古细菌差异性则较小;浅层样品细菌群落多样性差异显著正是受外界干扰因素所致。在本研究中,细菌多样性随埋深差异性小。结合细菌丰富度指数,可知3个煤样细菌群落是优势群体,而不是古细菌和真菌群落,这与前人研究一致[9]。
2.3 微生物群落组成与差异
2.3.1 细菌群落组成与差异
在细菌中,3个煤样共鉴定出27门67纲159目267科468属。在门水平,3个煤样都以变形菌门为优势门,分别占84.4%、96%和94.9%丰度,如图1(a)所示。变形菌门是最大的细菌门,属革兰氏阴性菌,环境分布广泛,类群庞大,具有固氮、物质降解、生物修复等方面的重要应用价值[12]。在前人研究中,鄂尔多斯盆地煤层的细菌优势门主要是变形菌门和放线菌门[9]。本研究中,细菌优势门是变形菌门。相对煤矿开采后的煤样和水样,近原位煤样受外界干扰因素小,所以细菌优势门类可能相对单一。
在属水平中,NF1-1,NF1-2和NF1-3主要是水杆菌属为优势属,分别占36.7%,52.1%和55.3%丰度;其他菌属占比在2.6%~23.8%丰度之间,如图1(b)所示。水杆菌属是丛毛单胞菌科,伯克氏菌目,β-变形杆菌纲,最早在饮水中被发现。随后,在我国西藏温泉沉积物和台湾淡水中,分别分离得到Aquabacterium tepidiphilum[13]和Aquabacterium lacunae[14]菌种,现已有9菌种被报道。2015年,Pham等[15]从石油污染的土壤中分离得到Aquabacterium olei NBRC 110486菌株,研究发现该菌株能以汽油、柴油和煤油为碳源生长,降解率达58%。这说明煤层内可能附存有以煤炭为碳源生长,且高效降解煤炭的菌种。对于原位煤层生物降解、煤炭微生物气化和高效菌株筛选的研究具有重要的意义。
结合属水平物种组成热图(见附加材料),重点分析前5丰度(除未分类属,包括:Aquabacterium、Pelomonas、Inhella、Paucibacter和Ideonella)的属水平物种差异。水杆菌属(Aquabacterium)和Paucibacter属分布差异是随样品埋深增加,丰度也增加,最大丰度值NF1-3样品分别是55.3%和3.6%;Inhella属则随样品埋深增加,丰度降低;而嗜糖假单胞菌属(Pelomonas)和Ideonella属在NF1-2中丰度最大。整体来看,煤样细菌前5丰度的属水平物种组成差异小。随煤样埋深变化不显著,无明显的新增属或者减少属。
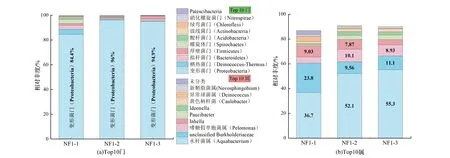
图1 近原位煤样中细菌门和属水平群落组成
2.3.2 古细菌群落组成与差异
在古细菌中,3个煤样共鉴定出6门14纲21目26科31属。在门水平,3个煤样以广古菌门(Euryarchaeota)、Asgardaeota门和泉古菌门(Crenarchaeota)为优势门。相对细菌,煤样古细菌的优势门更丰富,各煤样优势门丰度如图2(a)所示。同时,随着煤样埋深增加,广古菌门和泉古菌门丰度依次增加,Asgardaeota门丰度依次降低,而丙盐古菌门(Diapherotrites)是煤样NF1-1独有门。
广古菌门是分布广泛的古细菌一门,包括产甲烷菌、极端嗜盐菌、嗜热嗜酸菌和嗜热菌[16]。其中,厌氧产甲烷菌是学者们在煤层气领域研究的重点,已成为判别甲烷生物成因的有效数据,包括甲烷杆菌纲、甲烷球菌纲、甲烷微菌纲和甲烷火菌纲[17]。Asgardaeota门是新提出的古细菌门,它被认为是破译真核生物起源的钥匙[18]。在煤样中发现Asgardaeota门,为其分布和特征的认知起到积极作用。泉古菌门是最原始的古细菌类群,包括多种极端嗜热嗜酸菌群(如热球菌属和热网菌属)。上述古细菌门多被认为存在于极端环境,本煤样发现此三门且为优势门,说明极端环境的煤储层内存在有多样的古细菌门,并为煤炭的微生物转化研究提供更多的可能。
在属水平中,3个煤样的优势属比较分散,主要包括Odinarchaeia属、Bathyarchaeia属、甲烷杆菌属、Lokiarchaeia属、Micrarchaeia属、未分类属,具体如图2(b)所示。其中,Odinarchaeia属是新提出的古细菌属,主要被发现于缺氧的沉积物环境中(如海底沉积物),被认为是沉积物有机碳降解的关键参与者[18]。Bathyarchaeia属也是新古细菌属,环境中分布广泛,被认为在全球碳循环中扮演着重要的角色[19]。本次在近原位煤样中发现Odinarchaeia和Bathyarchaeia属,为其进一步环境分布和生态特征研究起到推动作用。同时,此两属可能涉及甲烷代谢、有机碳和芳香族化合物降解等方面功能[18,19],这为煤炭生物降解和煤层气生物成因提供了新的菌群研究。值得关注的是在煤样NF1-1和NF1-3中检测到甲烷杆菌属,丰度分别为10%和9.98%。它是产甲烷菌之一,能够厌氧代谢煤炭生成甲烷气体。目前,学者们认为不同来源样品中古细菌群落组成也不同[20]。Wawrik等[21]采集美国白垩纪果园煤系地层内11处样品,发现甲烷八叠球菌属和甲烷微菌属是主要产甲烷菌属。然而,美国粉河盆地和切诺基盆地是甲烷八叠球菌[22]。在国内研究中,山西晋城沁水盆地的产甲烷菌属包括甲烷杆菌属、甲烷微菌属、甲烷叶菌属和甲烷螺菌属,其中甲烷杆菌属为优势菌属[23];鄂尔多斯盆地产甲烷菌属有甲烷叶菌属、甲烷丝菌属和甲烷八叠球菌属[7,9]。本次鄂尔多斯盆地煤样是甲烷杆菌属,与山西晋城沁水盆地优势产甲烷菌属一致。这丰富了鄂尔多斯盆地产甲烷菌属生物信息,也说明采样地煤层中有生物转化甲烷的菌属,也为实现煤层生物甲烷化提供了可能性。
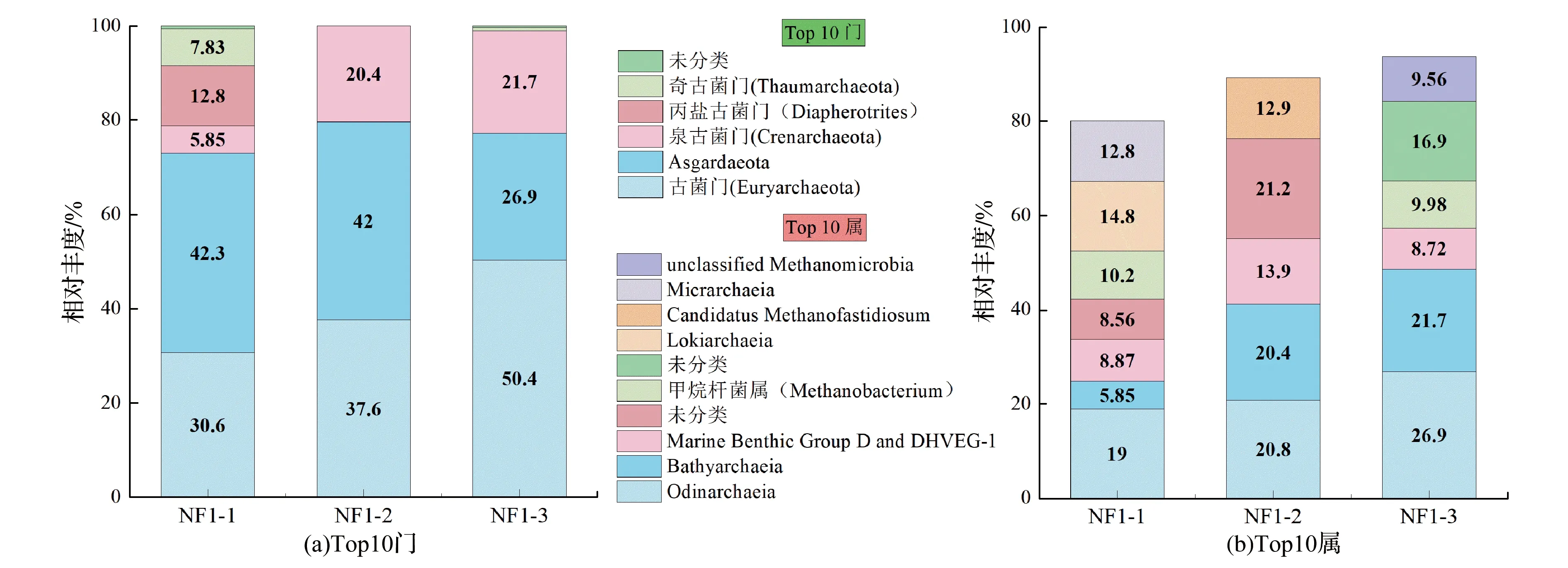
图2 近原位煤样中古细菌门和属水平群落组成
结合属水平物种组成热图(见附加材料),重点分析前5丰度(除未分类属,包括:Odinarchaeia、Bathyarchaeia、Marine Benthic Group D and DHVEG-1、Methanobacterium和Lokiarchaeia)的属水平物种差异。Odinarchaeia和Bathyarchaeia属分布差异是随样品埋深增加,丰度增加;最大丰度是NF1-3样品,分别为26.9%和21.7%。Marine Benthic Group D and DHVEG-1属在NF1-2中丰度最大。Methanobacterium属存在于NF1-1和NF1-3煤样,而Lokiarchaeia属单独存在于NF1-1。整体来看,煤样古细菌前5丰度的属水平物种组成差异大,随煤样埋深变化显著,有明显的差异和独有古细菌属。
2.3.3 真菌群落组成与差异
在真菌中,3个煤样共鉴定出20门38纲52目66科72属。在门水平,NF1-1以84%链形植物门(Streptophyta)为优势门;NF1-2和NF1-3是以链形植物门、子囊菌门(Ascomycota)和Colpodellidae门为优势门,具体如图3(a)所示。
链形植物门属绿色植物界,是由淡水中绿藻和有胚植物组成。在光呼吸途径中,通过过氧化物酶(乙醇酸氧化酶)将自身产生的过氧化氢转化为水和氧气,常被发现于池塘、土壤和石头等[24]。子囊菌门是一类高等菌物,多以陆生,营养方式有腐生、寄生和共生;其中,腐生的子囊菌能分解木材、食品、布匹、皮革及动植物残体[25]。Colpodellidae门常被发现于动物排泄物和人类血液中[26]。前人对煤层真菌群落研究较少,已报道中多以子囊菌门、担子菌门(Basidiomycota)和绿藻菌门(Chlorophyta)为优势门[27]。本次在煤层中发现的优势门将丰富真菌门类分布特征。
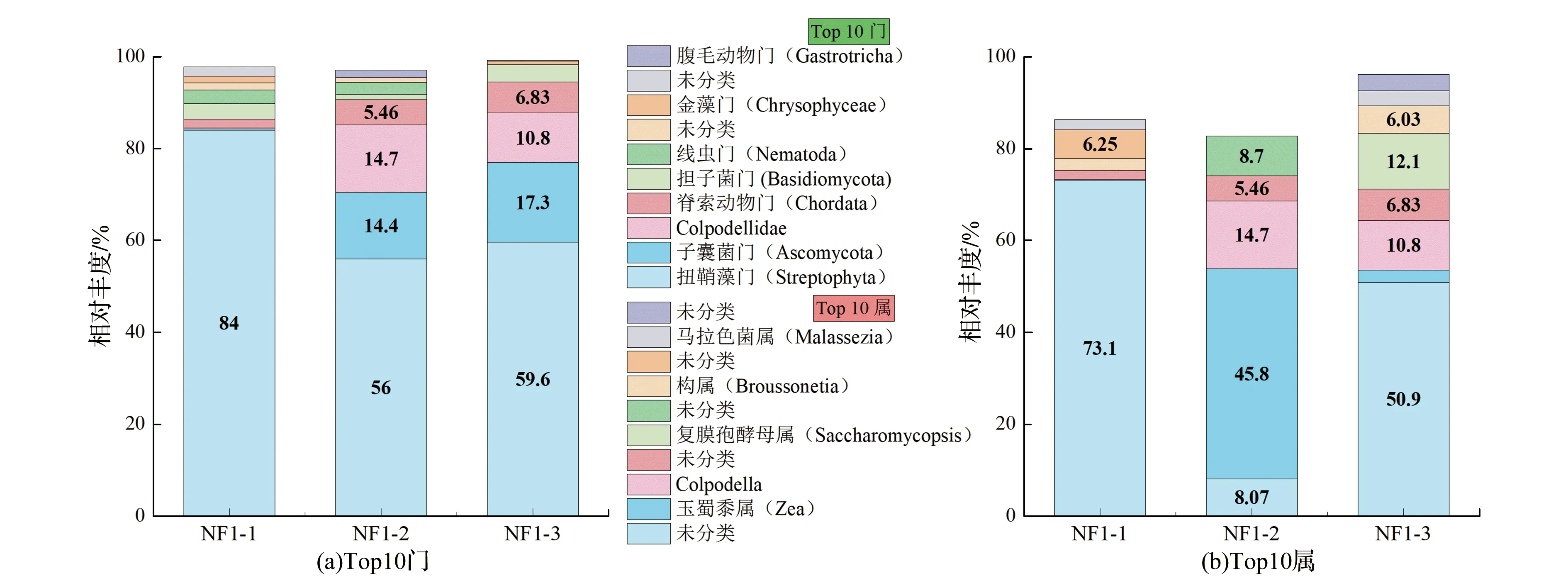
图3 近原位煤样中真菌门和属水平群落组成
在属水平中,NF1-1是73.1%未分类属为优势属;NF1-2以45.8%玉蜀黍属(Zea)和14.7% Colpodella属为优势属;NF1-3是以50.9%未分类属、10.8% Colpodella属和12.1% 复膜孢酵母属(Saccharomycopsis)为优势属,如图3(b)所示。遗憾的是NF1-1和NF1-3主要优势属未被分类。NF1-2优势属玉蜀黍属是重要禾本科谷物之一,广泛分布于世界各地[28]。本次仅在NF1-2中检测到玉蜀黍属,可能是采样时地面残留的玉米秸秆混入样品导致。
结合属水平物种组成热图(见附加材料),重点分析前5丰度(除未分类属:Zea、Colpodella、Saccharomycopsis、Broussonetia和Malassezia)的属水平物种差异。在真菌属水平中,煤样相对较高丰度中含较多的未分类属,使差异分析质量不高。整体来看,近原位煤样真菌前5丰度的属水平物种组成差异大,菌属随煤样埋深变化规律不显著,但各煤样有明显的差异和独有属。
2.4 菌群功能预测
通过Picrust2软件对煤样细菌和古细菌群落进行KEGG数据库二级功能预测,真菌群落利用MetaCyc数据库进行二级功能预测(见附加材料)。其中,KEGG通路数据库分为6大类,包括代谢、遗传信息处理、环境信息处理、细胞进程、生物体系统和人类疾病。MetaCyc数据库包括生物合成,降解/利用/同化,前体代谢物和能量的产生,聚糖途径和代谢簇。
在二级功能水平下,细菌预测30个功能,古细菌预测29个,真菌预测27个。在细菌和古细菌中,相对丰度前5位的预测功能都属代谢类通路。其中,细菌和古细菌相对丰度前4位的氨基酸代谢,碳水化合物代谢,辅因子和维生素的代谢,萜类和聚酮化合物的代谢是相同代谢。而相对丰度第5位的细菌是脂质代谢,古细菌是能量代谢。经代谢可知,细菌和真菌前五位代谢都属基本生物代谢。其中,碳水化合物和脂肪是生物的主要能源。碳水化合物代谢也称糖类化合物代谢,是微生物主要的碳源和能量来源,且有调节细胞活动的重要功能[29]。一般以葡萄糖、糖原和含糖的复合物三种形式存在。脂质是生物储能和供能主要物质,也是细胞膜的主要成份对细胞代谢和增殖至关重要[30]。而氨基酸是微生物所需蛋白质的组成,其代谢与生物的生命活动密切相关[29]。辅因子是促进酶与反应物进入活化反应,并加速酶催化反应的物质[31]。维生素是微生物所必需的某些少量有机化合物,对生物新陈代谢、生长、发育和健康有极重要作用[29]。因此,通过预测功能分析可知细菌和古细菌在煤层附存中以维持基本生命活动为主要代谢。
在真菌中,相对丰度前五位的预测功能分布于生物合成,降解/利用/同化,前体代谢物和能量的产生。它们分别是呼吸作用,脂肪酸和脂质降解,碳水化合物生物合成,核苷和核苷酸的生物合成,辅因子/辅基/电子载体和维生素生物合成。不难看出,真菌的前五位预测功能也都是维持生物基本生命的物质合成。其中,呼吸作用是细胞内有机物经酶催化后逐步氧化分解,同时释放能量的过程。而其他预测功能与细菌和真菌类似。因此,真菌在煤层附存中也是维持基本生命活动所需物质和能量。
3 结 论
原位煤样中细菌群落为优势群体,古细菌群落为弱势群体,真菌群落介于中间。其中,细菌群落以变形菌门为优势门,优势属为水杆菌属;古细菌群落以广古细菌门、Asgardaeota门和泉古细菌门为优势门,而优势属比较分散,存在有甲烷杆菌属;真菌群落以链形植物门、子囊菌门和Colpodellidae门为优势门,优势属为玉蜀黍属、Colpodella属和复膜孢酵母属。总体上,微生物群落丰富度随埋深增高而降低,而多样性规律却不明显。在预测功能中,细菌和古细菌主要以维持基本生命活动的物质和能量进行代谢,包括碳源,糖源,氨基酸和维生素;真菌以维持基本生命活动所需物质的降解、转化及合成为主要预测功能。

