NADPH氧化酶介导的ROS在特发性炎性肌病动物模型骨骼肌组织中的表达及意义*
邓蕊 柴克霞 马苗
(青海大学附属医院风湿免疫科,青海 西宁 810001)
特发性炎性肌病(Idiopathic inflammatory myopathy,IIM)是一种以肌无力和肌肉炎症为特征的异质性疾病,包括多发性肌炎、皮肌炎、包涵体肌炎、免疫介导的坏死性肌病和抗合成酶综合征[1-2];其主要表现为肌无力、肌痛,出现特征性皮疹,血清肌酶水平升高,肌肉活检显示肌纤维变性和再生、慢性单核细胞浸润及肌束周围萎缩[3]。目前IIM发病机制仍不清楚,多认为是遗传、环境、免疫机制和非免疫机制(内质网应激、活性氧的产生、自噬调节异常、缺氧、血管新生)等多因素相互作用的结果[3]。国内外多采用兔或豚鼠骨骼肌匀浆免疫诱导实验性自身免疫性肌炎(Experimental autoimmune myositis,EAM)动物模型,其操作简单、成本较低、建模效果好,为研究IIM提供了良好的基础[4-5]。
铁死亡是一种铁依赖性的,以细胞内活性氧(Reactive oxygen species,ROS)累积为特征的调节性细胞死亡形式[6]。参与铁死亡的ROS有多种产生来源,除了铁介导的芬顿反应产生ROS外,依赖NADPH的NADPH氧化酶(Nicotinamide adenine dinucleotide phosphate oxidases,NOXs)和谷胱甘肽的耗竭同样对ROS的产生起着重要作用[7]。活性氧为一系列分子氧的衍生物,主要包括非自由基(H2O2、ROOH、1O2、O3、HOCl、HOBr)和自由基(O2·-、·OH、ROO·、RO·)。适量的ROS可以促进细胞增殖、分化,参与细胞信号通路的调节;然而当ROS生成量超过机体调节能力时,则会引起炎症反应、氧化应激,从而导致细胞生理功能紊乱,触发细胞损伤或死亡[8]。研究表明,NOXs是体内ROS的重要来源,细胞通过依赖NADPH的电子还原系统将体内的氧分子还原成超氧阴离子,各种生长因子、细胞因子、炎症介质等刺激均可活化NOXs,消耗NADPH,产生大量的ROS[9]。NOXs有7种亚型,分别是NOX1、NOX2、NOX3、NOX4、NOX5、DUOX1及DUOX2,骨骼肌组织表达三种NOXs亚型(NOX1、NOX2和NOX4),NOX1在骨骼肌组织中的生理作用尚未明确,NOX2和NOX4是骨骼肌组织中ROS的主要来源[10]。有研究报道当骨骼肌组织肌管中产生大量ROS时可导致炎症细胞浸润,线粒体功能障碍,进而发生肌肉收缩功能失调、肌无力[11-12]。NOXs介导的ROS已被证实参与了代谢性疾病、自身免疫性疾病、肿瘤、动脉粥样硬化等的发生、发展过程[9,13],而在IIM中的作用尚不清楚。本研究通过检测EAM小鼠骨骼肌组织中NADPH、NOX2、NOX4和ROS的表达情况,探讨NOXs中的NOX2和NOX4介导的ROS在IIM发生和发展中的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及分组 豚鼠与BALB/c小鼠均购自西安科奥生物科技有限公司,饲养于青海大学实验动物中心,室内温度保持在22℃~25℃,湿度50%左右,明暗交替周期为12 h,每两日更换一次垫料以保持生存环境清洁干燥,每日添加饲料并更换清洁水。健康雌性豚鼠2只,体重300~350 g,用于制备豚鼠骨骼肌匀浆蛋白;健康雌性BALB/c小鼠7~8周龄,14只,体重18~22 g。本研究通过动物伦理委员会审核批准。
1.1.2 主要试剂 本研究中所选用的试剂及抗体购自南京建成生物工程研究所、武汉赛维尔生物科技有限公司及武汉博士德生物工程有限公司。
1.2 实验方法
1.2.1 豚鼠骨骼肌匀浆蛋白的制备 5%水合氯醛麻醉豚鼠,在消毒条件下立即留取其四肢骨骼肌,冰浴条件下剔除神经、血管、筋膜等组织;称重后放入4℃预冷的PBS液中,使用无菌外科剪剪碎组织,按每20 mg组织加入150 uL裂解液的比例加入裂解液,放置30 min,冰水浴中用刀式匀浆机5000 rpm进一步破碎组织,每匀浆30 s停30 s,反复多次,直至组织破碎成糊状;用生理盐水稀释后经无菌纱布过滤,收集滤液,低温离心机15000 rpm,4℃离心15 min,取上清液采用BCA蛋白定量法测定蛋白浓度,用PBS液配置其终浓度为20 mg/mL,-80℃冰箱分装保存备用。
1.2.2 建立EAM小鼠模型及分组 造模成功的判定方法 末次免疫处理一周后,通过观察小鼠的临床表现进行临床评分、检测小鼠四肢的肌力、测量小鼠体重、测定血清CK水平以及对小鼠四肢骨骼肌组织HE染色结果进行病理评级来判定造模是否成功。①临床表现评分:观察小鼠毛发的变化、姿势的改变、声音的转变等。采用Lennon等[14]临床表现评分方法:0分,无肌无力;1分,咬啮/喊叫无力;2分,休息时体位隆起,头下垂,前肢屈曲,行走震颤;3分,严重肌无力,无喊叫,体重减轻,严重的有肌肉萎缩、呼吸困难、濒于死亡(表现居中者分别评分为0.5、1.5、2.5分)。②小鼠肌力测定[15]:用翻转屏(一个50 cm2铁丝网,由直径为1 mm的金属丝组成网眼大小为12 mm2的屏障)测定肌力,将小鼠放在该铁丝网屏障中央,立即倒置屏障,使小鼠的头部下降,屏障平稳地置于垫子上方约20 cm,秒表记录小鼠掉落前持续的时间,每只小鼠连续测定5次,取平均值作为该小鼠的肌力测定值,时间越短提示肌力越差。③肌肉病理分级:依据Matsumoto等[16]肌肉组织HE染色病理学分级标准:0级,未发现病灶;1级,累及1~5个纤维;2级,累及6~30个纤维;3级,累及整个肌纤维束;4级,累及超过一个肌纤维束或整块肌肉组织(1级记1分;肌肉病变居中者可增加0.5分)。由2名经验丰富的病理专科医师采用双盲法对每只小鼠四肢的四块肌肉组织的HE染色结果进行评分,取平均值作为每只小鼠的组织病理学得分。EAM组小鼠在背部脊柱旁、尾根部及左右后肢皮下多点注射免疫混悬液(0.25 mL豚鼠骨骼肌匀浆蛋白与0.25 mL完全弗氏佐剂的混悬液),每周1次,连续注射6周,前三周免疫处理的同时腹腔注射百日咳毒素500 ng(用200 μL生理盐水稀释)。对照组小鼠在相同条件下相同部位注射同等剂量的对照混悬液(0.25 mL无菌生理盐水与0.25 mL完全弗氏佐剂的混悬液),每周1次,共注射6次。对照组6只,体重(20.25±1.29)g;EAM组8只,体重(20.48±1.13)g。两组小鼠体重比较差异无统计学意义(P>0.05)。
1.2.3 标本的采集与处理 ①血清标本:于末次免疫一周后,测量各组小鼠体重,按0.1 mL/10 g给予5%水合氯醛进行腹腔注射麻醉,经眼球取血,采血过程避免溶血,使用EP管留存1 mL,随后低温离心机3000 rpm,4℃离心10 min,离心后分离血清,采用全自动生化分析仪检测血清肌酸激酶(CK)水平。②肌肉标本:经眼球取血后,留取四肢骨骼肌,剔除神经、血管及筋膜,一部分组织置于4%多聚甲醛溶液中固定,常规石蜡包埋、制片,用于免疫组织化学法检测NOX2和NOX4及HE染色;另一部分组织立即置于液氮中冷冻数秒,随后进行组织匀浆,用于分光光度法及ELISA法分别检测NADPH和ROS。
1.2.4 HE染色检测两组小鼠骨骼肌组织病理改变 石蜡切片脱蜡脱苯至水,经苏木素染色、盐酸分化、伊红染色后,脱水透明封片,光镜下观察骨骼肌组织病理改变。
1.2.5 分光光度法检测两组小鼠骨骼肌组织中NADPH的含量 称取约0.1 g组织加入1 mL碱性提取液,冰浴研磨,95℃水浴5 min(盖紧防止水分散失),冰浴中冷却后,10000g 4℃离心10 min;取上清液至另一新的离心管中,加入等体积的酸性提取液使之中和,混匀,10000g 4℃离心10 min,取上清,严格按照说明书测定步骤加入试剂,混匀,波长570 nm,光径1 cm,双蒸水调零测定样本吸光值,代入公式计算NADPH含量。
1.2.6 免疫组织化学法检测两组小鼠骨骼肌组织中NOX2和NOX4的表达 石蜡切片常规脱蜡至水;滴加3%H2O2,37℃湿盒孵育10 min;PBS缓冲液洗3次,每次5 min;擦干,浸入0.01 mol枸橼酸缓冲液(pH6.0)中高压锅煮沸15 min;室温冷却后重复步骤三,擦干,滴加5%BSA封闭液,37℃湿盒孵育30 min;甩干勿洗,滴加一抗工作液,4℃湿盒孵育过夜;移去一抗,重复步骤三,擦干,滴加二抗工作液,37℃湿盒孵育30 min,重复步骤三;擦去多余PBS液,滴加新鲜配制DAB工作液,镜下监测染色程度,蒸馏水洗3次,每次5 min;擦干,苏木素复染,蒸馏水冲洗;1%盐酸酒精中分化数秒,蒸馏水冲洗;常规脱水、透明、干燥、封片。显微镜下观察,每张切片先在低倍镜(100×)下选取细胞密集区域,再用高倍镜(400×)拍照,随机选择10个视野,阳性染色呈淡黄色、棕黄色或棕褐色,计算阳性着色细胞占比,NOX2及NOX4主要表达在胞膜及胞浆[17]。反应结果的判断标准参照许良中[18]标准,首先将染色强度打分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色;再将阳性细胞所占的百分比打分:0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为>75%。根据两项评分乘积进行免疫组织化学染色评分,每张切片的得分取10个视野的平均分。染色强度与阳性细胞百分比的乘积>3分才算免疫反应阳性。
1.2.7 ELISA法检测两组小鼠骨骼肌组织中ROS的含量 称取约0.1 g组织加入0.9 mLPBS,冰浴条件下使用匀浆器将标本充分匀浆,低温离心机5000rpm,4℃离心15 min,收集上清液,分装后一份待检测,其余-20℃冷冻备用。

2 结果
2.1 EAM小鼠模型造模成功的结果判定 造模过程中对照组小鼠无死亡;EAM组有2只小鼠死亡,其中1只死于第4次免疫处理次日,另1只死于第5次免疫处理后2 h,其余小鼠均顺利完成造模过程。
2.1.1 小鼠临床表现、临床评分及体重变化 对照组小鼠活动姿势正常,叫声响亮,进食良好,体重稳定増长。其中有2只小鼠在第3次注射后,背部出现直径约0.3~0.5 cm的不规则区域毛发脱落,未出现硬结、红肿、破溃等现象,其余小鼠毛发整齐有光泽,未出现脱毛等现象。对照组小鼠临床评分为0分。EAM组小鼠在第2次免疫注射后背部注射部位出现毛发脱落,其中2只小鼠背部出现0.2~0.3 cm的硬结;第3次注射后,全部小鼠背部注射部位出现硬结、红肿,此时出现肌无力的表现,行走时后肢拖杳;第4次注射后,注射部位出现红肿、破溃现象,全部小鼠毛发凌乱、无光泽,进食减少,体重增长减慢或不増长,休息时背部隆起,其中一只小鼠出现严重的肌肉萎缩、呼吸急促、进食费力等症状,于次日死亡;第5次注射后,小鼠背部出现多个硬结,多个注射部位均有脱毛、破溃、流脓现象,叫声嘶哑,行走拖沓,直立困难,其中一只小鼠2 h后死亡;第6次注射后,小鼠背部大片的毛发脱落,破溃流脓现象严重,活动能力明显下降或不活动,进食费力,呼吸急促,见图1。EAM组小鼠临床评分为2.0~3.0分,平均(2.33±0.41)分。与对照组相比,末次免疫后1周EAM组小鼠体重下降,差异有统计学意义(P<0.05),见表1。
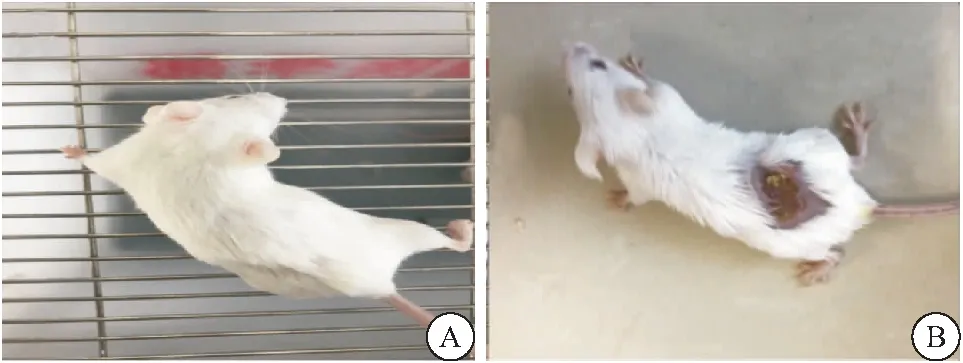
图1 两组小鼠临床表现
2.1.2 小鼠肌力测定时间及血清CK水平 EAM组小鼠肌力测定时间较对照组明显下降,差异有统计学意义(P<0.05);EAM组小鼠血清CK水平较对照组明显升高,差异有统计学意义(P<0.05),见表1。
2.1.3 小鼠骨骼肌组织病理改变及病理学评分 两组小鼠骨骼肌组织HE染色图见图2。对照组小鼠骨骼肌肌纤维大小、形态、结构基本正常,有少量炎性细胞浸润,未见肌纤维萎缩、变性、坏死。EAM组小鼠骨骼肌肌纤维大小不一、粗细不等,有大量炎性细胞浸润,可见不同程度萎缩、变性、坏死。EAM组小鼠骨骼肌组织病理学评分显著高于对照组,差异有统计学意义(P<0.05),见表1。根据造模成功的判定标准,本研究成功建立EAM小鼠动物模型。
表1 两组小鼠的体重、肌力测定时间、血清CK水平及骨骼肌组织HE染色评分结果比较
2.2 小鼠骨骼肌组织中NOX2及NOX4的阳性表达率 EAM组小鼠骨骼肌组织中NOX2及NOX4的阳性表达率均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组小鼠骨骼肌组织中NOX2及NOX4的阳性表达率结果[n(×10-2)]
2.3 小鼠骨骼肌组织中NOX2及NOX4的免疫组化评分 两组小鼠骨骼肌组织中NOX2与NOX4的免疫组化结果见图2。NOX2和NOX4在EAM组小鼠骨骼肌组织中的免疫组化评分高于对照组(P<0.05),见表3。
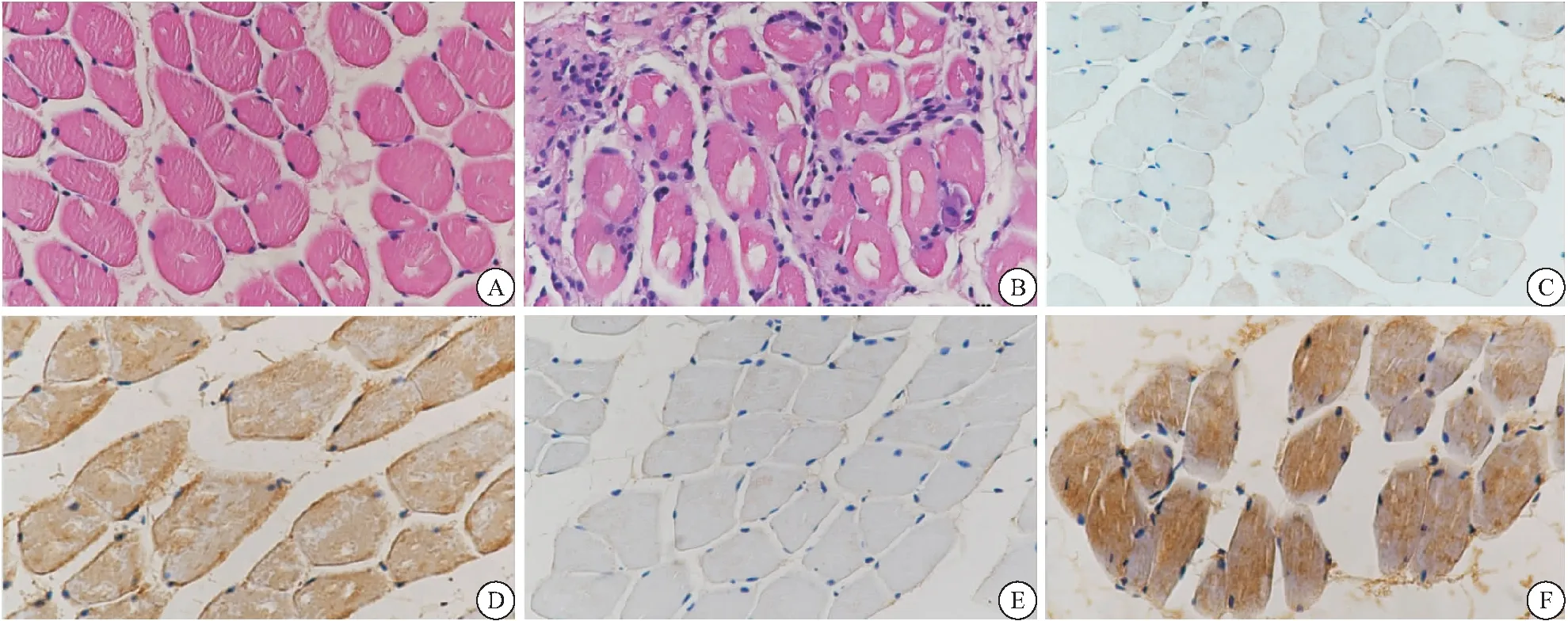
图2 两组小鼠骨骼肌组织HE染色图及NOX2与NOX4免疫组化图(400×)
2.4 小鼠骨骼肌组织中NADPH和ROS的含量 与对照组相比,EAM组小鼠骨骼肌组织中NADPH含量明显降低,ROS含量明显升高,差异有统计学意义(P<0.05),见表3。
表3 两组小鼠骨骼肌组织中NADPH、ROS的含量及NOX2、NOX4免疫组化评分结果比较
2.5 相关性分析Pearson相关分析显示,EAM组小鼠骨骼肌组织中ROS的含量与NOX2、NOX4的免疫组化评分均呈正相关,而与NADPH的含量呈负相关(P<0.05);EAM组小鼠骨骼肌组织HE染色病理学评分与NOX2、NOX4的免疫组化评分及ROS的含量均呈正相关,而与NADPH的含量呈负相关(P<0.05),见表4。

表4 EAM组小鼠骨骼肌组织中有关指标的相关性分析
3 讨论
研究证实,IIM的发病与许多特定的环境危险因素如细菌、病毒、寄生虫感染,职业性接触灰尘、气体或烟雾,紫外线照射等有关[19]。此外在IIM的发病过程中会产生大量活化的补体、致病性的自身抗体、免疫复合物及细胞因子等[20];其次,有研究显示,缺氧及血管新生也参与了IIM的发病过程[20-22]。血管新生可能是对缺氧环境做出的适应性调节,血管内皮生长因子(VEGF)是一种常见的促血管生成因子,通过与受体(VEGFR)结合上调相关基因的转录水平,诱导血管新生,而VEGF与VEGFR的结合亦可通过激活亚基Rac进而激活NOXs[23]。有文献报道NOXs是体内重要的敏感性氧感受器,在缺氧条件下也可通过促进VEGF的表达来促进血管生成,VEGF和NOXs可以相互促进彼此间的表达或激活[23-24]。本研究认为在EAM小鼠体内这些异常的刺激因素可能激活了NOXs,使得EAM小鼠骨骼肌组织中NOX2和NOX4的表达水平升高,而高表达的NOX2和NOX4介导生成高浓度的ROS,大量的ROS可降低细胞呼吸速率并减少ATP的产生,造成细胞内能量不足、线粒体功能障碍及关键肌肉组分的损伤,从而诱导骨骼肌组织萎缩及功能丧失,并参与维持骨骼肌组织的炎症进展。
NADPH是细胞内抗氧化防御系统不可或缺的组成成分,在细胞防御ROS氧化性损伤方面起着重要作用[25]。有研究发现,细胞内NADPH的水平是铁死亡敏感性的生物标志,在铁死亡发生过程中,NADPH的水平降低,而高水平的NADPH则会抵抗铁死亡的发生[26]。铁死亡的发生需要一定水平的NADPH作为电子供体,产生ROS;而在铁死亡发生过程中,NADPH提供了电子被还原成NADP++H+,因此NADPH的水平下降;正常生理情况下,NADPH的分解与合成处于相对平衡状态,而在炎症、疾病等条件下,NADPH更倾向于在NOXs的作用下产生ROS,诱发铁死亡[27]。本研究认为在EAM小鼠体内NADPH一方面被消耗,用于产生ROS诱导铁死亡,并且NOXs活化越多,NADPH消耗越多,随之生成的ROS水平越高;另一方面,NADPH还可以被高水平的ROS氧化,从而造成NADPH含量进一步降低。而对照组小鼠相比于EAM组小鼠,体内的炎症介质、细胞因子、抗体补体等成分较少,因此NOXs可能处于静息状态,从而NADPH的水平处于氧化还原平衡状态,ROS的含量也维持在生理水平。
有文献报道,在疾病状态下,NOX2参与了肌营养不良、肌纤维萎缩和收缩功能障碍的病理生理学进展[11,28],NOX4介导产生的超氧化物通过过氧亚硝酸盐和瞬时受体电位阳离子通道等机制诱发骨骼肌肥大[29];其次,活化后的NOX2和NOX4,通过消耗NADPH,介导产生大量ROS,高浓度的ROS可直接作用于脂质、DNA和蛋白质等生物大分子,造成脂质过氧化、诱导基因突变和蛋白质变性,除此以外,还可损伤线粒体、内质网及溶酶体等重要细胞器的功能,激活NF-κB信号通路,导致细胞内的氧化损伤及炎症反应,诱导铁死亡发生[30];再次,炎症反应、受损的生物大分子及细胞器介导产生的细胞因子与炎症因子又会进一步激活NOX2和NOX4,生成更多的ROS,对ROS的产生发挥正反馈作用并引发氧化损伤级联反应及炎症级联反应,同时诱导细胞铁死亡反应程度愈加强烈。因此在EAM小鼠骨骼肌组织中,NOX2/NOX4的表达水平越高,NADPH被大量消耗,ROS的含量越多,细胞铁死亡反应越强,体内氧化还原反应严重失衡,骨骼肌组织炎症反应越显著、损伤程度越严重。本研究发现EAM组小鼠骨骼肌组织中NOX2、NOX4的表达及ROS的含量均较对照组升高,而NADPH的含量较对照组降低;与此同时,本研究还发现EAM组小鼠骨骼肌组织中ROS的含量与NOX2、NOX4的免疫组化评分均成正相关,而与NADPH的含量成负相关;此外,EAM组小鼠骨骼肌组织HE染色病理学评分与NOX2、NOX4的免疫组化评分及ROS的含量均成正相关,而与NADPH的含量成负相关。以上结果提示铁死亡相关的NOXs介导的ROS可能参与了IIM的发病过程,并在IIM肌肉组织的损伤中发挥重要作用。
NOXs介导的ROS可能通过铁死亡途径参与了IIM的发病过程,并且NOXs可能是通过消耗NADPH产生大量的ROS,导致组织细胞的氧化性损伤并诱导铁死亡反应来参与IIM的发病。这为深入研究IIM的发病机制提供了新的方向。但是由于IIM的发病机制相对复杂,且本研究样本量较小,故还需扩大样本量并增加NOX2、NOX4和ROS的抑制剂进一步研究探讨NOXs介导的ROS在IIM发病机制中的作用及意义。
4 结论
NADPH氧化酶中的NOX2和NOX4可能通过消耗NADPH产生大量的ROS,导致组织细胞的氧化性损伤并诱导铁死亡反应来参与IIM的发病。NADPH、NOX2、NOX4和ROS有望成为新的评价IIM肌肉组织损伤程度的指标。

