氯化钙改性硅胶吸湿材料的制备及性能研究
杨欢,宋阳曦,徐淑权,杨森,向芮萱,郑中燕
氯化钙改性硅胶吸湿材料的制备及性能研究
杨欢1,宋阳曦2,徐淑权1,杨森1,向芮萱1,郑中燕1
(1.中国兵器工业第五九研究所,重庆 400039;2.驻重庆地区第六军事代表室,重庆 400039)
针对水溶液改性硅胶基质易破裂,普通硅胶吸水率不高等问题,采用氯化钙醇溶液浸渍法制备不同浓度的氯化钙改性硅胶吸湿材料。对比采用氯化钙水溶液和醇溶液制备的氯化钙改性硅胶吸湿材料的外观质量;采用气体吸附法测试等温吸附脱附曲线,基于吸附理论和FHH模型获得氯化钙改性硅胶吸湿材料孔隙参数和分形维数;采用静态吸附法获得水蒸气静态吸附曲线,根据准一级和准二级动力学模型建立适用于氯化钙改性硅胶吸湿材料的吸附动力学方程。采用氯化钙醇溶液浸渍制备的氯化钙改性硅胶吸湿材料的破裂程度明显减少;比表面积和孔容随氯化钙含量的增加而减小,孔径变化较小;吸湿量随氯化钙含量的增加而增加。在模拟吸附过程中,准二级动力学模型相关系数更高,因此能更好地模拟吸附动力学过程。采用质量分数为25%的氯化钙醇溶液制备的氯化钙改性硅胶吸湿材料的吸湿率最高、基质破裂率较低、再生能力优异,具有良好的应用前景。
硅胶;氯化钙;改性;分形特征;吸附量;吸附动力学
一些金属构件长期处于高湿环境中会发生锈蚀,此外高湿环境极易滋生霉菌而使材料变质,因此常用吸湿材料控制环境湿度。常用吸湿材料包括物理吸湿材料、化学吸湿材料两大类,其中化学吸湿材料因性能不稳定易液解而不常用,常用的物理吸湿材料包括硅胶、分子筛、活性氧化铝等,硅胶因其再生温度低、无毒无味无腐蚀性、物理化学稳定、热性能稳定等优点被广泛应用于各个行业,但吸湿量较低无法满足轻量化要求。单一的硅胶与氯化钙皆存在一定局限性,二者复合既可更好地固定吸湿溶解后的氯化钙,一定程度上避免氯化钙流出硅胶表面,还可提高吸湿量[1-2]。陈福康等[3]提出了一种由氯化钙和粗孔硅胶制备的复合吸附剂,制备的复合吸附剂吸附量最高可达28.3%;刘岩等[4]研究了氯化钙和粗孔硅胶制备的复合吸附剂的吸附脱附性能,从脱附热角度研究硅胶的解吸特性;朱培怡等[5]用氯化镁改性硅胶制备复合干燥剂,在相对湿度为20%~90%条件下研究其吸附脱附性能。以硅胶为基质的吸湿材料已有许多学者研究过,但多采用水溶液浸渍法制备,该方法在制备过程中易导致硅胶破裂,破裂后的硅胶固定吸湿溶解氯化钙的能力会降低。以硅胶为基质,采用醇溶液制备法制备吸湿材料,既使制备的材料具有较高的吸湿性能,又可减少制备过程中硅胶破裂的概率。
1 实验
1.1 原料与仪器
主要材料:硅胶(在室温和相对湿度分别为30%、50%、70%、90%的条件下,饱和吸湿量分别为10.11%、17.84%、37.44%、52.34%),青岛海洋化工有限公司;无水氯化钙(分析纯)和无水乙醇(分析纯),重庆川东化工有限公司。
主要仪器:JM–A10002电子天平,余姚市纪铭校验设备有限公司;CS101–3EB电热鼓风干燥箱,重庆四达试验设备有限公司;JP–020超声波清洗机,深圳市洁盟清洗设备有限公司;DF–101型集热式磁力搅拌器,上海力辰仪器科技有限公司;HUT701P高低温湿热试验箱,重庆哈丁科技有限公司;ASAP2460全自动比表面积及孔隙度分析仪,麦克默瑞提克(上海)仪器有限公司。
1.2 氯化钙改性硅胶吸湿材料的制备方法
氯化钙改性硅胶吸湿材料制备流程见图1,配方见表1。以S25为例,首先称量一定量的硅胶,在110 ℃下干燥6 h,冷却待用;然后制备质量分数为25%的氯化钙醇溶液;接着将100 g硅胶浸渍于150 g醇溶液中,先超声0.5 h再浸渍36 h;再将浸渍混合物过滤并在70 ℃下干燥2 h;将干燥前驱体放置于温度为(40±2)℃、相对湿度为(90±2)%环境中吸湿直至样品表面不再有液体溢出;最后将液解产物于110 ℃下活化6 h,得到氯化钙改性硅胶吸湿材料。

图1 氯化钙改性硅胶吸湿材料制备流程
表1 氯化钙改性硅胶吸湿材料配方

Tab.1 Formula of calcium chloride modified silica gel hygroscopic materials
注:硅胶与氯化钙醇溶液投料比为2∶3。
氯化钙改性硅胶吸湿材料在制备过程中会产生乙醇废液和废气,由于氯化钙醇溶液较难分离,所以采用对氯化钙醇溶液进行加热的方法,使其挥发后使用水做喷淋液进行回收再利用乙醇废气。
1.3 比表面积与孔径测试
将吸湿材料置于ASAP2460全自动比表面积及孔隙度分析仪中,于温度为77 K条件下测试氮气吸附脱附曲线,并基于BET理论计算吸湿材料比表面积,采用Kelvin方程的BJH方法计算吸湿材料孔容和孔径分布。
1.4 氯化钙改性硅胶吸湿材料吸湿性能测试
常采用吸湿量、吸湿速率等指标对吸湿材料的吸湿性能进行评价分析。文中通过测定氯化钙改性硅胶吸湿材料的吸湿量随时间的变化情况来分析其吸湿性能,具体如下。
1)将氯化钙改性硅胶吸湿材料在110 ℃的干燥箱中干燥3 h。
2)将高低温湿热试验箱的温度设为25 ℃,相对湿度设为要求值。
3)将氯化钙改性硅胶吸湿材料从干燥箱中取出称量后放入高低温湿热试验箱中,每隔0.5 h称量氯化钙改性硅胶吸湿材料的质量并记录,当相邻时间质量变化不超过0.1%时,则认为其达到饱和。
4)将干燥后的氯化钙改性硅胶吸湿材料放入高低温湿热试验箱内,改变相对湿度,重复步骤3,如此反复操作,每个样品测试的相对湿度分别为30%、50%、70%、90%。
氯化钙改性硅胶吸湿材料的吸湿量可用式(1)计算[6-7]。

式中:e为氯化钙改性硅胶吸湿材料平衡吸湿量,%;和1分别为氯化钙改性硅胶吸湿材料吸水前后的质量,g。
1.5 氯化钙改性硅胶吸湿材料再生性能测试
吸湿材料多次使用后吸水性能会逐渐下降,再生后吸水量可作为考察硅胶再生性能的指标。吸湿材料再生性能测试步骤:将吸水饱和后的氯化钙改性硅胶吸湿材料放入干燥箱内,在110 ℃下加热6 h,脱除其表面物理吸附水,得到干燥状态的氯化钙改性硅胶吸湿材料;多次测试并记录吸湿材料再生后的吸湿量。
2 结果与讨论
2.1 氯化钙改性硅胶吸湿材料的氯化钙搭载率计算
氯化钙改性硅胶吸湿材料中氯化钙搭载率可以反映硅胶的浸渍程度。氯化钙改性硅胶吸湿材料中氯化钙的搭载率计算见式(2)[8]。
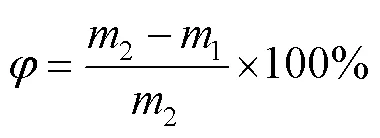
式中:2为浸渍完成并干燥后氯化钙改性硅胶吸湿材料的质量;1为浸渍前干燥后样品的质量。
文中共制备了5个样品,氯化钙的质量分数见表2。由表2可知,随着氯化钙醇溶液中氯化钙质量分数的增加,氯化钙搭载率也增加。当醇溶液氯化钙质量分数超过15%时,搭载率涨幅减小。
表2 氯化钙改性硅胶吸湿材料中氯化钙搭载率

Tab.2 Calcium chloride carry rate in calcium chloride modified silica gel hygroscopic materials
2.2 氯化钙改性硅胶吸湿材料破裂程度比较分析
采用氯化钙水溶液和氯化钙醇溶液分别浸渍硅胶所得的氯化钙改性硅胶吸湿材料分别见图2a和图2b。水溶液浸渍法制备的吸湿材料破裂率超过了97%,而醇溶液浸渍法制备的氯化钙改性硅胶吸湿破裂率约为3%,这是因为硅胶吸附氯化钙水溶液的原理是硅胶表面羟基与水分子形成氢键,硅胶吸附氯化钙醇溶液的原理是表面羟基与乙醇形成氢键,而羟基与水分子形成的氢键结合力更大,释放的吸附热更大,产生的热应力更大,所以导致硅胶破裂更多[8]。醇溶液改性的硅胶结构更加完整,在利用空隙结构容纳氯化钙时,对氯化钙吸湿强化效果更好,对氯化钙固定效果更好,这大大减小了液解的可能。

图2 氯化钙改性硅胶吸湿材料外观图
2.3 氯化钙改性硅胶吸湿材料结构分析
2.3.1 孔径分布及结构参数
氯化钙改性硅胶吸湿材料对氮气的吸附脱附等温线见图3,氯化钙改性硅胶吸湿材料的孔径分布曲线见图4。由图3可知,氯化钙改性硅胶吸湿材料吸附皆属于Ⅳ型吸附,吸湿材料的氮气吸附曲线在低压范围(/0<0.1)内有一定增加,此时发生微孔吸附,但氮气吸附量不大,这说明吸湿材料内部有少量微孔分布。
氯化钙改性硅胶吸湿材料的氮气吸附量在0.5</0<0.8范围内,随着相对压力的增加而迅速上升,这说明吸湿材料的介孔分布较为丰富。从吸附等温脱附曲线可知,吸湿材料的吸附等温线和脱附等温线未重合,且脱附等温线位于吸附等温线的上方,产生了吸附滞后现象,这是因为吸湿材料表面产生了毛细管凝聚,这再次说明了吸湿材料介孔分布丰富。由图4可知,氯化钙改性硅胶吸湿材料孔径主要分布在2~8 nm内,主要为介孔分布,与氮气吸附脱附曲线分析结果一致[9-11]。
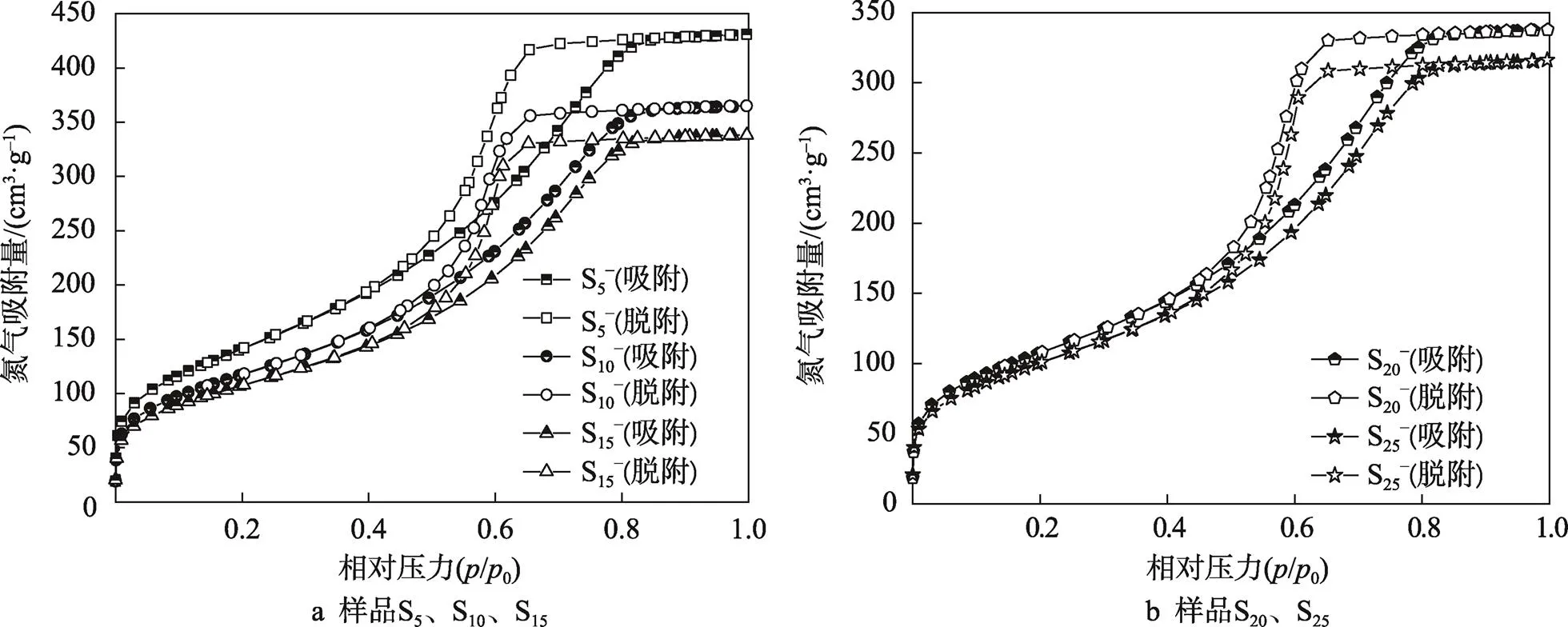
图3 氯化钙改性硅胶吸湿材料氮气吸附和解吸等温线
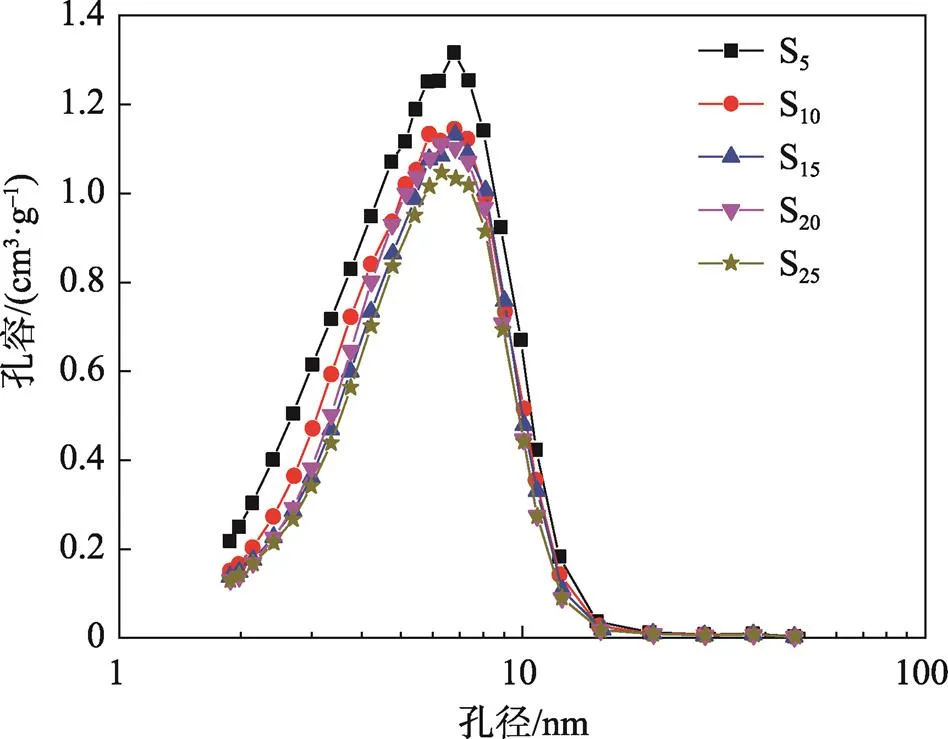
图4 氯化钙改性硅胶吸湿材料孔径分布曲线
氯化钙改性硅胶吸湿材料的结构参数见表3。由表3可知,平均孔径不受氯化钙含量影响。随着氯化钙含量的增加,吸湿材料的比表面积和孔容减小,这主要是因为氯化钙进入到硅胶孔隙结构中造成部分孔隙变小,使得内表面积降低,从而导致比表面积减小。
表3 氯化钙改性硅胶吸湿材料孔隙结构参数

Tab.3 Pore structure parameter of calcium chloride modified silica gel hygroscopic materials
2.3.2 分形特征
孔隙分形特征就是用统计学方法分析孔隙的非均匀性,文中主要采用FHH模型方法计算出分形维数,定量分析硅胶非均匀性。利用液氮吸附曲线中的相对压力和吸附量,对吸湿材料分形维数进行计算,其模型为[12-14]:

式中:为平衡压力下所对应的吸附气体体积,cm3;m为单分子层吸附气体体积,cm3;为常数;为分形维数的相关系数;0为气体吸附饱和蒸气压,MPa;为平衡压力,MPa。
由吸附脱附曲线可知,氯化钙改性硅胶吸湿材料在/0>0.5范围内出现了回滞环,这说明吸湿材料的氮气吸附脱附曲线在不同分压条件下反映出不同的孔隙特征,因此在计算时以分压0.5为界限,以ln[ln(0/)]、ln为轴和轴,利用最小二乘法原理计算斜率(图5),再利用公式=+3计算分形维数(表4)。
蓝墨云课堂是基于智能手机的APP类型的课堂教学管理系统,由于目前市面上智能手机主要是安卓系统和IOS系统,APP系统的开发不能跨平台,所以分为安卓和IOS两种APP系统。基于微信平台的公众号的功能受限于微信平台,而单独开发的APP系统功能上就比公众号强大,更能满足功能复杂的用户需求,不过APP的开发成本高,开发周期长。
由表4可知,氯化钙改性硅胶吸湿材料的表面分形维数1为2.30左右,5种材料的分形维数接近,说明这些吸湿材料表面粗糙程度基本在同一水平;5种材料的结构分形维数2为2.90左右,说明这些材料的结构复杂程度也在同一水平。由分形理论可知,分形维数与孔径结构的复杂程度相关,分形维数越接近于2,孔隙表面越光滑,结构越简单;分形维数越接近3,孔隙表面越粗糙结构越复杂,因此这些吸湿材料表面较为光滑,结构较为复杂[15]。
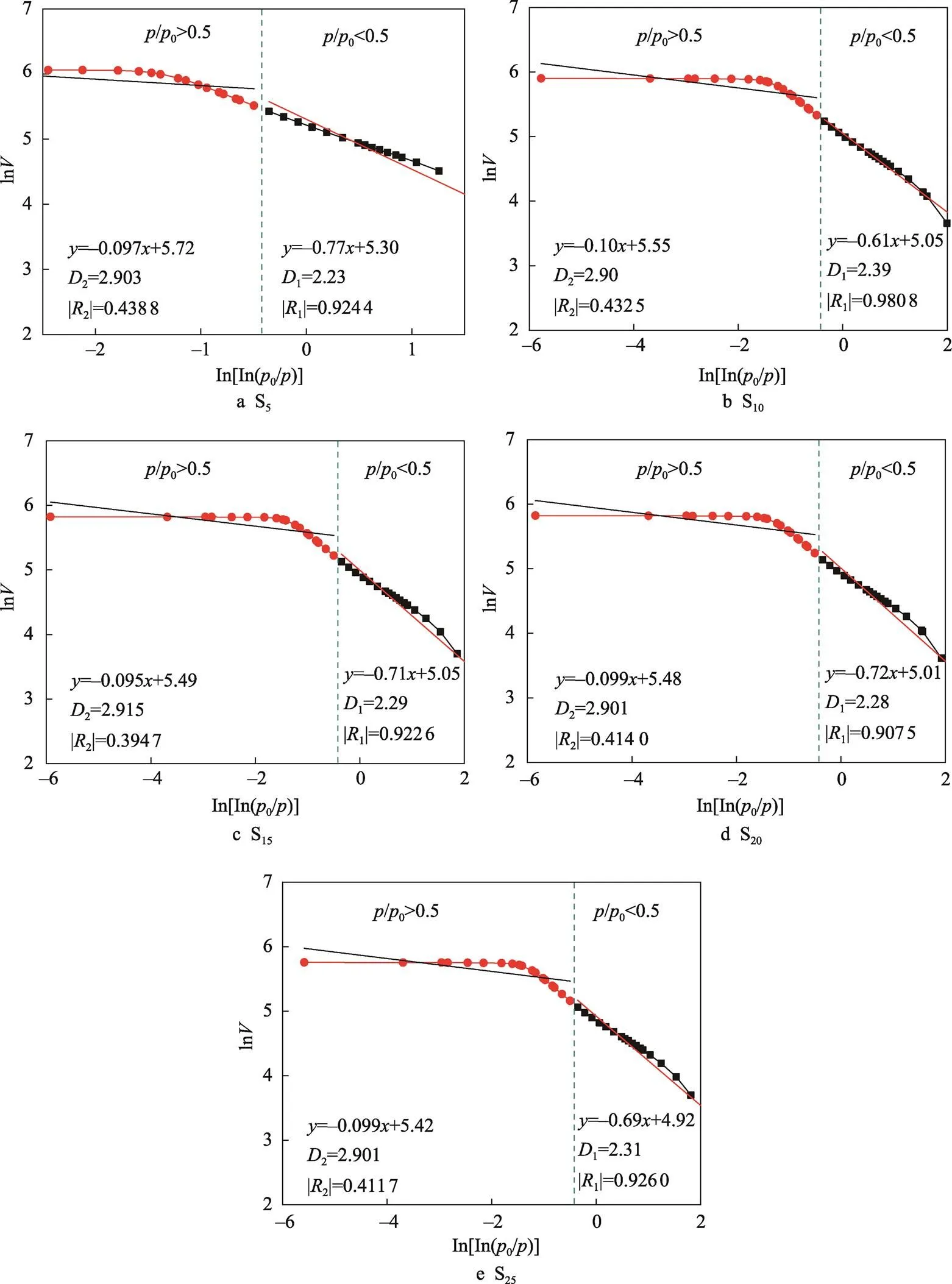
图5 氯化钙改性硅胶吸湿材料FHH模型分形维数
2.4 氯化钙改性硅胶吸湿材料吸附性能分析
2.4.1 静态吸附性能分析
氯化钙改性硅胶吸湿材料在不同相对湿度下对水蒸气的静态吸附动力学曲线见图6。在初始阶段,吸湿量随时间的增加而增大,之后吸湿量的增幅有所减弱。这可用碰撞概率来解释,在吸湿初始阶段氯化钙改性硅胶吸湿材料孔内所有吸附位点均处于空位状态,水分子击中吸附空位的概率较大,随着吸附过程的进行,吸附空位逐渐被占据且越来越少,水分子击中空位的概率越来越小,吸湿量的增幅逐渐减小直至饱和[4]。
氯化钙改性硅胶吸湿材料的吸湿量随氯化钙搭载率的增加而增加,其原因与硅胶、氯化钙吸附机理有关:硅胶通过范德华力将水蒸气吸附到硅胶的孔壁上,氯化钙水合物与水蒸气进行络合反应(CaCl2·2H2O+H2O→CaCl2·H2O),实现了水蒸气的化学吸附。由前述可知,氯化钙进入到硅胶孔隙结构中会覆盖住硅胶表面部分羟基,造成物理吸附的降低;通过对氯化钙和硅胶的饱和吸附量进行测定发现,在温度为25 ℃、相对湿度为30%条件下氯化钙平衡吸湿量为110.8%;硅胶在温度为5 ℃和相对湿度分别为30%、50%、70%、90%条件下,平衡吸湿量分别为10.11%、17.84%、37.44%、52.34%,因此可知氯化钙对水分子的化学吸附作用远大于硅胶对水分子的吸附作用。氯化钙含量越大,化学吸附效果越好,此时化学吸附增效大于物理吸附降效,从而使得吸湿量大幅提升,另外氯化钙分散于硅胶孔隙结构中,增加了氯化钙与水蒸气的接触面积,这也有助于氯化钙改性硅胶吸湿材料吸湿性能的提高[16-18]。
表4 氯化钙改性硅胶吸湿材料BET及FHH模型分形结果

Tab.4 Fractal results of calcium chloride modified silica gel hygroscopic materials by BET model and FHH model
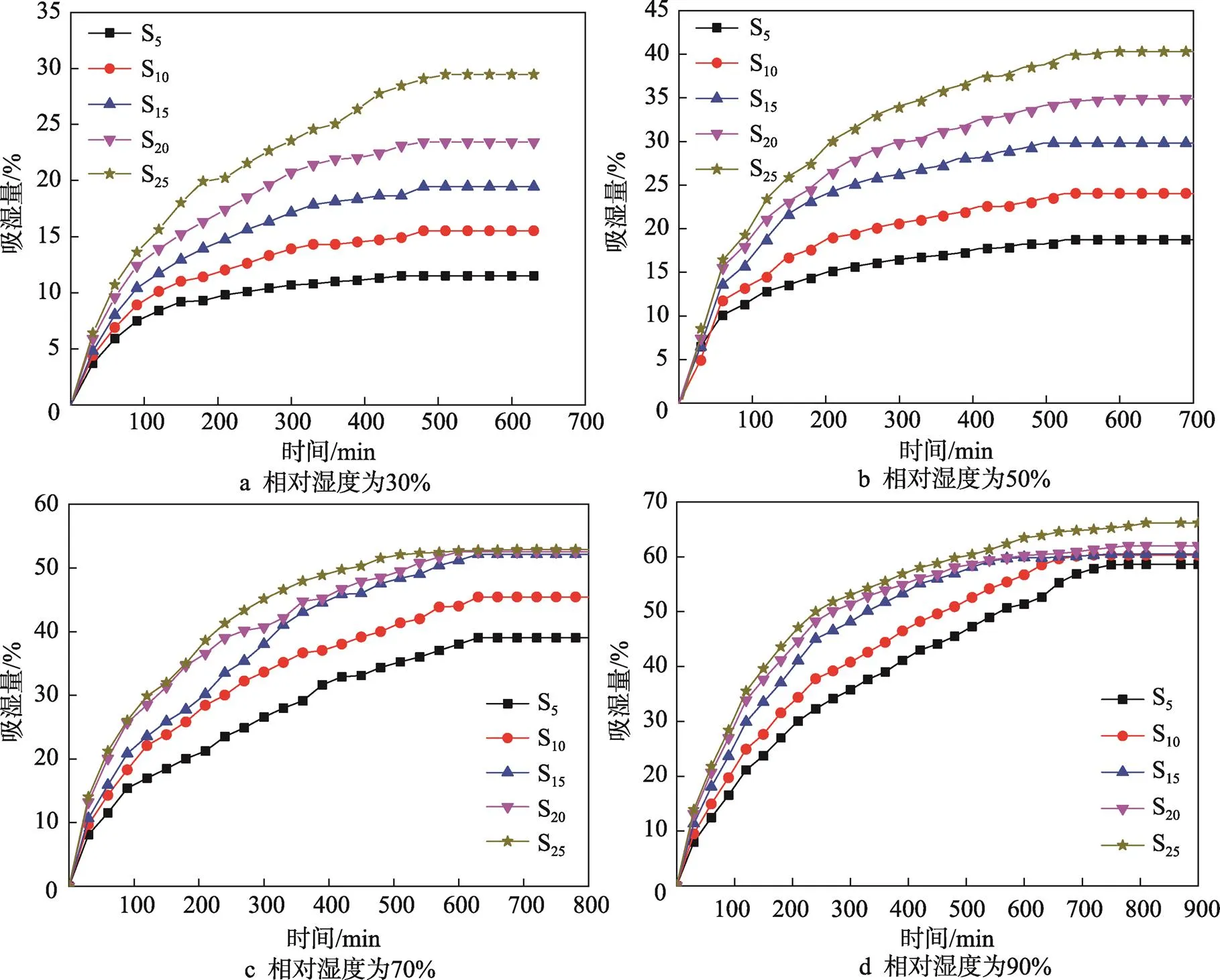
图6 氯化钙改性硅胶吸湿材料的静态吸附曲线
2.4.2 等温吸附性能分析
氯化钙改性硅胶吸湿材料的吸水等温线见图7。同种样品的吸湿量随相对湿度的增加而增加,样品S5、S10、S15、S20、S25在相对湿度30%下的平衡吸湿量分别为11.50%、15.52%、19.46%、23.42%、26.45%,优于同种湿度下未改性硅胶的平衡吸湿量(10.11%)。在相对湿度50%条件下,S5、S10、S15、S20、S25吸湿量分别为18.71%、24.05%、29.81%、34.90%、40.28%,也优于同种湿度下未改性硅胶的吸湿量(17.84%)。相对湿度从30%到50%,S5、S10、S15、S20、S25吸湿量分别增加了7.21%、8.53%、10.35%、11.48%、13.83%。对比其他样品也可以得出,样品的吸湿量随着相对湿度增加而增加。这是因为相对湿度越大,环境中水分子数量越多,在相同时间内,水分子击中吸附空位的概率越大。在相同湿度下,改性后吸湿材料的平衡吸湿量优于未改性硅胶的。
2.4.3 再生性能分析

图7 氯化钙改性硅胶吸湿材料吸水等温线

图8 CaCl2–H2O体系相图
注:L为液态水,冰为固态水。
S25是所制备氯化钙改性硅胶吸湿材料中吸湿性能最好的,亦是结构被改变最多的样品,故测试S25再生后质量、相对湿度为70%条件下吸湿量变化和再生前后外观质量变化,图9a为再生后S25吸湿前后质量变化,图9b为再生后S25吸湿量变化,图10为S25外观质量。由图9可知,S25的质量仅在第1次再生后降低了0.05 g,后面3次再生后一直保持在8.84 g,而吸湿量在前2次再生后降低了0.7%,最后2次S25吸湿量几乎没有减少。由图10a可知,再生前的S25破裂率为0%。图10b为再生4次后的S25,此时破裂率约8%,比较二者可知,再生使用会造成部分S25破裂,但破裂率不高且破裂后结构较为完整基本不影响使用,因此S25有较好的再生性能,可多次反复使用,这就大大降低了吸湿材料的成本,使吸湿材料具有较好的应用前景。

图9 S25循环吸附性能

图10 S25重复使用前后外观质量
2.5 吸附动力学研究
氯化钙改性硅胶吸湿材料吸湿过程主要分为4个阶段:水蒸气穿过吸湿材料与空气接触的界膜,扩散进入孔隙内部;水蒸气在复合吸湿材料孔隙内的扩散;水蒸气在吸湿材料内表面物理吸附;水蒸气在吸湿材料内表面化学吸附。吸湿材料在前2个阶段吸附速率较慢,在第3、4阶段吸附速率很快,可忽略不计,因此只需研究1、2阶段吸附动力学即可[19]。由2.4节可知,S25是所制得氯化钙改性硅胶吸湿材料中平衡吸湿量最优者,因此以S25在相对湿度为30%、50%条件下吸附为例,基于准一级和准二级动力学模型建立适用于氯化钙改性硅胶吸湿材料的动力学模型。
1)准一级吸附动力学模型。用于描述水蒸气从边界膜进入到孔隙内部的准一阶动力学模型,采用拉格尔格伦模型计算吸附速率,其公式为[20]:
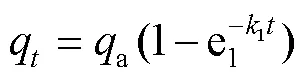
式中:q为时刻的吸附量,mg/g;a为饱和吸附量,mg/g;1为准一级动力学模型吸附速率常数,min−1。
2)准二级动力学模型。用于描述水蒸气在孔隙内扩散的准二级动力学方程为[20]:

式中:2为准二级动力学模型吸附速率常数,g/(mg·min)。
利用式(4)和式(5)分别对图11中的数据进行非线性拟合,拟合结果见表5,图12为对应的准一级、准二级动力学模型拟合曲线。在吸附初始阶段,氯化钙改性硅胶吸湿材料在相对湿度为50%的条件下吸附速率高于相对湿度为30%的吸附速率,饱和吸附量也是在相对湿度为50%条件下更高。在不同湿度条件下,准一级和准二级动力学模型皆较好地模拟了水分子在氯化钙改性硅胶吸湿材料上的吸附过程,二者相关系数均高于0.99,但准二级拟合的相关系数更高,因此建立的准二级动力学方程能更好地模拟了水分子在氯化钙改性硅胶吸湿材料的吸附过程。

图11 S25吸附量随时间变化情况
表5 S25吸附动力学准一级和准二级动力学模型方程参数

Tab.5 Model parameters of quasi-first order and quasi-second order equations for S25 adsorption

图12 动力学方程拟合情况
3 结语
文中以硅胶为载体,利用醇溶液浸渍法将氯化钙嵌入硅胶微孔内来制备氯化钙改性硅胶吸湿材料,通过对氯化钙改性硅胶吸湿材料的性能进行测试分析,得出如下结论。
1)与溶液法制备的氯化钙改性硅胶吸湿材料相比,采用醇溶液法制备的吸湿材料基质破裂率明显降低。
2)氯化钙改性硅胶吸湿材料的介孔分布较为丰富,随着氯化钙含量的增加,其比表面积、孔容减小,平均孔径变化不大;由分形维数可知,氯化钙改性硅胶吸湿材料孔隙结构较复杂、表面较光滑。
3)文中测试了氯化钙改性硅胶吸湿材料在不同湿度条件下的吸附曲线,发现平衡吸湿量随氯化钙含量的增加而增加,且氯化钙改性硅胶吸湿材料的平衡吸湿量是优于未改性硅胶的。
4)分别模拟计算了氯化钙改性硅胶吸湿材料的吸附准一级和准二级动力学模型,准一级和准二级动力学模型皆较好地模拟了水分子在吸湿材料上的动态吸附,但准二级拟合的相关系数更高,可以更好地模拟硅胶动力学吸湿过程。
[1] 周波. 沸石基调湿材料的制备及调湿性能研究[D]. 南京: 东南大学, 2018: 1-7.
ZHOU Bo. Preparation and Study of the Hygrothermal Performance of Zeolite-Based Humidity Control Materials[D]. Nanjing: Southeast University, 2018: 1-7.
[2] 申展, 刘瑶华, 罗俊杰. 细孔球形硅胶脱附性能的研究[J]. 包装工程, 2019, 40(19): 187-191.
SHEN Zhan, LIU Yao-hua, LUO Jun-jie. Desorption Properties of Fine Porous Spherical Silica Gel[J]. Packaging Engineering, 2019, 40(19): 187-191.
[3] 陈福康, 马悦. 基于硅胶和氯化钙复合吸附剂的吸附性能研究[J]. 鄂州大学学报, 2017, 24(3): 100-102.
CHEN Fu-kang, MA Yue. Study on Adsorption Performance of Composite Adsorbent Based on Silica Gel and Calcium Chloride[J]. Journal of Ezhou University, 2017, 24(3): 100-102.
[4] 刘岩, 马春元, 张梦. 硅胶和改性硅胶的吸附解吸特性[J]. 离子交换与吸附, 2018, 34(4): 289-297.
LIU Yan, MA Chun-yuan, ZHANG Meng. Adorption and Desorption Properties of Silica Gel and Modified Silaca Gel[J]. Ion Exchange and Adsorption, 2018, 34(4): 289-297.
[5] 朱培怡, 王海增, 李溪. 氯化镁改性硅胶的吸水等温线及脱附性能[J]. 硅酸盐学报, 2010, 38(4): 735-740.
ZHU Pei-yi, WANG Hai-zeng, LI Xi. Water Vapor Adsorption Isotherm and Desorption Property of Magnesium Chloride Modified Silica[J]. Journal of the Chinese Ceramic Society, 2010, 38(4): 735-740.
[6] 何贤培. 干燥剂吸湿率测试方法的探讨[J]. 广东化工, 2019, 46(9): 85-86.
HE Xian-pei. Test Method of Water Absorption of Desiccant[J]. Guangdong Chemical Industry, 2019, 46(9): 85-86.
[7] 王子惠, 陶海军, 田相龙, 等. 凹土复合干燥剂的制备及吸湿性能[J]. 南京工业大学学报(自然科学版), 2019, 41(1): 30-35.
WANG Zi-hui, TAO Hai-jun, TIAN Xiang-long, et al. Preparation and Hygroscopic Properties of Attapulgite Supported Desiccant[J]. Journal of Nanjing Tech University (Natural Science Edition), 2019, 41(1): 30-35.
[8] 叶松. 沸石/吸湿性盐复合吸附剂用于高温热泵的实验研究[D]. 郑州: 郑州大学, 2019: 19-20.
YE Song. Experimental Study on Zeolite/Hygroscopic Salt Composite Adsorbent for High-Temperature Heat Pump[D]. Zhengzhou: Zhengzhou University, 2019.
[9] 近藤精一, 石川达雄, 安部郁夫. 吸附科学[M]. 北京: 化学工业出版社, 2006: 31-81.
SEIICHI K, TATSUO I, IKUO A. Adsorption Science [M]. Beijing: Chemical Industry Press, 2006: 31-81.
[10] 余煜玺, 朱孟伟. 高球形度、高比表面积SiO2/TiO2气凝胶小球的制备和表征[J]. 材料工程, 2017, 45(2): 7-11.
YU Yu-xi, ZHU Meng-wei. Preparation and Characterization of Highly Spherical Silica-Titania Aerogel Beads with High Surface Area[J]. Journal of Materials Engineering, 2017, 45(2): 7-11.
[11] 陈金妹, 谈萍, 王建永. 气体吸附法表征多孔材料的比表面积及孔结构[J]. 粉末冶金工业, 2011, 21(2): 45-49.
CHEN Jin-mei, TAN Ping, WANG Jian-yong. Characterization of Pore Structure and Specific Surface Area Based on Gas Adsorption Applied for Porous Materials[J]. Powder Metallurgy Industry, 2011, 21(2): 45-49.
[12] HU Zhi-bo, ZHENG Shui-lin, TAN Ye, et al. Preparation and Characterization of Diatomite/Silica Composite Humidity Control Material by Partial Alkali Dissolution[J]. Materials Letters, 2017, 196: 234-237.
[13] 周三栋, 刘大锰, 蔡益栋, 等. 低阶煤吸附孔特征及分形表征[J]. 石油与天然气地质, 2018, 39(2): 373-383.
ZHOU San-dong, LIU Da-meng, CAI Yi-dong, et al. Characterization and Fractal Nature of Adsorption Pores in Low Rank Coal[J]. Oil & Gas Geology, 2018, 39(2): 373-383.
[14] 刘娟. 活性炭孔径分布分形表征与其吸附性能之间关系的研究[D]. 广州: 华南理工大学, 2011: 11-13.
LIU Juan. Study on Relationship between Fractal Characterization of Pore-Size Distribution and Adsorption Performance of Activated Carbon[D]. Guangzhou: South China University of Technology, 2011: 11-13.
[15] 李凤丽, 姜波, 宋昱, 等. 低中煤阶构造煤的纳米级孔隙分形特征及瓦斯地质意义[J]. 天然气地球科学, 2017, 28(1): 173-182.
LI Feng-li, JIANG Bo, SONG Yu, et al. Nano Scale Pore Structure and Fractal Characteristics of Low-Medium Metamorphic Tectonically Deformed Coal[J]. Natural Gas Geoscience, 2017, 28(1): 173-182.
[16] 贺杨堃, 杨继萍, 付悍巍, 等. 新型硅胶复合干燥剂的制备与性能研究[J]. 高校化学工程学报, 2012, 26(6): 1054-1059.
HE Yang-kun, YANG Ji-ping, FU Han-wei, et al. Research on a Modified Silica Gel-Based Desiccant[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(6): 1054-1059.
[17] 贾春霞. 硅胶基复合干燥剂强化除湿机理及其应用研究[D]. 上海: 上海交通大学, 2006: 45-47.
JIA Chun-xia. Study on Reinforcement Dehumidification Mechanism and Application of Composite Desiccant Based on Silica Gel[D]. Shanghai: Shanghai Jiao Tong University, 2006: 45-47.
[18] 牛自得, 程芳琴. 水盐体系相图及其应用[M]. 天津: 天津大学出版社, 2002: 19-33.
NIU Zi-de, CHENG Fang-qin. Phase Diagram of Salt System and Its Application[M]. Tianjin: Tianjin University Press, 2002: 19-33.
[19] 刘业凤, 王如竹. 新型复合吸附干燥剂的吸附动力学特性研究[J]. 上海理工大学学报, 2006, 28(2): 107-110.
LIU Ye-feng, WANG Ru-zhu. Study on Adsorption Kinetics Characteristic of a Kind of New Composite Desiccant[J]. Journal of University of Shanghai for Science and Technology, 2006, 28(2): 107-110.
[20] 闫柯乐. 不同结构硅胶材料对甲苯分子的吸附行为及吸附动力学实验研究[J]. 科学技术与工程, 2018, 18(8): 157-162.
YAN Ke-le. Experimental Investigation on the Adsorption Behavior and Adsorption Kinetic of Toluene on the Different Silica Gels[J]. Science Technology and Engineering, 2018, 18(8): 157-162.
Preparation and Properties of Calcium Chloride Modified Silica Gel Hygroscopic Materials
YANG Huan1, SONG Yang-xi2, XU Shu-quan1, YANG Sen1, XIANG Rui-xuan1, ZHENG Zhong-yan1
(1. No.59 Research Institute of Ordnance Industry, Chongqing 400039, China;2. The sixth Military Representative Office in Chongqing, Chongqing 400039, China)
The work aims to prepare calcium chloride modified silica gel hygroscopic materials of different concentrations by calcium chloride and alcohol solution impregnation method, so as to solve the problems of easy rupture of aqueous modified silica gel and low water absorption rate of ordinary silica gel. The appearance quality of hygroscopic materials prepared by calcium chloride aqueous solution and alcohol aqueous solution was compared. The isothermal adsorption curves were tested by gas adsorption method. The pore parameters and fractal dimensions of calcium chloride modified silica gel hygroscopic materials were obtained based on BET theory and FHH model, respectively. The static adsorption curve of vapor was obtained by the static adsorption method. The adsorption kinetics equation suitable for hygroscopic materials was established according to the quasi-first-order and quasi-second-order kinetic models. The calcium chloride modified silica gel hygroscopic materials prepared by calcium chloride and alcohol solution could effectively reduce the rupture. The specific surface area and pore volume of the materials decreased with the increase of CaCl2content, but the pore size changed little. The moisture adsorption of materials increased with the increase of CaCl2content. The quasi-second-order kinetic model was more suitable to simulate the adsorption kinetics of the materials due to the higher correlation coefficient. The calcium chloride modified silica gel hygroscopic materials prepared by 25wt.% CaCl2alcohol solution have high hygroscopicity, low matrix rupture degree and excellent regeneration ability, thus having a good application prospect.
silica gel; calcium chloride; modification; fractal feature; adsorption capacity; adsorption kinetics
TB332
A
1001-3563(2022)15-0216-10
10.19554/j.cnki.1001-3563.2022.15.025
2021–11–22
杨欢(1993—),女,硕士,工程师,主要研究方向为防护包装材料。
责任编辑:曾钰婵

