植物乳杆菌抑菌蛋白的分离鉴定及抑菌特性研究
李小宁,李 军,尹杨燕,李常挺,马春霞,陶 立,龚 俞,钟舒红,白慧丽,彭 昊,廖玉英
(1.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁 530001;2.广西大学动物科学技术学院,南宁 530004;3.贵州省畜禽遗传资源管理站,贵阳 550001)
植物乳杆菌是一种多功能乳酸菌,作为乳酸菌的代表,在自然界分布广泛,因其具有良好的抗菌性能而成为无抗养殖领域的研究重点,是一类具有开发前景的新型绿色抗菌制剂[1]。
现有研究表明,植物乳杆菌的抗菌特性主要依赖于其产生的代谢产物,分离到的抑菌物质主要包括有机酸[2-3]、脂肪酸[4]、抑菌蛋白或小分子抗菌肽[5-7]。抑菌蛋白或小分子抗菌肽是植物乳杆菌产生的重要代谢产物,研究证实植物乳杆菌的发酵上清经蛋白酶处理后,其原本的抑菌能力将会大打折扣[8]。目前针对植物乳杆菌抑菌蛋白的研究主要集中在对其进行分离、鉴定及其抑菌机理的探讨。詹晖等[9]对小鼠进行沙门氏菌攻毒,发现植物乳杆菌细菌素对沙门氏菌在增殖过程中的细胞膜有破坏作用。韩金志等[10]从植物乳杆菌中分离出一种新型细菌素,经抑菌试验证实其对大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄等食源性致病菌具有不同程度的抑菌活性。细菌素可破坏病原菌的细胞膜或细胞壁,使其内容物外泄而达到抑菌作用;也可以菌体的核酸为作用靶点,阻碍病原菌的增殖分裂从而发挥抗菌作用。Miao等[11]研究发现干酪乳杆菌的细菌素 F1 可通过作用于金黄色葡萄球菌的DNA和破坏细胞膜两种方式抑制金黄色葡萄球菌的增殖。Khalaf等[12]从乳酸菌中分离出的细菌素PLNC8 αβ可通过破坏病原菌的生物膜从而发挥抗菌作用。
与其他非蛋白类抑菌物质相比,抑菌蛋白或小分子抗菌肽抑菌活性强、抑菌谱广且抑菌蛋白编码基因易克隆表达,可为实现工业化生产发挥更大的应用价值,筛选新型广谱而有效的抑菌蛋白或小分子抗菌肽可为开发新型替抗产品提供新思路新选择。目前针对植物乳杆菌的抑菌效果研究多集中在有机酸的协同作用,而对于抗菌肽或抑菌蛋白的协同作用却鲜有报道。本研究通过低温离心和超滤法提取植物乳杆菌代谢产物中的胞外蛋白,采用液相色谱串联质谱(LC-MS/MS)法进一步分析鉴定抑菌蛋白成分,并对抑菌机制进行解析,以期为全面解析植物乳杆菌的抑菌机制和进一步研发替代抗生素的新一代绿色安全抑菌蛋白制剂提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基 试验用菌种植物乳杆菌GX20200417-1,分离自广西市售发酵酸菜,由广西壮族自治区兽医研究所细菌室提供;指示菌大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 6583、沙门氏菌SM022均由广西壮族自治区兽医研究所收藏保存。MRS肉汤培养基购自北京陆桥技术股份有限公司。
1.1.2 主要试剂及仪器 RIPA裂解液(Solarbio公司);乙腈(ACN)、甲酸(FA)、碳酸氢铵、二硫苏糖醇(DTT)、碘乙酰胺(IAA)(Sigma-Aldrich公司);考马斯亮蓝染色剂(碧云天生物技术有限公司)。超净工作台(Thermo Scientific公司);低温高速离心机(Eppendorf公司);Western电泳仪(Bio-Rad公司);毛细管高效液相色谱仪和电喷雾-组合型离子阱Orbitrap 质谱仪(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 菌种活化及生长性能测定 将-80 ℃保存的菌种溶解,灼烧接种环至冷却后,蘸取少量菌液,轻轻划线接种于指定的平板培养基,37 ℃培养24 h后,挑取单个菌落,接种于MRS液体培养基,37 ℃、150 r/min恒温摇床震荡培养,分别在0、4、8、12、24、36和48 h吸取发酵液,测定其D600 nm值。
1.2.2 植物乳杆菌发酵上清液的制备 将活化传代后的植物乳杆菌接种于15 mL MRS液体培养基,37 ℃、150 r/min恒温摇床震荡培养24 h后,4 ℃、12 000 r/min离心10 min,取上清经0.22 μm无菌滤膜过滤,并收集滤液。
1.2.3 牛津杯法检测抑菌活性 分别吸取200 μL 1×108CFU/mL的指示菌悬液并均匀涂布于固体培养板上,轻轻放置牛津杯,在杯中加入200 μL发酵液/发酵上清液/胞外蛋白,37 ℃恒温培养24 h,每种处理做3个平行,测定抑菌圈直径。
1.2.4 不同培养时间植物乳杆菌发酵上清液对大肠杆菌抑菌活性的测定 将活化的植物乳杆菌接种于15 mL MRS液体培养基,37 ℃、150 r/min恒温摇床震荡培养,分别在培养0、4、8、12、24、36和48 h时吸取200 μL发酵液,按照1.2.2的方法收集发酵上清液,按照1.2.3的方法测定其对于大肠杆菌的抑菌活性。
1.2.5 胞外蛋白的制备 将1.2.2收集到的发酵上清液加入到 3 ku 超滤膜的 15 mL超滤管中,4 ℃、6 500 r/min离心 40 min,收集浓缩液,并将浓缩液稀释于MRS培养基中,使其蛋白溶液总量与初始发酵液体积一致。
1.2.6 SDS-PAGE分离胞外蛋白 取适量胞外蛋白样品,与Loading Buffer(5×)混合,将样品和Marker依次加入12%分离凝胶的孔中,100 V运行 10 min。然后120 V运行60 min,剥离胶放入考马斯亮蓝染色液中,室温染色 1 h。加入脱色液,置于 80 r/min 脱色摇床上,每 20 min 更换一次脱色液至完全脱净。完成脱色后,用双蒸水浸泡,参照蛋白质分子质量标准将所提纯的蛋白从凝胶中分离出来。
1.2.7 抑菌蛋白理化特性研究
1.2.7.1 温度对抑菌蛋白抑菌活性的影响 将抑菌蛋白分别在20、40、60、80、100和121 ℃下水浴30 min,以室温的抑菌蛋白液为对照组,每组3个重复,采用牛津杯法测定不同处理后的样品对大肠杆菌抑菌活性的影响。
1.2.7.2 pH对抑菌蛋白抑菌活性的影响 将抑菌蛋白分别用Tris-HCl 和MES-NaOH 缓冲液调节pH至2.0、4.0、6.0、8.0、10.0、11.0和12.0,静置2 h,以未处理的抑菌蛋白液为对照组,每组3个重复,采用牛津杯法测定不同处理后的样品对大肠杆菌抑菌活性的影响。
无菌蒸馏水分别用Tris-HCl 和MES-NaOH缓冲液调节pH至2.0、3.0、4.0、10.0、11.0和12.0,采用牛津杯法测定不同pH缓冲液对大肠杆菌抑菌活性的影响,以排除过酸或过碱条件本身对抑菌效果的影响。
1.2.7.3 蛋白酶对抑菌蛋白抑菌活性的影响 分别用胰蛋白酶与蛋白酶K处理抑菌蛋白,37 ℃水浴30 min,以未处理的抑菌蛋白液为对照组,每组3个重复,采用牛津杯法测定不同处理后的样品对大肠杆菌抑菌活性的影响。
1.2.8 胰蛋白酶酶解 ①胶粒脱色:将目的条带切成胶粒,分装进1.5 mL EP管中,使用 50% ACN-50% 50 mmol/L NH4HCO3溶液脱色。②胶粒脱水:加入 100% ACN 100 μL,放置 30 min,待胶粒呈白色团状,弃去ACN,室温放置干燥。③还原烷基化:加入适量10 mmol/L DTT 于 56 ℃ 水浴中还原 1 h,吸出弃去。而后加入适量55 mmol/L IAA,暗处室温反应1 h,吸出弃去,按照①②步骤脱色脱水。④酶切:取10 μL 5 ng/μL 酶于EP管中,4 ℃冰箱孵育 40 min,取出后每管补加 5~10 μL 50 mmol/L NH4HCO3溶液,密封于 37 ℃ 水浴中酶切 16 h。⑤肽段提取:加提取液(5% TFA-50% ACN-45%水)100 μL/管,37 ℃水浴 1 h,超声 5 min,离心 5 min,重复1次,真空离心干燥。
1.2.9 LC-MS/MS检测 经胰蛋白酶酶解后的肽段在质谱仪中离子化后,通过检测器分析,可得到各肽段的质荷比(m/z),即一级质谱图;部分肽段再次被破碎和分析,产生二级质谱图,采用质谱检索软件选择Uniport蛋白数据库,对获得的全部质谱数据进行分析。色谱条件:流动相A:0.1%甲酸,2% ACN;流动相B:0.1%甲酸,80% ACN;流速:600 nL/min;每个组分分析时间:66 min。
1.3 数据统计分析
试验数据采用SPSS 26.0软件进行单因素方差分析,采用LSD法对抑菌活性进行多重比较,采用Duncan’s法对理化特性各组数据进行多重比较,结果以平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 植物乳杆菌GX20200417-1生长曲线
由图1可知,植物乳杆菌GX20200417-1在4 h后D600 nm值迅速上升,进入对数期,24 h后趋于稳定,进入平台期。
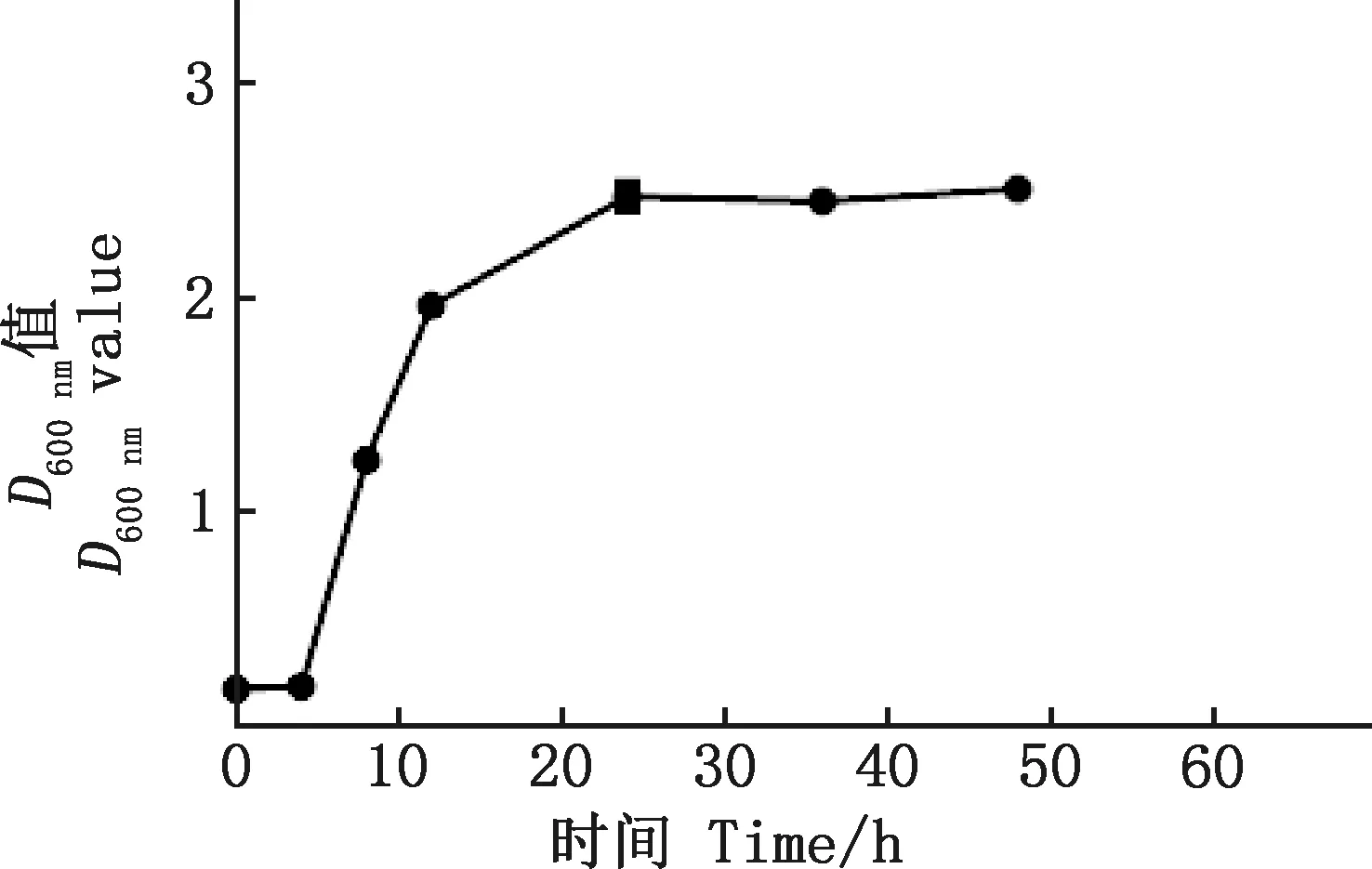
图1 植物乳杆菌GX20200417-1生长曲线Fig.1 Growth curve of Lactobacillus plantarum GX20200417-1
2.2 植物乳杆菌抑菌活性测定
植物乳杆菌GX20200417-1对供试指示菌的抑菌活性见图2。由图2可知,植物乳杆菌GX20200417-1对沙门氏菌、大肠杆菌、金黄色葡萄球菌均具有较好的抑菌效果,其中对大肠杆菌的抑菌圈直径大于沙门氏菌和金黄色葡萄球菌,抑菌圈直径为13.33 mm,说明植物乳杆菌GX20200417-1对大肠杆菌的抑菌效果优于沙门氏菌和金黄色葡萄球菌。

图2 植物乳杆菌GX20200417-1体外抑菌活性测定Fig.2 Determination of antibacterial activity of Lactobacillus plantarum GX20200417-1 in vitro
2.3 植物乳杆菌发酵上清液对大肠杆菌的抑制活性测定
由图3可知,发酵液及发酵上清液的抑菌曲线基本相似且一致;在0~4 h内没有抑菌能力,4 h后抑菌能力逐渐增强,并在24 h时达到最大,此时发酵液及发酵上清液产生的抑菌圈直径分别为13.33和12.21 mm,随着培养时间的延长,抑菌能力并无显著变化。MRS培养基产生的抑菌圈直径为0 mm,对比图1与图3可发现,在4~24 h范围内,抑菌圈直径与D600 nm值增长趋势一致,且在24 时达到稳定。
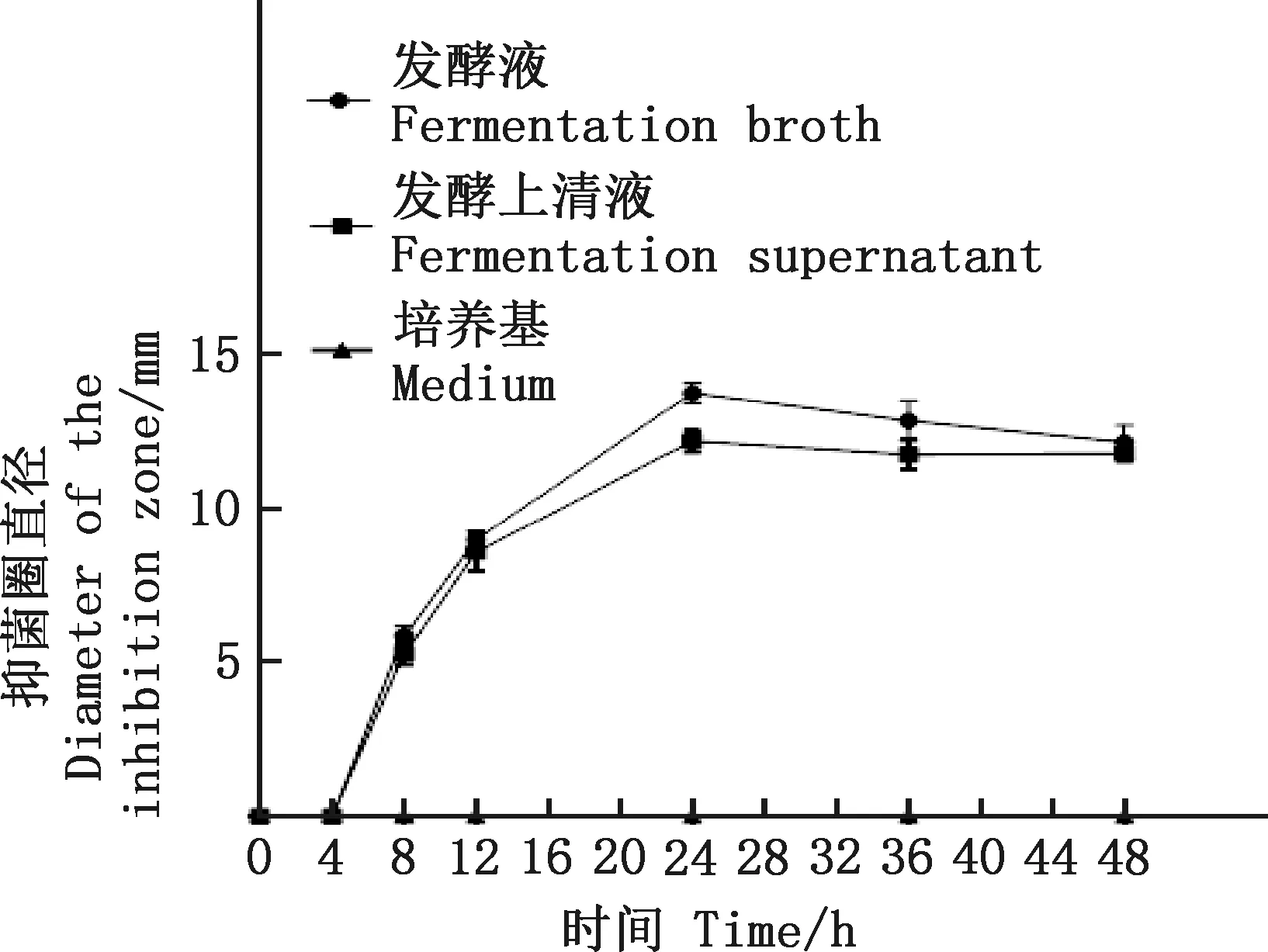
图3 植物乳杆菌GX20200417-1发酵液及发酵上清液抑菌曲线Fig.3 Inhibitory curves of Lactobacillus plantarum GX20200417-1 fermentation broth and fermentation supernatant
2.4 胞外蛋白的制备及抑菌活性测定
将提取的胞外蛋白按比例稀释于等体积发酵液的MRS培养基中,以保证单位体积的胞外蛋白全部来自于等体积下的菌液或等体积的发酵上清液。由图4可知,稀释后的胞外蛋白与等体积的发酵液(1×108CFU/mL)及发酵上清液可产生相近直径的抑菌圈,说明植物乳杆菌GX20200417-1胞外蛋白对于大肠杆菌亦具有较好的抑菌活性,进一步说明植物乳杆菌代谢产物中的抑菌物质主要为抑菌蛋白成分,通过SDS-PAGE对提取的胞外蛋白进行分离,分离到胞外蛋白分子质量在5~150 ku之间(图5)。

图4 植物乳杆菌GX20200417-1发酵液/发酵上清/胞外蛋白/培养基对大肠杆菌的抑菌效果Fig.4 Inhibitory effect of Lactobacillus plantarum GX20200417-1 fermentation broth,fermentation supernatant,extracelluar protein and medium on Escherichia coli
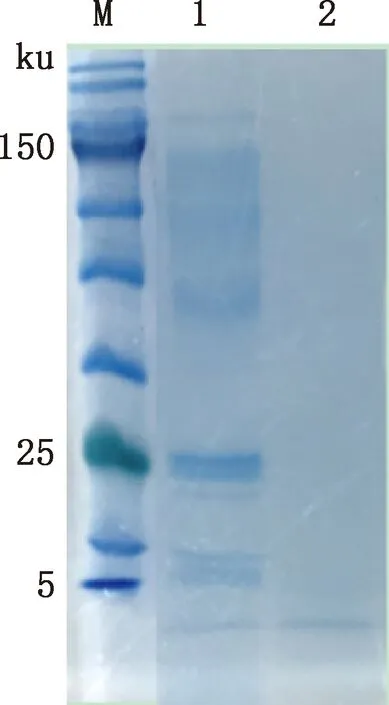
M,蛋白质分子质量标准;1,胞外蛋白;2,培养基M,Protein Marker;1,Extracellular protein;2,Medium图5 胞外蛋白SDS-PAGEFig.5 SDS-PAGE of extracellular protein
2.5 抑菌蛋白理化特性
与对照组相比,胞外蛋白经20、40、60和80 ℃水浴处理后,抑菌活性均无显著变化(P>0.05),但其在100和121 ℃处理后,抑菌活性明显下降,与对照组及其他温度处理组差异显著(P<0.05)(图6)。不同pH缓冲液处理抑菌蛋白后,抑菌蛋白在pH为6.0~8.0的环境下,抑菌活性较好,与对照组相比,在过酸或过碱条件下抑菌活性均受到抑制(P<0.05)(图7)。为验证pH缓冲液本身是否对大肠杆菌产生抑菌影响,在pH分别为2.0~4.0和10.0~12.0的条件下对大肠杆菌做抑菌处理,结果显示,pH为2.0~4.0和10.0~12.0的无菌缓冲液均未对大肠杆菌产生抑菌影响(图8)。与对照组相比,用蛋白酶K及胰蛋白酶处理抑菌蛋白后,抑菌蛋白抑菌活性显著下降(P<0.05)(图9)。

与对照组相比,*,差异显著(P<0.05);无*,差异不显著(P>0.05)。下同Compared with control group,*,Significant difference (P<0.05);No*,No significant difference (P>0.05).The same as below图6 温度对抑菌蛋白抑菌活性的影响Fig.6 Effect of temperature on antibacterial activity of antibacterial protein

图7 pH对抑菌蛋白抑菌活性的影响Fig.7 Effect of pH on antibacterial activity of antibacterial protein

图8 不同pH缓冲液对大肠杆菌抑菌活性的影响Fig.8 Antibacterial activity of different pH buffer on Escherichia coli
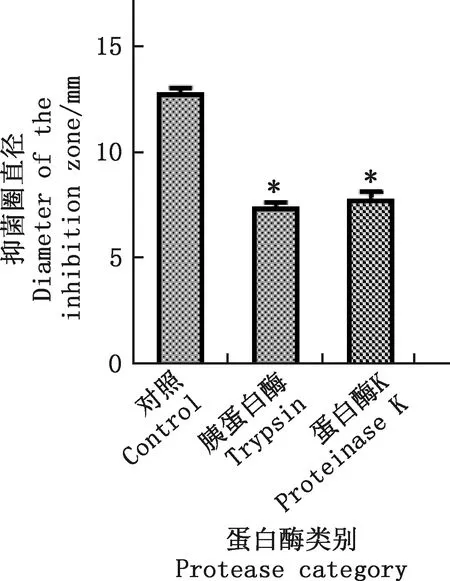
图9 抑菌蛋白对蛋白酶的敏感性Fig.9 Sensitivity of antibacterial protein to protease
2.6 抑菌蛋白的抑菌特性研究
为进一步研究抑菌蛋白的成分,用液相色谱串联质谱分析仪进行分析,得到胞外蛋白总离子图谱(图10),质谱采集的数据,经过软件MaxQuant(1.6.2.10)数据库检索,共检测出5种可信度较高且与抑菌作用相关的蛋白质,依次为片球菌素 pediocin PA-1、辅助蛋白、溶菌素、聚酮合酶和LysM peptidoglycan-binding domain-containing protein(表1)。Uniport 蛋白数据库功能预测显示:pediocin PA-1为广谱性的细菌素,溶菌素具有溶菌酶活性,二者主要通过破坏细菌细胞壁与细胞膜,从而达到抑菌效果。辅助蛋白主要参与细菌素的合成过程,聚酮合酶参与抗生素的合成。LysM peptidoglycan-binding domain-containing protein在蛋白鉴定结果中显示可信度最高,但在检索数据库中未显示相关功能。

图10 植物乳杆菌GX20200417-1胞外蛋白总离子图谱Fig.10 Total ion map of extracellular protein of Lactobacillus plantarum GX20200417-1

表1 植物乳杆菌GX20200417-1抑菌蛋白分析
3 讨 论
植物乳杆菌的主要益生特性之一是其广谱的抑菌性,抑菌特性主要依赖于其产生的复杂代谢产物,包括有机酸、脂肪酸、抑菌蛋白或小分子抗菌肽等。国内外学者对抑菌蛋白的分离纯化做了相关研究,分离纯化方法主要有层析法、蒸发浓缩法、有机溶剂法、超滤法等[13]。本研究采用低温离心和超滤法分离植物乳杆菌代谢产物中的抑菌蛋白,并通过抑菌活性测定发现抑菌蛋白对大肠杆菌具有良好的抑菌效果,徐栋等[14]从植物乳杆菌中分离出的细菌素LZ222,以及翟佳琳等[15]分离出的抑菌蛋白对大肠杆菌同样具有抑菌活性,与之不同的是Todorov等[16]分离出的细菌素ST26MS和ST28MS对大肠杆菌并无抑菌效果。本研究通过温度、pH、酶处理等方法研究植物乳杆菌产生的抑菌蛋白的理化特性,发现抑菌蛋白具有较好的热稳定性,经121 ℃处理后抑菌活性并未完全丧失;抑菌蛋白经不同pH缓冲液处理后均能保持抑菌活性,且在pH为6.0~8.0时抑菌活性较强,本研究利用极酸极碱的无菌缓冲液对大肠杆菌做抑菌处理,证明缓冲液并未对大肠杆菌产生抑菌影响,这与在酸性条件下抑菌蛋白依然保持较高抑菌活性的结果相违背[17],与在碱性环境下抑菌活性减弱或丧失的结果保持一致[18-19],说明过酸过碱环境可能使抑菌蛋白的构象发生改变,对其活性产生影响。抑菌蛋白经胰蛋白酶、蛋白酶K处理后抑菌活性明显减弱,可能是抑菌蛋白发生部分降解,这一结果与徐志娇等[20]分离出的抑菌蛋白及Seval等[21]分离出的KT11的抑菌活性相似。
为进一步研究植物乳杆菌产生的抑菌蛋白的抑菌特性,通过LC-MS/MS分析鉴定出5种可信度较高且与抑菌作用相关的蛋白质,依次是片球菌素 pediocin PA-1、辅助蛋白、溶菌素、聚酮合酶和LysM peptidoglycan-binding domain-containing protein。
pediocin PA-1是由51个氨基酸组成的细菌素,属于植物乳杆菌产生的ClassⅡa型细菌素,其杀菌机制主要是在细胞膜上形成孔洞,使细胞内离子外泄,引起质子驱动势的耗散,最终引发病原菌死亡[22]。Alvarez等[23]证实细菌素以病原体的细胞膜为攻击靶点,形成孔洞,导致内容物外泄,从而对大肠杆菌发挥抑菌作用。赵瑞香等[24]发现细菌素作用大肠杆菌后细胞膜通透性增大,胞内K+和ATP大量外泄,细胞物质及能量代谢失衡,最终引发大肠杆菌死亡。已证实化学合成的pediocin PA-1可替代天然细菌素完成其抗菌功能。辅助蛋白是由174个氨基酸形成的小分子蛋白,主要功能是参与细菌素的生物合成,辅助蛋白具有高度的同源性,推测其具有辅助细菌素转运的功能。
Lysin是由434个氨基酸形成的蛋白质,具有溶菌酶活性,通过水解细菌细胞壁的肽聚糖发挥其抗菌作用,杀菌活性高且耐药性强,被认为是替抗产品的潜在候选蛋白,Li等[25]发现高度嵌和的lysin对金黄色葡萄球菌在体内外均发挥抑菌活性。Chen等[26]报道了一种独特的lysin嵌合蛋白,该嵌合蛋白对多药耐药鲍曼不动杆菌的抑菌活性提高十万倍左右。有关植物乳杆菌lysin的研究罕见报道,从植物乳杆菌GX20200417-1鉴定出的lysin可作为分离纯化的重要方向。
聚酮合酶广泛存在于植物、细菌和真菌中,是一类与次级代谢有着密切关系的酶类,催化合成结构多样的聚酮化合物,具有良好的抗菌作用[27]。根据Uniport蛋白数据库分析,植物乳杆菌代谢产物中的聚酮合酶能催化抗生素的生物合成,其对植物乳杆菌的抑菌效果发挥间接作用。
LysM peptidoglycan-binding domain-containing protein是由187个氨基酸形成的小分子蛋白,质谱结果经Uinport数据库比对,蛋白可信度最高。LysM 结构域存在于许多细菌的肽聚糖水解酶中,主要作用机制是识别含有N-乙酰氨基葡萄糖(GlcNAc)残基的肽聚糖,已有研究者在植物乳杆菌中鉴定出一种与免疫相关的葡聚糖水解酶即N-乙酰氨基葡糖苷酶(Acm2)[28],葡聚糖水解酶C端含有3个重复的LysM 结构域[29],研究证明LysM结构域通过与肽聚糖的结合识别病原菌,并通过某些未知的途径调控抗菌肽的表达,从而起到有效的抑菌作用[30]。
以上仅是分析鉴定出5种可信度较高的抑菌蛋白,并未对抑菌蛋白进一步分离得到单一物质,若对单一物质进行抑菌机理的深入研究,可为替抗产品的开发提供全新思路。
4 结 论
植物乳杆菌GX20200417-1抑菌谱广,能有效抑制多种病原菌的增殖。本研究采用超滤法获得其抑菌蛋白混合物,抑菌活性强,具有较好的耐热、耐酸碱性,在pH 6.0~8.0时抑菌活性最佳,对蛋白酶敏感。利用LC-MS/MS分析鉴定出5种可信度较高且与抑菌作用相关的蛋白质,蛋白功能分析显示,这些抑菌蛋白可通过破坏细菌细胞膜及细胞壁直接或间接发挥抑菌作用。本研究对抑菌蛋白的分离及抑菌机制的解析可为新型抗菌制剂的开发提供参考。

