华西综合血液管理策略减少体外循环患者异体血需要
刘侠丽,谭赵霞,秦 臻,喻 翔,汪 勃,周秀娟,刘 婷,罗 明,李呤雨,周荣华,杜 磊,熊际月
心肺转流(cardiopulmonary bypass, CPB)对血液系统和凝血系统的严重破坏,使CPB 下的心血管手术成为异体血需要量最大的手术。 心脏手术患者所用血液占围术期输血量的80%,占全国血制品供应的10%~20%[1]。 这不仅加剧了异体血的供求矛盾,而且增加血源传播性疾病的风险[2-3],并剂量依赖性增加患者围术期死亡、感染和急性肾损伤风险,甚至降低长期生存率[4-7]。 因此,减少异体血输入成为改善此类患者预后的关键之一。 为此,华西医院根据血液破坏的环节,制定了一套血液管理策略-华西综合血液管理(Huaxi integrated blood management, HIBM) 策略。 HIBM 于 2020 年 6 月开始实施,经过2 个月的改进、推行趋于完善,并于8 月1日全面实施。 本研究通过回顾性分析HIBM 实施前、后患者输血量与输血率的变化,评估这一策略是否降低患者血制品需要量。
1 资料与方法
1.1 临床资料和患者分组 本研究纳入2019 年1月1 日至2020 年12 月31 日在四川大学华西医院心脏外科行CPB 下心血管手术的成人患者(年龄>18 岁)。 为避免手术操作的复杂程度不同对输血的影响,排除标准包括:①先天性心脏病手术;②心脏移植手术;③肺栓塞手术;④CPB 下行开胸探查及心包剥离手术。 另外,剔除死亡患者未纳入分析(其中1 例患者入室后因夹层破裂而死亡;3 例主动脉夹层术中、术后难以控制的出血死亡;2 例停机失败死亡;1 例左室后壁破裂;2 例突发恶性心律失常死亡)。
将患者分为两组:HIBM 实施前组(n =2 265,2019.1.1~2020.5.31)和实施后组(n = 709,2020.8.1~12.31)。 收集两组患者术前的一般情况和凝血功能、术中指标,以及围术期异体血使用情况。
1.2 麻醉与CPB 管理 患者入室后,静脉咪达唑仑、舒芬太尼、丙泊酚、肌松剂麻醉诱导后行气管插管,机械控制呼吸,静-吸复合维持麻醉。 人工心肺机为Stockert S5(Stockert 公司,德国)滚压泵、膜式氧合器(Medtronic,美国),预充液以佳乐施为主,常规加入25%甘露醇250 ml 和30 mg 肝素抗凝。 肝素3 mg/kg 全身抗凝,建立 CPB,活化凝血时间>480 s 转机。 瓣膜置换、冠状动脉旁路移植术(coronary artery bypass grafting, CABG)、心脏肿瘤等无需停循环的手术患者采用浅低温(鼻咽温34℃),而需要停循环的大血管手术维持最低鼻咽温24℃左右。采用晶体 ∶血液为1 ∶4 含血停搏液,经主动脉根部或左、右冠状动脉开口顺行灌注停搏液,必要时经冠状静脉窦逆行灌注。 CPB 中维持静脉血氧饱和度(SvO2)>70%,平均动脉压50~80 mmHg。
1.3 HIBM 的制定 HIBM 内容包括:①使用整合微栓过滤器的氧合器(Medtronic Fusion)替代普通膜肺和微栓过滤器。 ②缩短管路并减小管径:>55 kg 患者使用成人管路,主泵管使用 3/8~1/2 变径管路,动脉使用 3/8 管路,静脉使用 1/2 管路;<55 kg患者使用儿童管路,主泵管、动静脉管路均使用3/8管路。 HIBM 实施前>50 kg 患者均使用成人管路。③选择性安装超滤器:临近复温时,储血器内血液仍超过1 500 ml,预计无法在停机后将血液完全回输至体内的患者;炎症反应较为严重的患者,如全弓、感染性心内膜炎。 ④常规使用负压辅助静脉引流(vacuum assist venous drainage, VAVD,西安西京医疗用品有限公司)装置:负压维持在-20 mmHg~-60 mmHg。 ⑤采用逆预充技术:外科建立动脉插管后连接体外循环管路,使用患者自身的血液替换CPB管路中的预充液。 操作期间必要时麻醉医生由静脉给少量缩血管药物维持患者收缩压>90 mmHg,若血压不能维持仍低于90 mmHg,立即停止操作,配合外科医生进入 CPB 状态。 对于低血容量患者[8]、严重脱水患者不使用逆预充技术。 ⑥使用血液分离技术(Sorin xtra):对于体重>50 kg、术前血小板(platelet, PLT)≥150×109/L、预计手术时间>2 h 的患者,在CPB 开始后经膜肺的静脉回流端引血至血液分离机行血液分离。 分离的PLT 数量占全身PLT 数量的30%[9],并保存于枸橼酸血袋中,保护 PLT 功能[10]。 ⑦常规使用血液回收技术。 ⑧减少剩余机血,通过超滤、扩张血管、改变体位(头高脚低),尽可能将机血输入患者体内,剩余机血一般不超过400 ml。 ⑨常规对 CPB 管道进行洗涤: 机血回收后,将氧合器和管道用生理盐水冲洗后回收至血液回收装置,洗涤后得到的红细胞(red blood cell,RBC)回输给患者。 见表1。
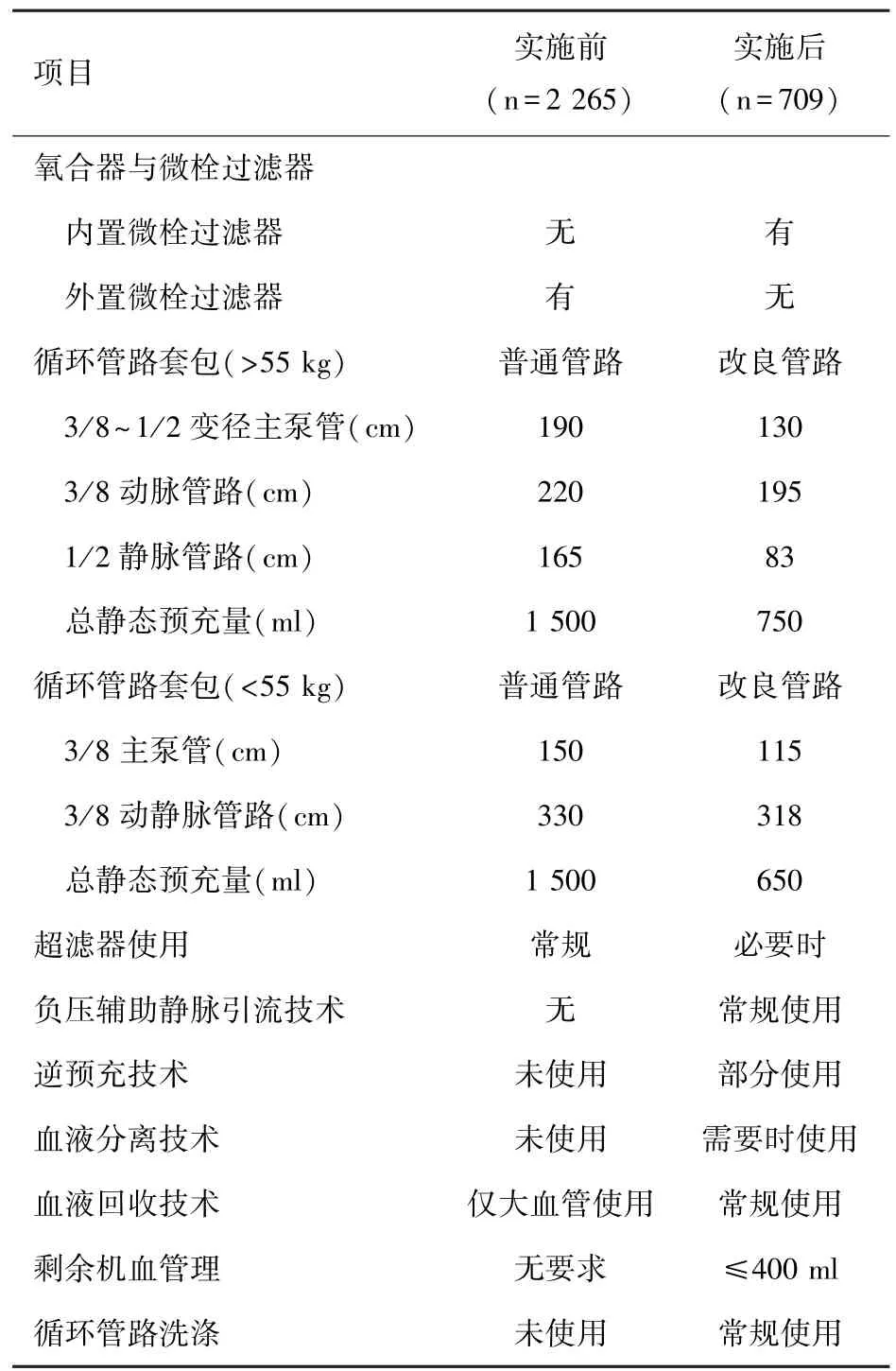
表1 华西综合血液管理策略
1.4 成分输血指征 2019 年 1 月 1 日至 2020 年 12月31 日期间,所有患者的输血指征均相同。 RBC输入指征:① CPB 期间血红蛋白(hemoglobin,Hb)<70 g/L[11];②手术后 Hb<90 g/L[12]。 新鲜冰冻血浆(fresh frozen plasma,FFP)输入指征[13]:① 凝血酶原时间(prothrombin time,PT)或活化部分凝血活酶时间(activated partial thromboplastin time, APTT)大于正常值的1.5 倍,国际标准化值>2.0 及创面弥漫性渗血;②输入的RBC 相当于自身血容量的70 ml/kg 时;③缺乏抗凝血酶Ⅲ导致的肝素抵抗。 PLT 输入指征[13]:①术前存在 PLT 功能障碍;②PLT 数量<50×109/L;③PLT 数量在(50~100)×109/L 根据术野出血情况决定。
1.5 统计方法 采用 SPSS 23.0 和 Graphpad 统计学软件进行数据处理和统计学分析。 正态分布计量资料用均数±标准差表示,单因素方差分析。 非正态分布计量资料用中位数和四分位数区间表示,秩和检验分析。 计数资料采用频数百分比[n(%)]表示,fisher 精确检验分析。 使用单因素和多因素逻辑回归分析观察HIBM 实施后比较实施前对血制品(RBC、FFP、PLT)的影响,矫正指标为患者性别、年龄、体重、术前 Hb、PLT、PT、抗凝药的使用、手术方式、CPB 时间及主动脉阻断时间;术后围术期异体血输入量(从入院至出院期间,所有异体RBC、FFP、PLT 的输入量,FFP 的容量除以200 ml,即换算为单位)。 围术期异体血输入率(输入异体血的患者人数占所有纳入研究的患者百分比)。P<0.05 代表差异有统计学意义。
2 结 果
2.1 患者一般情况 符合筛选标准的3 818 例患者中排除先天性心脏病、心脏移植、肺栓塞,以及CPB 下行心包剥离、开胸探查、心脏异物取出和死亡病例共计526 例;另剔除HIBM 试行阶段的318例(9.7%),2 974 例患者分为实施前组(n =2 265)和实施后组(n =709)纳入分析。 其中男性 1 469 例(49%),年龄 18~80(54±11)岁,体重 28 ~165(61±11)kg。 手术方式包括瓣膜手术 2 196 例(73.84%)、CABG 134 例(4.51%)、瓣膜置换联合 CABG 38 例(1.28%)、大血管手术 495 例(16.64%)、心脏肿瘤切除术 111 例(3.73%)。
HIBM 实施后组患者瓣膜手术的比例低于实施前患者(67.0% vs. 76.0%),大血管手术比例则高于实施前(22.7% vs. 14.7%)。 HIBM 实施后组患者阿司匹林使用比例更高、阻断时间更长。 3 组患者年龄、性别、体重、术前血红蛋白数量、凝血功能等无统计学差异。 见表2。

表2 华西综合血液管理实施前后患者的一般情况
2.2 围术期血制品需要量变化 2020 年5 月前,无论是血制品的输注率(图1A),还是这些血制品的输血量(图1B),均维持在稳定且较高水平。 6 ~7月,所有血制品的输血率和输血量均呈现断崖式下降,8 月后,则呈现稳定的较低水平。 见图1。

图1 观察期间患者血制品需要变化趋势
2.3 术后最低Hb 比较 两组患者术前Hb 无显著性差异。 术后最低Hb 定义为到达ICU 至出院期间最低的Hb 水平。 HIBM 实施后组患者术后最低Hb高于实施前组[(96±14)g/L vs. (93±14)g/L(P<0.001)]。 见图 2。

图2 两组患者围术期血红蛋白比较
2.4 HIBM 降低血制品需要量 HIBM 实施前,患者的所有血制品的平均输注量为(3.70±5.94)U,全面实施后则进一步降低至(0.69±2.33)U,仅为实施前的19%。 输血率也由61%下降至15%。
不同的手术种类与HIBM 实施前比较,实施后使瓣膜手术的平均输血量下降84.1%,CABG 手术输血量下降79.2%,CABG 联合瓣膜置换手术输血量下降66.4%,大血管手术输血量下降84.3%,心脏肿瘤手术输血量下降92.6%。 不同种类手术的输血率也有显著下降。 见表3。

表3 华西综合血液管理实施前后对血制品需求量的比较
为进一步观察不同手术类型在HIBM 实施前后对血制品需要量的影响,将分别对RBC、FFP 和PLT的输注量和输注率进行比较,结果见表4。

表4 华西综合血液管理实施前后血制品输注量和输注率在各类型手术中的比较
2.5 HIBM 降低异体血暴露风险 单因素和多因素逻辑回归分析显示,患者年龄、术前PLT 数量、体重、术前 Hb 水平、PT、手术类型、CPB 时间、主动脉阻断时间被鉴定为异体血输入的独立风险因素。 见表5。

表5 血制品需求的危险因素
单因素和多因素回归分析显示,与HIBM 实施前比较,HIBM 使 RBC、FFP、PLT、总血制品暴露风险分别下降至 0.07、0.13、0.06、0.05。 见表 6。

表6 华西综合血液管理实施前后对血制品暴露风险的影响因素分析
3 讨 论
基于CPB 导致血液破坏的各个环节,本单位制定了HIBM。 通过对实施前后共3 292 名患者的回顾性分析发现,HIBM 实施后患者术后最低Hb(96±14)g/L 高于 HIBM 实施前患者(93±14) g/L(P<0.001),故HIBM 在不降低,甚至略增加患者术后Hb的同时,使所有手术种类的各种血制品的需要量均显著下降:围术期总血制品输注量下降81%,其中RBC 输注量下降 86%、FFP 下降 81%,PLT 下降75%。 多因素逻辑回归分析发现,总血制品、RBC、PLT 暴露风险仅为实施前的 0.05~0.13。
CPB 相关血液的丢失和破坏大致可以分为三大类[14]:①CPB 引起的血液稀释;②术中血液丢失;③凝血功能异常导致的术后血液丢失。 因此,降低血液稀释、减少外科和CPB 导致的血液丢失、改善凝血功能,成为设计HIBM 的三大原则。
血液的过度稀释将会造成循环Hb 的迅速下降,并对携氧能力、凝血功能均造成不良影响。 减少预充是降低血液稀释的主要手段。 降低膜肺和循环管道的容量是减少预充的主要手段。 在HIBM 实施中通过3 种措施减少管道循环容量:①使用整合微栓过滤器的氧合器替代普通膜肺和微栓过滤器;②通过优化主泵-膜肺-手术床之间的距离,缩短CPB 管路长度,对于低体重患者,降低管路内径;③使用逆预充技术,利用患者自身的血液替换CPB 管路中的预充液[8,15]。 这些改变使预充量从 1 500 ml 下降至750 ml,然而由于氧合器储血室与患者之间的高度差减小, 为保证充分的静脉引流, 常规使用VAVD[16],通过给储血室施加负压以增加引流。 事实上,阜外医院体外循环组也做了相似的改进:他们通过改良管路、使用整合微栓的氧合器、VAVD、迷你停搏液等措施,使围术期输血率和输血量分别降低了 7.6%,50%[17]。
减少外科和CPB 导致的血液丢失是HIBM 的第二项管理措施,包括从切皮到缝皮的血液回收技术,以及CPB 管道的洗涤。 与部分医院仅在二次手术或大血管手术时使用血液回收装置不同的是,HIBM管理措施推荐常规使用。 文献显示[14,18],心脏手术全程使用血液回收装置可减少38%RBC 输注量,平均每例患者减少0.68 U 的 RBC,且无严重不良反应,因此目前被欧洲心脏外科协会成人心脏手术患者血液管理指南[19]推荐使用。 与指南不同的是,HIBM 推荐充分使用血液回收系统的作用:即当剩余机血回收后,使用生理盐水将氧合器和管道内剩余的RBC 洗涤后,再使用血液回收装置浓缩,可得到约 0.5~1 U RBC[14]。
在改善凝血功能方面,HIBM 包含3 项措施:①对于PLT 数量较高、手术时间较长的患者,使用血液分离技术将自体血离心、分离获得富PLT 血浆,并在CPB 后回输给患者,以避免CPB 过程中PLT 破坏和纤维蛋白原的激活[20],对凝血功能具有较好的改善作用[21]。 而在 CPB 开始后分离血小板,既不延长手术时间,也不影响循环稳定,可应用于病情危重患者。 在本实验过程中并没有发现因含有肝素的血小板输入导致活化凝血时间的延长或出血增加等现象,其原因可能是血小板内含有的肝素极少,对于成年患者的凝血不造成影响。 ②剩余机血的管理:其目的是尽可能将体外的血液回输给患者(剩余机血一般不超过400 ml),这可以增加循环PLT、凝血因子的数量,从而在鱼精蛋白中和肝素后之后发挥重要止血作用。 ③按需使用超滤。 在HIBM 实施前,为避免过度血液稀释造成的Hb、凝血因子、PLT 浓度显著下降[14],多使用超滤快速去除多余水分。 然而超滤器的介入将造成部分血液丢失,增加血液与异物表面的接触面积,从而增加凝血物质的消耗,加剧机体炎症反应[22],而其对炎性介质去除作用有限。 HIBM 实施后,随着管路缩短、预充液的下降,血液稀释和提高Hb 水平不再是一个严重问题,因此也无需常规使用超滤器,这对于降低凝血物质的激活、减少血液丢失将会发挥积极作用。 在此情况下,不使用超滤不会影响患者术后恢复。 事实上,超滤对减少胸腔引流量、术中、术后血制品的使用、术后机械通气时间等帮助十分有限[23-24]。
HIBM 为多个血液管理措施的集成,因此它不同于以往报道单个措施研究。 如仅通过减少预充将RBC 输注率由40%降到36.3%,RBC 平均输血量由1.52 U 降到 1.20 U[25]。 一项 Mate 分析表明[8]仅使用逆预充技术,围术期RBC 输注率可由95.8%降到54.2%。 仅使用血液分离技术改善凝血功能[26-27],仅通过使用血液回收装置减少术中血液丢失[28-29],这些血液保护效果并不显著,而HIBM 实施后,血制品的输注量和输注率下降均超过80%,提示HIBM的血液保护效果较单一措施更为显著。
然而在实施过程中但需注意以下事项:①血液保护是所有参与手术人员的责任。 本研究仅关注了体外循环期间的血液保护措施。 后期完美的综合性保护措施应包括外科、麻醉、器械护士和ICU 部分;②负压可能会造成血液中RBC 的损伤[30],加重血液破坏。 将 VAVD 的负压控制在-20 ~ -60 mmHg,尽可能降低对血液的破坏作用;③在逆预充实施期间,需要保证血流动力学稳定,所以该技术不能用于低容量状态的患者[8],也不能一味追求效果而增加置换预充液的量[19,31],对老年人、严重脱水患者耐受性差而不适宜使用[32];④对于HIBM 中每一个措施的安全性和有效性,仍需要进一步探索。
尽管如此,本研究充分显示,基于降低血液稀释、减少血液丢失、改善凝血功能的HIBM 措施能够显著降低成人心血管手术血制品需要量和暴露风险。 HIBM 实施简单、有效,值得推荐。

