内生真菌对新渡户树蜂共生真菌的抑制作用*
王立祥 崔树鹏 孔露露 王 萱 杨宗基 任利利 骆有庆
(1.甘肃农业大学植物保护学院 兰州 730070; 2.北京林业大学林木有害生物防治北京市重点实验室 北京 100083)
森林昆虫能与真菌在长期协同进化中形成互相依存的互惠共生关系,即真菌协助昆虫生长发育和适应环境,昆虫则是真菌长期稳定的栖息场所和传播载体(Peteretal., 2020)。这种共生关系不仅使共生菌与宿主昆虫形成稳定的营养共同体,而且有利于“虫菌共生类”昆虫快速占据较多生态位,成为优势类群(Biedermannetal., 2019)。
新渡户树蜂(Sirexnitobei)隶属于膜翅目(Hymenoptera)树蜂科(Siricidae)树蜂属(Sirex)(卢钟宝, 2018),是一种重要的林木钻蛀性害虫(Gaoetal., 2021),在我国河北、北京、内蒙古、吉林、辽宁、甘肃、陕西、江苏、云南等地均有分布(卢钟宝等, 2018)。该虫寄主广泛,可危害多种针叶树种,在不同地区其危害的寄主树种有所差别,主要包括油松(Pinustabulaeformis)、华山松(Pinusarmandii)、樟子松(Pinussylvestrisvar.mongolica)、落叶松(Larix)等。有别于一般钻蛀性害虫仅直接钻蛀树木造成危害,新渡户树蜂具有特殊的“昆虫-共生真菌”复合致害寄主树种的能力(王明等, 2020)。一般来讲,树蜂属昆虫与共生真菌形成严格的一一对应关系,1种树蜂仅携带1种共生菌(Tabataetal., 1997; 1999; Slippersetal., 2003)。如松树蜂(Sirexnoctilio)的共生真菌为Amylostereumareolatum,兰树蜂(S.cyaneus)的共生真菌为A.chailletii。然而,Fitza等(2016)研究发现日本地区的新渡户树蜂携带2种共生真菌,为A.chailletii或A.areolatum,且认为寄主树种是影响新渡户树蜂共生真菌差异的主要原因。
新渡户树蜂的雌成虫体内形成了1对特化的器官——贮菌囊,专门用来贮藏共生菌的分生孢子和菌丝片段。贮菌囊位于雌成虫产卵器基部,与中输卵管相连。新渡户树蜂雌成虫产卵时会将卵和贮菌囊内的共生菌菌丝片段和孢子一起注入寄主树木内(Taylor, 1981)。完成产卵后,虫卵需要等待一段时间才能孵化,此时共生菌菌丝片开始在寄主内大面积生长,它作为一种白腐真菌,能够降解寄主木质纤维素,破坏木质部结构,为初孵幼虫的取食做准备(Thompsonetal., 2013; 2014)。研究认为,共生真菌对新渡户树蜂幼虫而言是不可或缺的,它为幼虫的生长发育提供了必要的营养和活动空间,如果共生真菌在寄主树木内生长受限,新渡户树蜂也将发育不良,甚至死亡(李大鹏, 2015)。然而,新渡户树蜂幼虫在寄主内生长时会面临许多资源竞争者。研究发现,A.chailletii和A.areolatum生长速率缓慢,竞争资源和生态位的能力很弱,能被寄主树木内已定殖的真菌所抑制(Wahl, 2017),从而破坏新渡户树蜂与共生真菌的互利共生关系,影响新渡户树蜂幼虫在寄主内的生长发育(Wangetal., 2019)。
前期研究发现在寄主樟子松内有许多死亡的新渡户树蜂幼虫,尸体已被真菌侵染。幼虫是否因为寄主内生真菌侵染致死尚不明确。于是本文提出1个假设,即卵幼虫死亡的原因是寄主樟子松的内生真菌抑制了新渡户树蜂共生真菌的生长,进而导致幼虫无法取食而死亡。本试验选取的2种真菌大伏革菌(Phlebiopsisgigantea)和绿色木霉(Trichodermaviride)均分离自樟子松内死亡的树蜂幼虫体表,为优势真菌。且前期研究发现,这2种真菌也是樟子松的优势内生真菌(王立祥等, 2017)。因此,本文以新渡户树蜂的共生真菌为研究对象,研究寄主樟子松和油松体内新渡户树蜂共生真菌的种类差异性,比较2种优势内生真菌对新渡户树蜂共生真菌拮抗能力的差异,并对其拮抗机制作初步探讨,研究结果以期为新渡户树蜂的生物防治提供新思路和依据。
1 材料与方法
1.1 供试菌株
1) 2种供试内生真菌大伏革菌和绿色木霉保存于甘肃农业大学植物保护省级重点实验室,其在GenBank上的基因登录号分别为KX099661和KX099655。
2)新渡户树蜂共生真菌A.chailletii和A.areolatum分离自雌成虫贮菌囊。
1.2 试验方法
1.2.1 不同寄主树种新渡户树蜂共生真菌的检出率 2018年4月下旬,在内蒙古通辽市金宝屯镇东风营林区新渡户树蜂发生地分别选取有典型点状流脂且有个别树蜂新鲜羽化孔的樟子松和油松各5株,树龄为20~25年,胸径18~24 cm。将供试样木伐倒后,截成1 m的木段,两端封蜡以防止水分散失,随之寄回甘肃农业大学养虫室。不同虫害木被分别放置在养虫笼中,保持养虫室内的温度为(25±3) ℃,湿度为65%±5%,光照条件为自然光照,直到新渡户树蜂成虫自然羽化。由于该地区的樟子松同时也被松树蜂危害,因而所取样木也可能存在松树蜂,但2种树蜂的羽化时间存在差异。待树蜂羽化期,收集新渡户树蜂雌成虫,解剖贮菌囊,分离共生真菌,并统计不同寄主树种内新渡户树蜂的2种共生真菌检出率。
1.2.2 真菌的生长速率测定 将得到的优势内生真菌绿色木霉和大伏革菌以及新渡户树蜂的共生真菌A.chailletii和A.areolatum分别接种至PDA培养基上活化1周,后用直径4 mm的打孔器取活化好的菌饼,接种至新的PDA平板中心位置,并放置在黑暗条件下25 ℃恒温培养。测量菌丝生长直径的方法为十字交叉法: 在培养皿背部每隔24 h标记菌丝生长的最前沿,测量菌落直径,并求其平均值,待菌丝生长到培养皿边缘时停止测量。然后计算测量的平均值,每种真菌重复5次。用以下公式计算真菌的生长速率。
GR=TLH/GD×100%。
式中:GR为真菌生长速率(mm·d-1),TGLH为菌丝生长总长度(mm),GD为生长天数(d)。
1.2.3 内生真菌与共生真菌的平板对峙试验及镜检 利用平板对峙法来衡量内生真菌对共生菌A.chailletii和A.areolatum的拮抗能力。首先将所有真菌接种于PDA培养基上活化1周,然后用灭过菌的直径为4 mm真菌打孔器进行打孔,由前期生长速率试验结果可知,共生真菌A.areolatum的生长速率明显慢于内生真菌。为使它们有相对公平的竞争起点,按如下方法接种: 首先在PDA培养基的平板中心接种共生菌A.areolatum,待A.areolatum生长4天后,在其培养基平板直径的两侧距边缘20 mm处分别接入内生真菌菌饼;A.chailletii的生长速率与2种内生真菌生长速率无差异,故同时接种。每个处理重复3次,以仅接种4 mm菌饼的A.chailletii和A.areolatum作为对照。计算内生真菌对A.areolatum和A.chailletii菌丝生长的抑制率,计算公式如下:
式中:P为抑制率,C、T分别为对照组、对峙试验中的A.chailletii和A.areolatum菌落半径,d为菌饼的半径。
在平板对峙试验过程中,用小刀片刮取2菌落交界处的菌丝体,制成临时玻片,在显微镜下观察二者菌丝体的生长及相互影响情况。
1.2.4 内生真菌发酵液对共生真菌孢子萌发的影响 内生真菌发酵液的制备(陈曼等, 2008): 将2株优势内生真菌在PDA平板上活化1周后,无菌条件下用直径4 mm的真菌打孔器在菌落边缘打取菌饼。将菌饼分别接种到含有150 mL PDB(葡萄糖3 g; 马铃薯30 g; 蒸馏水150 mL)液体培养基的三角瓶中,每个三角瓶接种5个菌饼,于25 ℃、180 r·min-1培养10天。得到的培养液以5 000 r·min-1离心10 min并取上清液,经过0.22 μm的微孔滤膜真空抽滤,收集发酵滤液,4 ℃保存备用。
将2种共生真菌A.areolatum和A.chailletii分别接种于PDA培养基,10天后用灭菌打孔器打取5 mm菌饼挑于无菌试管中,加入2 mL 0.01%的Tween-80无菌水冲洗、振荡搅动使培养基的真菌孢子尽可能多的存在于无菌水中。然后取1滴孢子悬浮液于显微镜下观察,在低倍镜下(10×10)每个视野内孢子数达到60~100个即可。无菌条件下,取制备好的孢子悬浮液300 μL加入2 mL的灭菌离心管中,加入等体积的不同稀释倍数的内生真菌发酵液(原液,5、10、20、50倍液),再加入200 μL的PDB液体培养基,对照组只加入等量无菌水,振荡混匀。每个处理重复3组,25 ℃恒温培养8 h,镜检孢子萌发情况,并计算抑制率。
1.3 数据分析
统计分析软件使用SPSS 23.0。采用单因素方差分析(One-way ANOVA)对真菌生长速率、平板对峙和发酵液试验中测定参数进行分析,多重比较使用Tukey HSD检验法。Pearson卡方检验用于分析不同寄主树种中新渡户树蜂雌雄虫的数量差异,以及2种共生真菌A.chailletii和A.areolatum的检出率差异。
2 结果与分析
2.1 不同寄主树种新渡户树蜂羽化数及其共生真菌的检出率
从样木中共羽化新渡户树蜂成虫490头。由图1可知,不同寄主树木中,新渡户树蜂雌虫与雄虫羽化数量差异均显著(樟子松:χ2=54.08,df=1,P<0.01; 油松:χ2=87.12,df=1,P<0.01),其中从樟子松中羽化新渡户树蜂163头,雌成虫39头; 从油松中羽化新渡户树蜂327头,雌成虫56头。不同寄主中,雌虫体内分离到的共生真菌种类也存在差异。在樟子松中,39只雌虫共分离共生真菌39株,其中A.chailletii分离到24株,A.areolatum分离到15株(χ2=10.48,df=1,P<0.05)。在油松中,56头雌虫共分离共生真菌53株,A.chailletii分离到19株,A.areolatum分离到34株(χ2=8.91,df=1,P<0.05),且本次分离发现,每头雌成虫只能携带1种真菌,A.chailletii或A.areolatum。
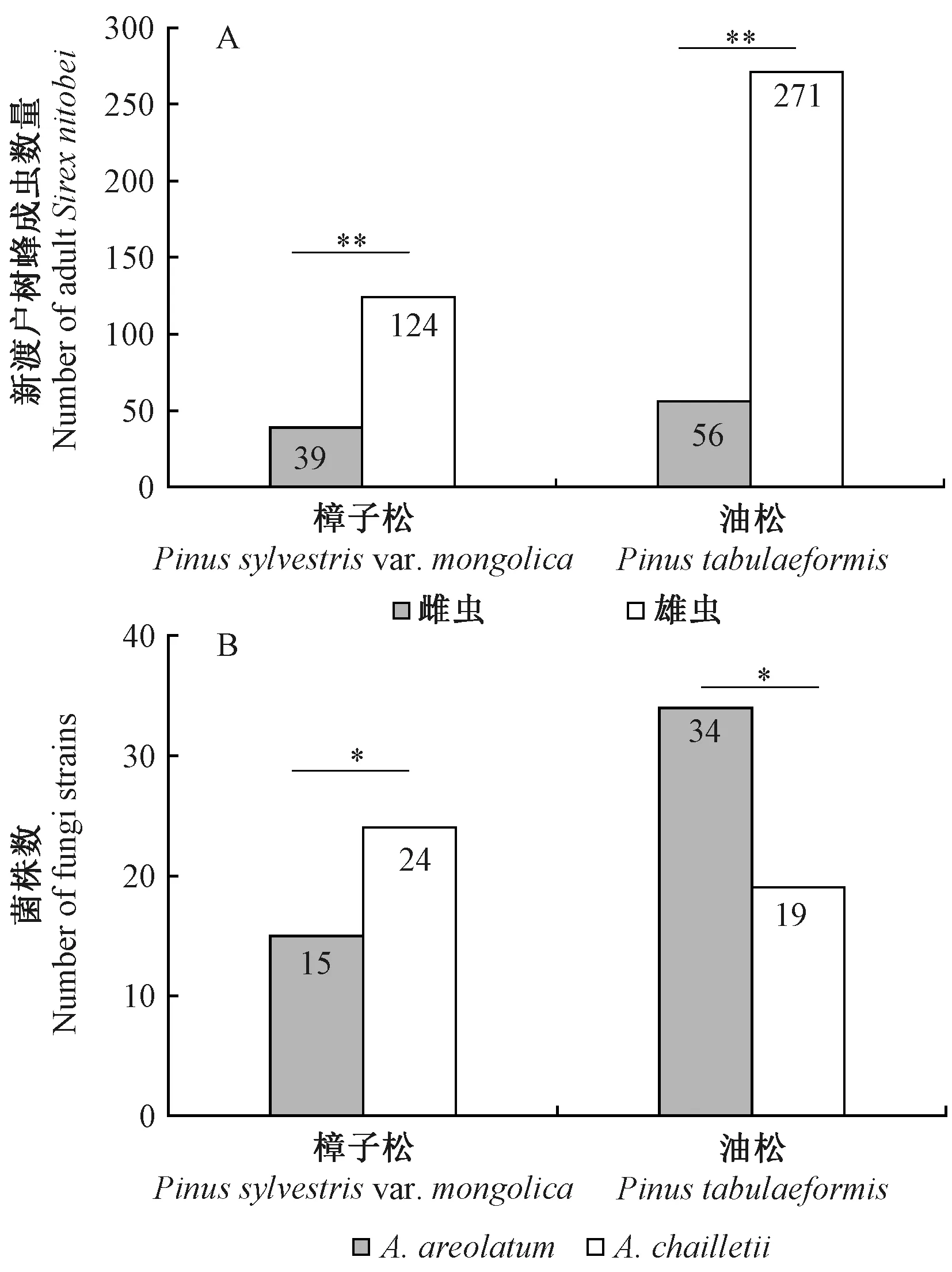
图1 不同寄主树木中新渡户树蜂的羽化数量(A)和新渡户树蜂雌成虫分离不同共生真菌的菌株数(B)Fig. 1 The number of emergences of S. nitobei in different host trees (A) and the number of strains of different symbiotic fungi isolated from female adults of S. nitobei (B)*: P<0.05,**: P<0.01.
2.2 不同真菌的生长速率
由图2可知,4种真菌的生长速率存在显著差异(F=329.99, df=3,P<0.05)。在相同的培养时间下,内生真菌绿色木霉的生长速率最快,菌落直径为(10.13±0.16) mm·d-1; 大伏革菌的生长速率次之。相比于2种内生真菌,新渡户树蜂共生真菌的生长速率均较慢,其中A.areolatum的生长速率最慢,为(4.26±0.2) mm·d-1。大伏革菌和A.chailletii的生长速率无显著差异(F=3.28, df=2,P>0.05)。
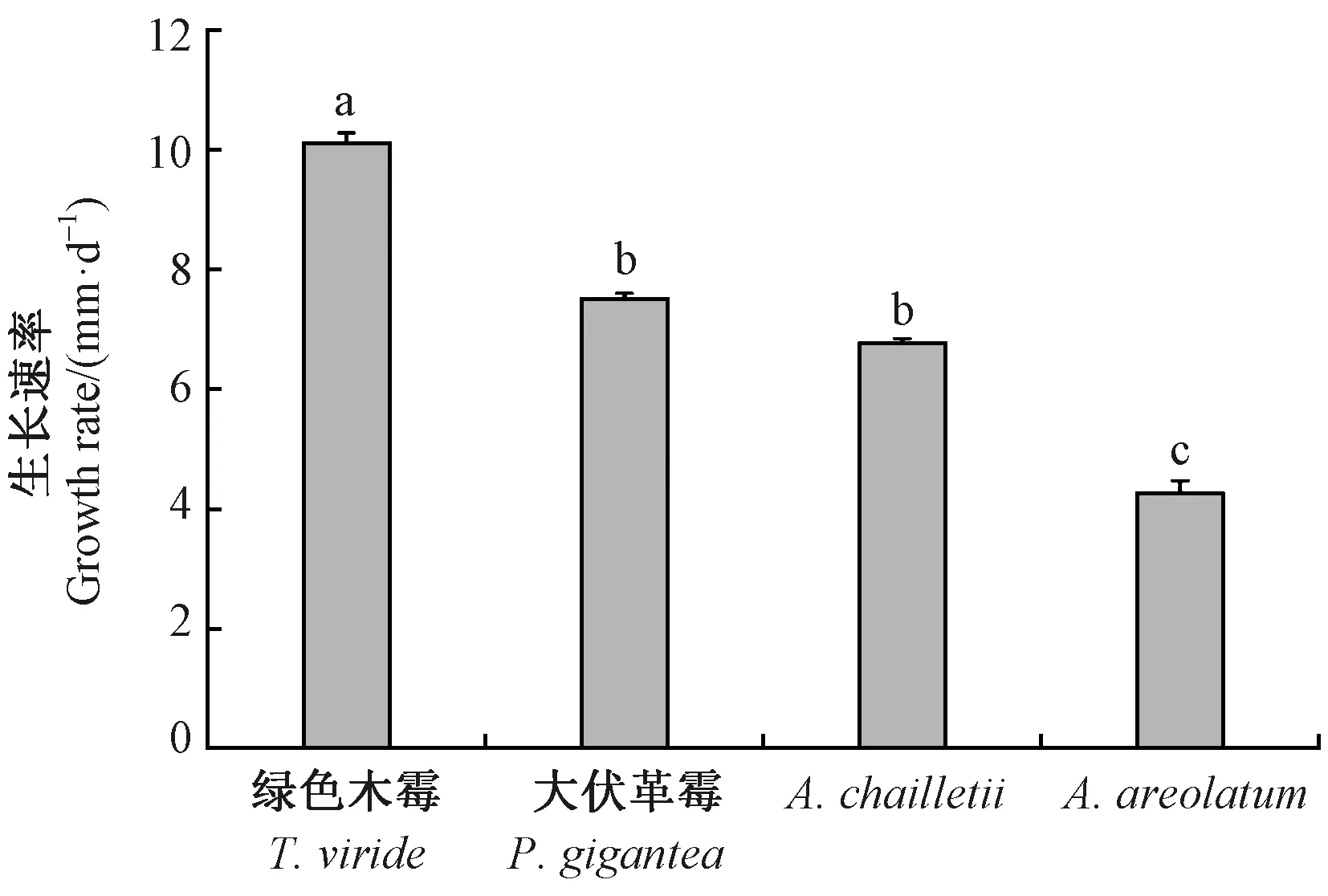
图2 4种真菌的生长速率Fig. 2 The growth rate of four fungi图柱上不同小写字母表示生长速率在0.05水平下差异显著(P<0.05)。Different lowercase letters above columns indicate a significant difference at 0.05 level (P<0.05).
2.3 内生真菌对共生真菌的抑制作用
平板对峙结果表明: 2种内生真菌对新渡户树蜂共生真菌A.chailletii和A.areolatum的生长均具有较强的抑制作用(F=84.1, df=3,P<0.01)(图3)。接种内生真菌1周后,绿色木霉对2种内生真菌的抑制率均大于60%; 大伏革菌对A.areolatum的抑制率为40.16%,而对A.chailletii的抑制率最强,为85.79%(图3A)。接种2周后,内生真菌对共生真菌的抑制作用显著增强,抑制率均超过85%(图3B),但整体而言,绿色木霉抑制新渡户树蜂共生真菌的能力强于大伏革菌。由试验结果可知,当绿色木霉和大伏革菌的菌丝刚接触A.chailletii和A.areolatum的菌丝时,A.chailletii和A.areolatum并没有明显变化; 但在菌丝接触1~2天后,可观察到接触带的菌丝缠绕在一起,并略微上凸; 菌丝接触3~4天后,接触带发生塌陷,培养基背面可观察到明显的抑菌带(图4)。在拮抗后期,发现绿色木霉和大伏革菌的菌丝体均可完全地覆盖A.chailletii和A.areolatum菌落,持续观察20天,检测发现A.chailletii和A.areolatum均无活性,说明绿色木霉和大伏革菌均能完全抑制新渡户树蜂共生真菌的菌丝生长并导致其死亡。其中A.areolatum在受到绿色木霉和大伏革菌的抑制后,菌落由起初的无色逐渐变为黄色,到拮抗后期变为较深的黄褐色,而A.chailletii此现象不明显(图4)。

图3 内生真菌对共生真菌生长的抑制作用Fig. 3 Effects of endophytic fungi on the growth of symbiotic fungiA: 为接种内生真菌1周后的抑制率; B: 为接种内生真菌2周后的抑制率。A: The inhibition rate of endophytic fungi was 7 days after inoculation; B: The inhibition rate of endophytic fungi was 14 days after inoculation.
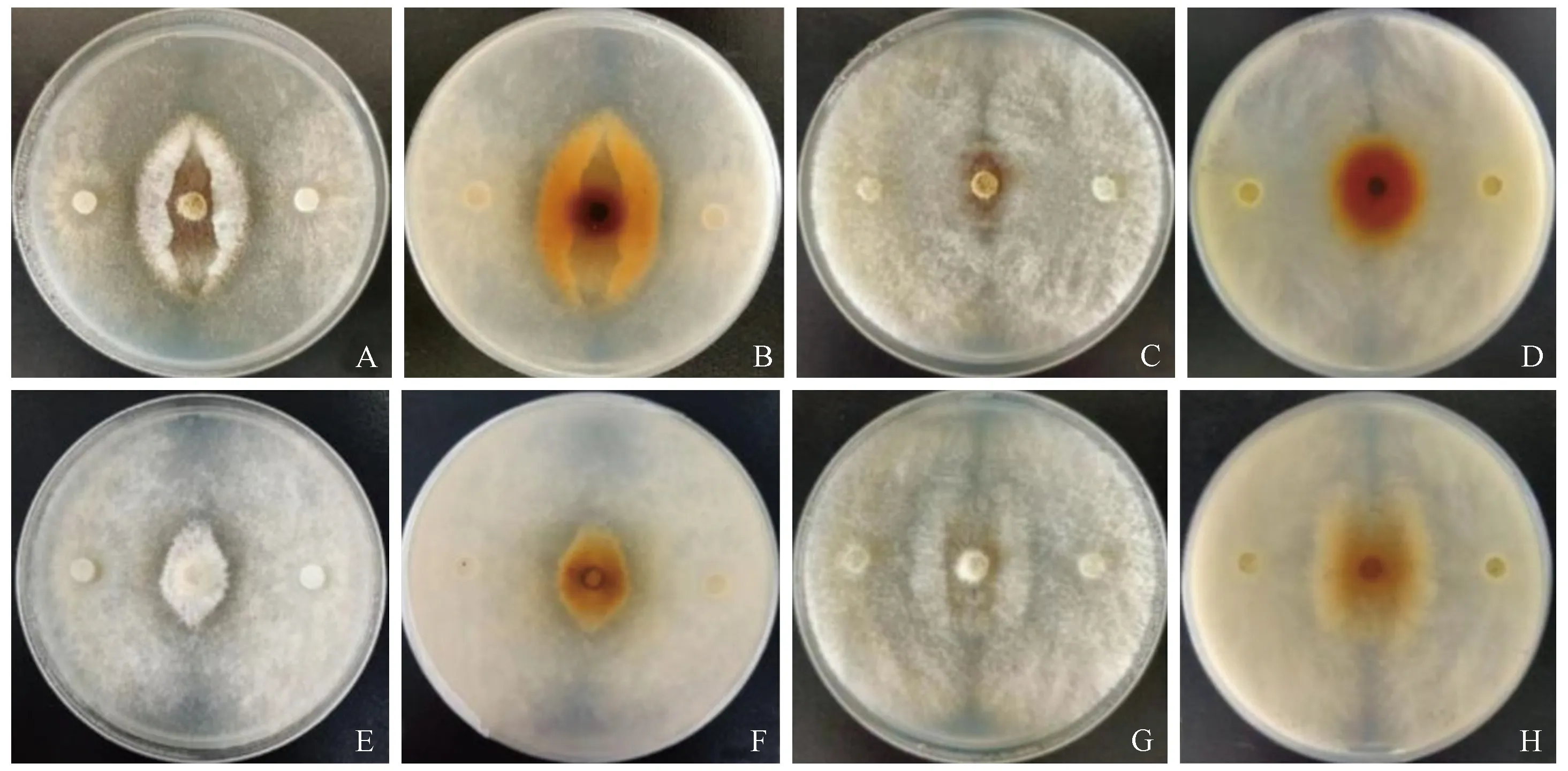
图4 内生真菌对共生菌菌丝的抑制作用Fig. 4 Inhibitory effect of endophytic fungi on hyphae of symbiotic fungi大伏革菌与A. areolatum正面(A)、背面(B)对峙; C: 绿色木霉与A. areolatum正面(C)、背面(D)对峙。大伏革菌与A. chailletii正面(E)、背面(F)对峙; 绿色木霉与A. chailletii正面(G)、背面(H)对峙。P. gigantea vs. A. areolatum front(A), back (B); T. viride vs. A. areolatum front(C), back (D); P. gigantea vs. A. chailletii front(E), back (F); T. viride vs. A. chailletii front(G), back (H).
由镜检结果可知,内生真菌菌丝体以多种方式抑制共生真菌的菌丝生长,可与共生菌菌丝平行生长、寄生、缠绕在共生菌菌丝上(图5A、C、D),也可使共生真菌菌丝发生畸形(图5C、D),有的还能穿入共生真菌菌丝内生长(图5B)。
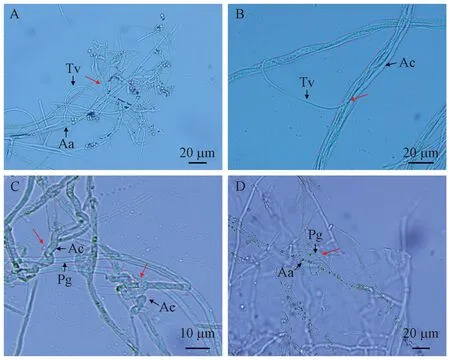
图5 内生真菌对共生真菌生长的影响Fig. 5 Effects of endophytic fungi on the growth of symbiotic fungiA: A. areolatum(Aa)和T. viride(Tv)的菌丝拮抗(缠绕及畸形); B: A. chailletii(Ac)和T. viride的菌丝拮抗(寄生); C: A. chailletii和P. gigantea(Pg)的菌丝拮抗(畸形); D: A. areolatum和P. gigantea 的菌丝拮抗(缠绕)。A: Antagonistic mycelia of A. areolatum (Aa) and T. viride (Tv) (entangulation and deformity); B: Antagonistic mycelia of A. chailletii (Ac) and T. viride (parasitism); C: Antagonistic mycelia of A. chailletii and P. gigantea (Pg) (deformity); D: Hyphae antagonism of A. areolatum and P. gigantea (entanglement).
2.4 内生真菌发酵液对共生真菌孢子萌发的影响
2种内生真菌发酵液对新渡户树蜂共生真菌A.chailletii和A.areolatum的分生孢子萌发均有抑制作用,且不同菌株的发酵液对不同共生真菌分生孢子萌发的抑制作用差异显著。从表1可以看出,内生真菌发酵产物的浓度越高,对孢子萌发的抑制率越高,其中绿色木霉的发酵原液对A.chailletii和A.areolatum的孢子萌发抑制率均最高,分别为42.06%和46.19%。随着内生真菌发酵液浓度降低,其抑制率也随之降低,2种内生真菌发酵液表现出相同的抑制趋势。整体而言,绿色木霉发酵液对A.chailletii和A.areolatum孢子萌发的抑制能力高于大伏革菌发酵液。
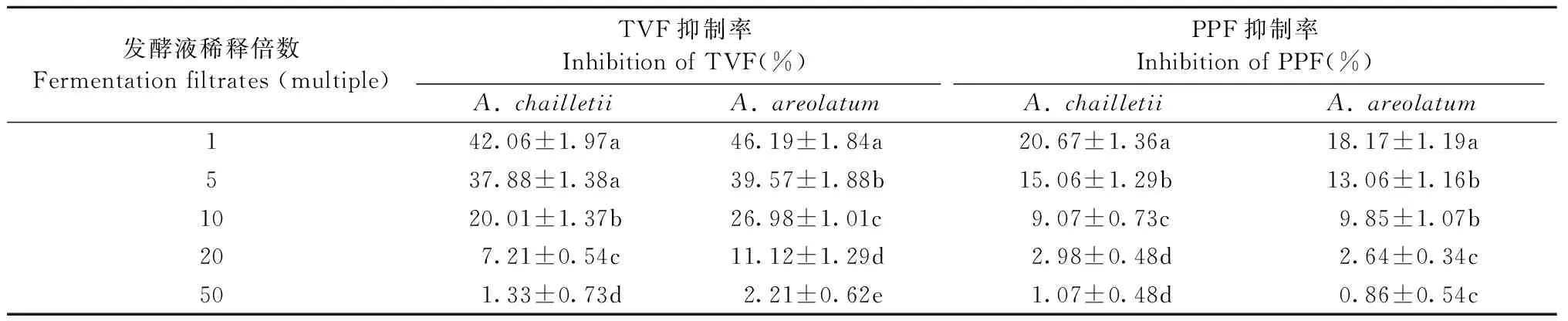
表1 内生真菌发酵液对共生真菌分生孢子萌发的抑制作用①Tab.1 Inhibitory effect to fermentation filtrate sprepared from endophytic fungi on conidiophores germination of A. chailletii and A. areolatum
①TVF: 绿色木霉发酵液; PPF: 大伏革菌发酵液。同列数据后不同小写字母表示差异显著(P<0.05)。TVF: Fermentation filtrates ofT.viride; PPF: Fermentation filtrates ofP.gigantea. Different lowercase letters in the same column indicate significant differences (P<0.05).
3 讨论
昆虫与真菌在长期协同进化过程中形成了相互依存的共生关系(王四宝等, 2017),即昆虫可为真菌提供栖息场所,真菌配合宿主昆虫完成各阶段的生命活动(薛宝燕等, 2004)。多数树蜂科昆虫能与淀粉韧革菌属(Amylostereum)真菌共生。一般来说,1种树蜂只携带1种共生真菌,它们之间有着稳定的共生关系。截至目前,树蜂科昆虫已有报道的共生菌种类共有4种,分别为A.chailletii、A.areolatum、A.ferreum和A.laevigatum(王立祥, 2019; 李大鹏等, 2015; Slippersetal., 2015)。以往研究认为,1种真菌可以分别与不同种树蜂形成共生关系。然而,近来的研究发现,不同地区的同种树蜂可携带不同的共生真菌种类(Fitzaetal., 2016)。本研究结果显示,新渡户树蜂能携带2种共生真菌A.areolatum或A.chailletii,但同一种寄主松树羽化的树蜂雌虫携带共生真菌的比例有差别。其中在油松中羽化的雌成虫携带A.areolatum的比例更高,樟子松中羽化的雌成虫携带A.chailletii比例更高。由此可见,新渡户树蜂携带共生菌的种类与它所侵染寄生树种有关。本研究结果与日本学者的研究结果相同(Fitzaetal., 2016),证实了树蜂与其共生真菌并不遵循严格一一对应的理论。早在1970年,欧美学者已指出寄主树种可能是淀粉韧革菌属真菌与不同种树蜂关联的重要驱动因素,如A.chailletii常与松属(Pinus)之外的其他松科(Pinaceae)植物相关联,而A.areolatum常与松科的松属树种相关联(Prattetal., 2000)。但这一观点不是固定不变的,树蜂携带的共生菌会随着寄主树种和时间的变化而变化。例如本试验中樟子松和油松均属于松属树种,但新渡户树蜂不仅携带A.areolatum,而且也携带A.chailletii。综上所述,在以后的研究中,将结合多种真菌鉴定手段和扩大调查树蜂寄主种类,从采样地和采样量2个维度考虑,探究我国新渡户树蜂共生菌A.areolatum或A.chailletii与不同寄主树种之间的关系,将简单的“树蜂-共生真菌”固化关系转变为“寄主树种-树蜂-共生真菌”三者之间的动态关系。
大伏革菌和绿色木霉都属于腐生菌,可在朽木上大量繁殖,通过营养竞争、重寄生、分泌次级代谢物质及诱导寄主植物产生抗性等多种方式防治植物病虫害的发生(张晓梦等, 2020)。本试验所选取的优势内生真菌大伏革菌和绿色木霉对新渡户树蜂2种共生真菌的生长均有较强的抑制作用。平板对峙试验发现,大伏革菌和绿色木霉的菌丝体在PDA培养基上会显著侵占共生菌的生存资源和空间,通过营养掠夺、缠绕和寄生等方式使共生菌生长不良,最终会完全覆盖共生菌并导致其死亡。在发酵液试验中,2种内生菌发酵液对共生菌孢子萌发均有抑制作用,且绿色木霉发酵液抑制效果优于大伏革菌发酵液。随着内生真菌发酵液浓度降低,其抑制率也随之递减。从这个理论角度出发,可以认为寄主树种内绿色木霉和大伏革菌定殖率越高,其对新渡户树蜂侵染的抗性能力越强(王立祥, 2019)。
大伏革菌对针叶树根腐病有很好的防治效果,目前已研制出大伏革菌的商品化制剂(李杏春等, 2014),它不仅能够控制已发病的树木,还能有效地防控周围树木感染,并且对生态环境的影响较小。仅在欧洲,每年约有62 000 hm2的欧洲云杉(Piceaabies)使用大伏革菌菌剂(Thor, 2003)。相较于大伏革菌,绿色木霉的生防作用早已被各国科学家所证实,木霉菌制剂对于一些土传病原菌都有很好的防治效果,如立枯丝核菌(Rhizoctoniasolani)、镰刀菌(Fusariumspp.)、核盘菌(Sclerotiniaspp.)、疫霉菌(Phytopthoraspp.)等。早在1981年,防治果树银叶病的木霉菌制剂已经在西欧国家商品化生产,在我国江浙一带有用木霉菌防治茉莉花(Jasminumsambac)白绢病的报道(刘士旺, 2003)。其中的绿色木霉可对松落针病病原菌有较好的抑制效果(祁金玉等, 2014)。新渡户树蜂作为一种次期性害虫,严重危害衰弱的针叶树。本试验结果发现,绿色木霉和大伏革菌能够抑制并杀死新渡户树蜂共生真菌,破坏树蜂与共生真菌的互惠共生关系。在今后的生产实践中,可以在树蜂产卵前期,对衰弱木采取树干注射、灌根、飞机施药等方法施用绿色木霉和大伏革菌的生物菌剂,使这些真菌提前占据生态位,抑制树蜂共生真菌生长,降低产卵率和幼虫成活率,达到害虫防治效果。这种防治方法对我国入侵害虫松树蜂等其他树蜂昆虫也同样有效。
4 结论
本研究从樟子松中死亡树蜂幼虫体表分离的优势内生真菌大伏革菌和绿色木霉对新渡户树蜂共生真菌A.chailletii和A.areolatum均具有显著的抑制作用,其中平板对峙试验中2株内生真菌可完全抑制并杀死新渡户树蜂共生真菌的菌落。寄主樟子松对新渡户树蜂及其共生真菌的入侵与定殖有一定的抵抗能力。本试验结果为新渡户树蜂的生物防治提供了菌株资源,为樟子松内生真菌的开发利用奠定了基础。

