参芪蛭龙汤通过ERK/cPLA2 信号通路对膜性肾病小鼠的治疗作用及机制研究
薛丕良,李丽琦,徐梅秀,李星宇,王 顺,2
(1.黑龙江省中医药科学院,黑龙江哈尔滨 150036;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
膜性肾病(membranous nephropathy,MN)是成人肾病综合征(nephrotic syndrome,NS)的主要病理类型之一,约占成人NS 的20%[1]。MN 的主要病理特征表现为肾小球基底膜增厚、免疫复合物在上皮下弥漫性沉积及IgG 颗粒样沿毛细血管袢沉积,主要临床表现为水肿、高脂血症、低白蛋白血症和大量蛋白尿[2]。2003~2014 年,MN 的发病频率增加了近一倍,发病率仅次于IgA 肾病,其中三分之一的患者会发展为终末期肾病[3,4]。
临床上,西医对MN 的治疗效果并不理想,利妥昔单抗或环磷酰胺(cytoxan,CTX)联合类固醇是临床治疗MN 的主要方法,但感染、肾毒性、骨髓毒性、癌症等副作用的发生,以及大多数患者在停药后会复发,导致患者多次住院治疗[5-7]。近年来,中医药在治疗MN 方面取得较好的疗效,与西药相比,中药能更快地提高血清白蛋白水平、从而更好地缓解水肿、疲劳等症状,且不良反应少[8]。
中医认为,本病的病机主要为脾肾两虚,湿浊瘀阻,通常以补益脾肾,化瘀利湿为主要治疗法则[9]。参芪蛭龙汤是临床治疗MN 的复方制剂,已在临床应用10 年有余,疗效显著[10]。本方中以黄芪、党参、淫羊藿为君药,其中黄芪补肺脾之气,为补气要药,且具有升举阳气、利水退肿之效;党参补益脾胃之气;淫羊藿补命门,益精气,利小便,补肾壮阳。川芎、当归、僵蚕、水蛭、地龙为臣药,其中川芎活血行气;当归养血活血;地龙通经络、利小便;僵蚕化痰软坚散结;水蛭治恶血,瘀血,月闭,破血瘕积聚,利水道。凤尾草、虎杖为佐药,虎杖活血祛瘀、清热利湿;凤尾草利湿消肿。全方共凑补脾益肾,活血化瘀,利湿消肿之效。
根据症候表现不同,临床上在参芪蛭龙汤方基础上加减应用治疗气虚血瘀型MN 及特发性MN,取得较好疗效[11,12]。前期药理研究已表明,参芪蛭龙汤对MN 大鼠的治疗作用与下调肾脏组织转化生长因子-β1(transforming growth factor-β1,TGF-β1)和乙酰肝素酶1(heparanase 1,HPA-1)的表达水平相关,从而改善肾脏肾小球足突病理变化[13]。本实验通过建立小鼠MN 模型,通过观察参芪蛭龙汤对肾脏Nephrin-Podocin-Neph1 受体复合物及ERK/cPLA2 通路的影响,进一步探讨参芪蛭龙汤治疗MN 的具体的分子机制,为临床用药提供科学依据。
1 材料与方法
1.1 药物
参芪蛭龙汤中药材饮片(党参、黄芪、水蛭、地龙、当归、川芎、虎杖、僵蚕、淫羊藿、凤尾草)均购自于黑龙江中医药大学附属第一医院。雷公藤多苷片(湖南千金协力药业有限公司,批准文号:国药准字Z43020138,规格:10 mg/片)。
1.2 动物
SPF 级ICR 小鼠60 只,雌雄各半,6 周龄,体质量(23±4)g,购于辽宁长生生物科技股份有限公司,动物生产合格证号:SCXK(辽)2020-0001。动物使用许可证号SCXK(黑)2018-003。动物饲养环境为恒温23~25 ℃,相对湿度为50%~55%,12 h昼夜节律的动物房,自由饮水及进食。适应性喂养一周。所有动物实验均获黑龙江省中医药科学院动物伦理委员会批准同意,编号:201912014。
1.3 试剂
阳离子牛血清白蛋白(c-BSA)(美国Chondrex公司,货号:9058,规格:20 mg);完全弗氏佐剂(美国Chondrex 公司,货号:7008);白蛋白(albumin,ALB)、总蛋白(total protein,TP)、血肌酐(Creatinine,CRE)、尿素氮(urea nitrogen,UREA)、胆固醇(cholesterol,CHO)、甘油三脂(triglyceride,TG)(中生北控生物科技股份有限公司,批号分别为181511、182512、181401、183105、182022、187831);微量总蛋白测定试剂盒(德国德赛诊断系统有限公司,批号:60137949);BeyoFast SYBR Green One-Step qRT-PCR Kit(北京碧云天科技有限公司,货号:D7268M);蛋白酶磷酸酶抑制剂混合物(北京碧云天科技有限公司,货号:P1051);IL-6、IL-4 和TNF-α 检测试剂盒(南京建成生物工程研究所,批号均为:20200326);兔抗鼠p-cPLA2 抗体(美国Affinity 公司,货号分别为:AF3329)、兔抗鼠cPLA2 抗体、p-ERK1/2 抗体、ERK1/2 抗体(沈阳万类生物科技有限公司,货号分别为:WL02539、WLP1512、WL01864);HRP 标记山羊抗兔IgG 二抗(美国Thermo Fisher Scientific 公司,货号:31490);苏木素(北京索莱宝科技有限公司公司,货号:517-28-2);山羊血清(北京索莱宝科技有限公司,货号:SL038);DAB(迈新试剂公司,货号:DAB-1031)。
1.4 仪器
PUZS-600A 型全自动生化分析仪(北京普朗新技术有限公司);CX23 光学显微镜(德国Leica 公司);RM2235 切片机(德国Leica 公司);iMark 型全自动酶标仪(美国BIO-RAD 公司);RM2016 型石蜡切片机(莱卡显微系统(上海)有限公司);Amersham Imager 600 型凝胶成像系统(美国GE 公司);CP100NX 型超速冷冻离心机(日本HIMAC 公司)。
1.5 方法
1.5.1 药物制备 取党参20 g、当归15 g、黄芪30 g、水蛭5 g(需研末)、川芎15 g、僵蚕15 g、地龙20 g、虎杖15 g、凤尾草15 g、淫羊藿30 g,加10 倍量水浸泡1 h,武火煎煮1 h,滤过,收集药液。药渣再加10 倍量水,煎煮1 h,滤过,收集药液。合并两次滤液后,浓缩至1.2 g/mL,分装后,-80 ℃冰箱冻存。
1.5.2 膜性肾病模型制备 参照文献方法制备模型肾病小鼠模型[14],具体方法如下:小鼠适应性喂养3 d 后,随机分为空白对照组(10 只)和造模组(50只)。将阳离子牛血清白蛋白(c-BSA)(2 mg/mL,10 mL PBS)与等体积的弗氏完全佐剂混合,制备成乳浊液。小鼠尾根部、腹股沟多点皮下注射上述制备好的乳浊液0.2 mL(c-BSA:0.2 mg),进行初次免疫。2 周后,造模组小鼠首次尾静脉注射100 μg(c-BSA:0.1 mg/mL,体积1 mL),隔日注射,注射剂量增加至300 μg(c-BSA:0.3 mg/mL,体积1 mL),每周注射3 次,连续4 周。造模结束后,测定24 h 尿蛋白数值,大于8 g/L,为模型成功小鼠。
1.5.3 动物分组及给药 将造模成功的小鼠按照尿蛋白数值随机分为模型组及参芪蛭龙汤低、高剂量组(12、24 g 生药/kg,按生药总量计;根据体表面积换算法,其分别为人临床等效剂量0.5、1 倍)和雷公藤多苷片组(14 mg/kg,为人临床等效剂量1 倍)。空白组小鼠给予等体积蒸馏水,每日1 次,连续4 周。
1.5.4 血液生化指标测定 末次给药后,各组小鼠摘眼球取血,肝素钠抗凝后,低温下3 000 r/min 离心10 min,分离血浆,应用全自动生化分析仪测定各组小鼠TG、TC、TP、ALB、CRE、UA、UREA 的含量。应用全自动酶标仪,按照酶联免疫试剂盒说明书操作,测定血清IL-6、IL-4 和TNF-α 含量。
1.5.5 尿蛋白测定 末次给药前1 d,代谢笼,收集各组小鼠24 h 尿液,应用全自动生化分析仪,采用邻苯三酚红比色法测定尿蛋白值。
1.5.6 肾脏HE 染色 末次给药后1 h,各组小鼠腹腔注射5%水合氯醛(0.7 mL/100 g)麻醉后,无菌分离小鼠肾脏组织,立即放入4%多聚甲醛缓冲液中固定过夜。梯度浓度乙醇逐级脱水后,滴加液体石蜡,冷却后制成蜡块。切片机手动切片,厚度为5 μm。参照试剂盒说明书进行染色并于光镜下观察。
1.5.7 肾脏免疫组化染色 无菌分离小鼠肾脏组织,4%多聚甲醛缓冲液中固定过夜。用切片机将肾组织蜡块切成4 μm 厚的薄片,切片烘烤后放入装有二甲苯的溶液中脱蜡、梯度浓度酒精进行脱水,然后用柠檬酸缓冲液进行抗原修复。3%过氧化氢孵育后,10%正常山羊血清室温封闭。一抗孵育、二抗孵育、DAB 显色、苏木素复染,最后脱水、透明、封片,在显微镜下观察切片效果,并拍照。
1.5.8 RT-PCR 法检测肾脏组织Neph-1、Nephrin及Podocin 表达 将冻存组织从-80 ℃冰箱中取出,称取500 mg 组织至于研钵中,向研钵中倒入少量液氮,研磨成细粉后,转移至无RNA 酶的1.5 mL离心管中,加入1 mL Trizol 裂解液,混匀后,静置10 min。加入0.2 mL 氯仿,混匀10 s,静置5 min。4 ℃,12 000 r/min,离心10 min 后,混合液分为3 层即无色的水相、中间层和黄色的有机相,将水相转移到新的离心管中。加入与水等体积的异丙醇,混匀后,置于-20 ℃条件下过夜。15 h 后,10 000 r/min,离心10 min,弃上清。加入1 mL 75%乙醇清洗沉淀。4 ℃3 400 r/min 离心3 min,弃上清后室温放置5 min,让残留的乙醇挥发。加30 μL 无RNA酶的ddH2O,充分混匀,待沉淀完全溶解,即为肾脏组织样本的总RNA。测定RNA 浓度后,根据Beyo-Fast SYBR Green One-Step qRT-PCR Kit。对上述提取的肾脏组织总RNA 进行反转录反应和PCR 反应。引物序列如下:Neph-1 上游引物:ACCTGTCGCAGTATGAATGA,下游引物:CCACCTGTAGCCCAAGAT;Nephrin 上游引物:ACTATGCCCTCTTCAAATGC,下游引物:CTCACGCTCACAACCTTCA;Podocin 上游引物:AGGATGGCGGCTGAGATT,下游引物:TGGTTTGGAGGAACTTGG;β-actin 上游引物:CTGTGCCCATCTACGAGGGCTAT,下游引物:TTTGATGTCACGCACGATTTCC。目的基因的相对表达量用2-ΔΔCt来表示。
1.5.9 Western-blot 法检测肾脏组织ERK 及cPLA2蛋白表达 称取500 mg 冻存肾脏组织至于研钵中,向研钵中倒入少量液氮,研磨成细粉后,转移至1.5 mL 离心管中,加入1 mL 加强型RIPA 裂解液(含1×蛋白磷酸酶抑制剂),冰浴下裂解30 min,低温12 000g离心10 min,收集上清总蛋白提取液。蛋白定量、变性后,按SDS-PAGE 凝胶制备试剂盒说明进行电泳,然后进行湿转印,封闭。加入p-ERK1/2(1∶1 500)、ERK1/2(1∶1 500)、p-cPLA2(1∶2 000)、cPLA2(1∶1 500)和β-actin(1∶2 000)一抗稀释液,4 ℃孵育过夜。次日,将孵育一抗后的NC 膜取出,放入TBST 中清洗5 min,共3 次,用TBST 按比例稀释二抗,室温孵育2 h。将孵育完二抗的NC 膜浸入TBST 中清洗5 min,共3 次。然后加入配置好的ECL 发光试剂,室温避光备用。曝光成像,结果用Image J 凝胶图片处理软件分析目标条带的灰度值。
1.6 统计学处理
2 结果
2.1 参芪蛭龙汤对MN 小鼠UTP 及肝功能的影响
与空白组比较,模型组小鼠UTP 值显著升高(P<0.01)。与模型组比较,给药后,参芪蛭龙汤低剂量组、高剂量组和雷公藤多苷片组小鼠UTP 值显著下降(P<0.01)。此外,与空白组比较,模型组小鼠ALB 和TP 含量均显著降低(P<0.01),与模型组比较,参芪蛭龙汤低剂量、高剂量组小鼠TP、ALB 含量均显著升高(P<0.05、P<0.01);雷公藤多苷片组TP 含量显著升高(P<0.05),而对ALB 的含量无影响(P>0.05)。见表1。
表1 参芪蛭龙汤对MN 小鼠UTP 及肝功能的影响(g/L,n=10,±s)Tab 1 Effects of Shenqi Zhilong Decoction on UTP and liver function in MN mice(g/L,n=10,±s)
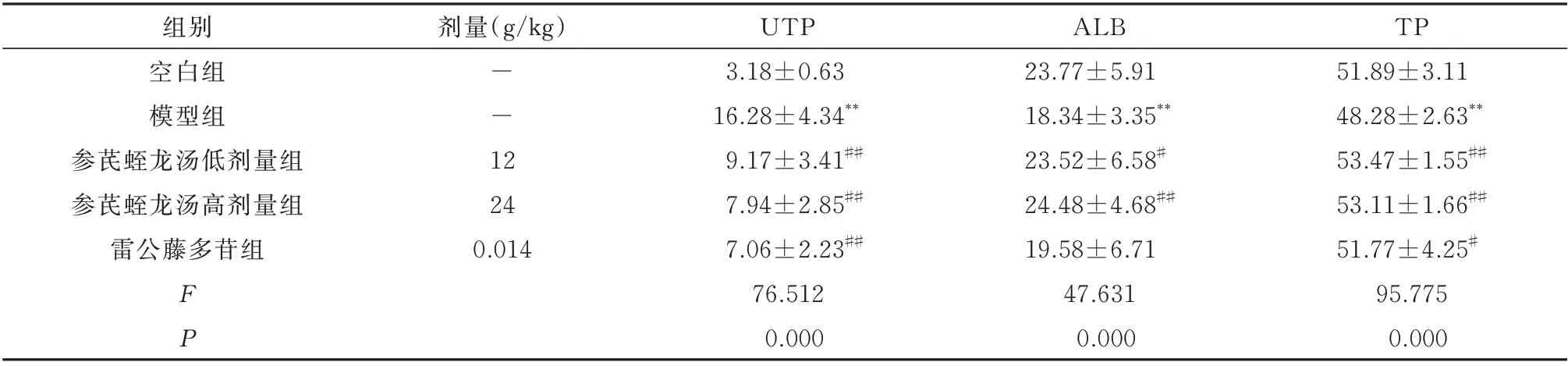
表1 参芪蛭龙汤对MN 小鼠UTP 及肝功能的影响(g/L,n=10,±s)Tab 1 Effects of Shenqi Zhilong Decoction on UTP and liver function in MN mice(g/L,n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
TP 51.89±3.11 48.28±2.63**53.47±1.55##53.11±1.66##51.77±4.25#95.775 0.000组别空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组剂量(g/kg)--1 2 24 0.014 FP UTP 3.18±0.63 16.28±4.34**9.17±3.41##7.94±2.85##7.06±2.23##76.512 0.000 ALB 23.77±5.91 18.34±3.35**23.52±6.58#24.48±4.68##19.58±6.71 47.631 0.000
2.2 参芪蛭龙汤对MN 小鼠肾功能的影响
与空白组比较,模型组小鼠CRE、UREA、UA含量无显著变化(P>0.05)。与模型组比较,参芪蛭龙汤低剂量、高剂量组CRE、UREA、UA 含量无显著变化(P>0.05);雷公藤多苷片组CRE 显著升高(P<0.05)、UREA 显著降低(P<0.01)。见表2。
表2 参芪蛭龙汤对MN 小鼠肾功能指标的影响(μmol/L,n=10,±s)Tab 2 Effect of Shenqi Zhilong Decoction on renal function indexes of MN mice(μmol/L,n=10,±s)
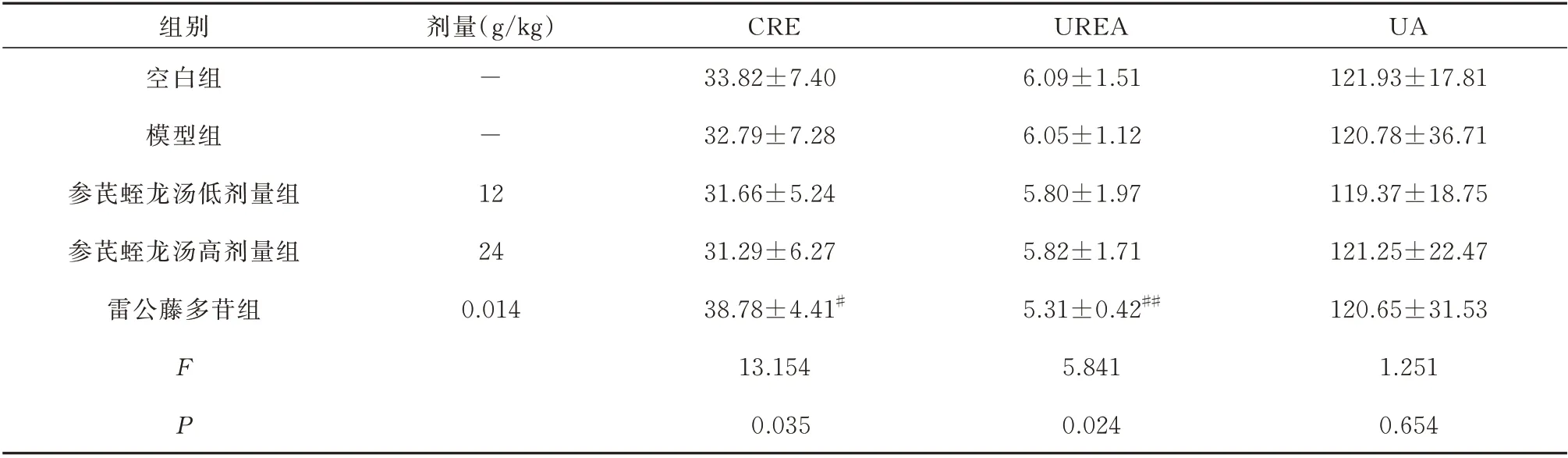
表2 参芪蛭龙汤对MN 小鼠肾功能指标的影响(μmol/L,n=10,±s)Tab 2 Effect of Shenqi Zhilong Decoction on renal function indexes of MN mice(μmol/L,n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
UA 121.93±17.81 120.78±36.71 119.37±18.75 121.25±22.47 120.65±31.53 1.251 0.654组别空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组剂量(g/kg)--1 2 24 0.014 FP CRE 33.82±7.40 32.79±7.28 31.66±5.24 31.29±6.27 38.78±4.41#13.154 0.035 UREA 6.09±1.51 6.05±1.12 5.80±1.97 5.82±1.71 5.31±0.42##5.841 0.024
2.3 参芪蛭龙汤联对MN 小鼠血脂的影响
与空白组比较,模型组CHO、TG 含量显著上升(P<0.05)。与模型组比较,参芪蛭龙汤低剂量、高剂量组及雷公藤多苷片组小鼠CHO 含量均显著降低(P<0.05);参芪蛭龙汤低剂量、剂量组TG 含量显著降低(P<0.05),而雷公藤多苷片组小鼠TG含量无显著变化(P>0.05)。见表3。
表3 参芪蛭龙汤对MN 小鼠血脂的影响(mmol/L,n=10,±s)Tab 3 Effect of Shenqi Zhilong Decoction on blood lipid in MN mice(mmol/L,n=10,±s)
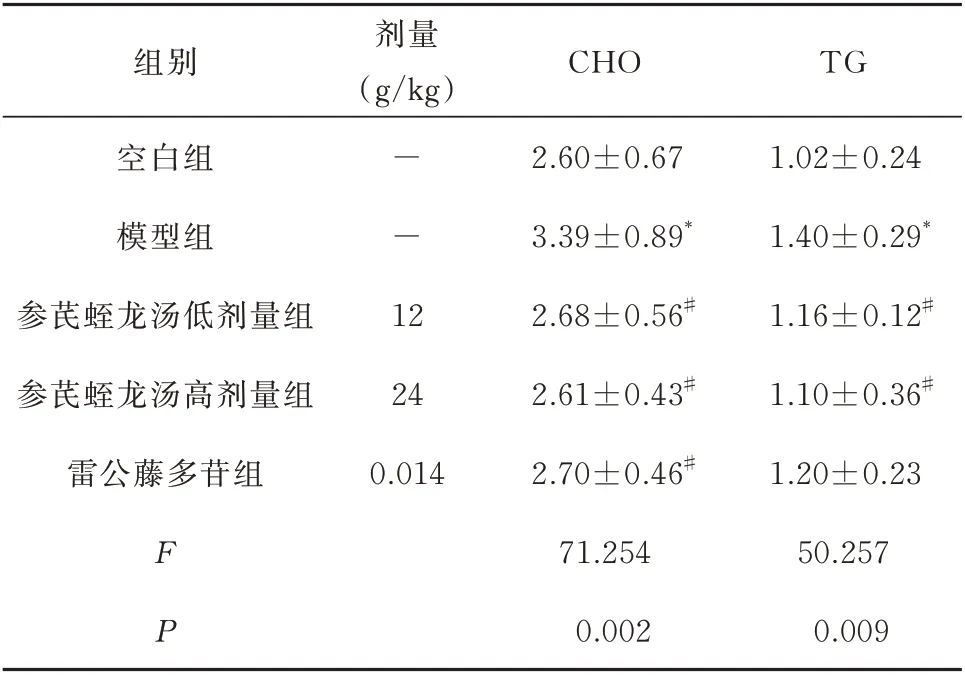
表3 参芪蛭龙汤对MN 小鼠血脂的影响(mmol/L,n=10,±s)Tab 3 Effect of Shenqi Zhilong Decoction on blood lipid in MN mice(mmol/L,n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别剂量(g/kg)CHO TG空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组--1 2 24 0.014 2.60±0.67 3.39±0.89*2.68±0.56#2.61±0.43#2.70±0.46#1.02±0.24 1.40±0.29*1.16±0.12#1.10±0.36#1.20±0.23 50.257 0.009 FP 71.254 0.002
2.4 参芪蛭龙汤对MN 小鼠肾脏病理变化的影响
空白组小鼠肾小球系膜、管腔大小正常。模型组小鼠肾小球出现分叶现象,肾小球系膜增厚、管腔扩大、肾小囊壁上皮破损、细胞数量减少。与模型组比较,参芪蛭龙汤低剂量、高剂量组及雷公藤多苷片组小鼠肾小球系膜增厚、管腔扩大、上皮破损现象明显减轻,细胞数量趋向正常,其中以参芪蛭龙汤高剂量组最佳。
此外,空白组小鼠肾脏组织中IgG 表达呈阴性,即无IgG 沉积。模型组小鼠IgG 表达显著升高,即有大量IgG 沉积。与模型组比较,参芪蛭龙汤低剂量、高剂量组及雷公藤多苷片组小鼠甚至组织中IgG 表达显著降低,即IgG 沉积减少,其中以参芪蛭龙汤高剂量组最佳。见图1。
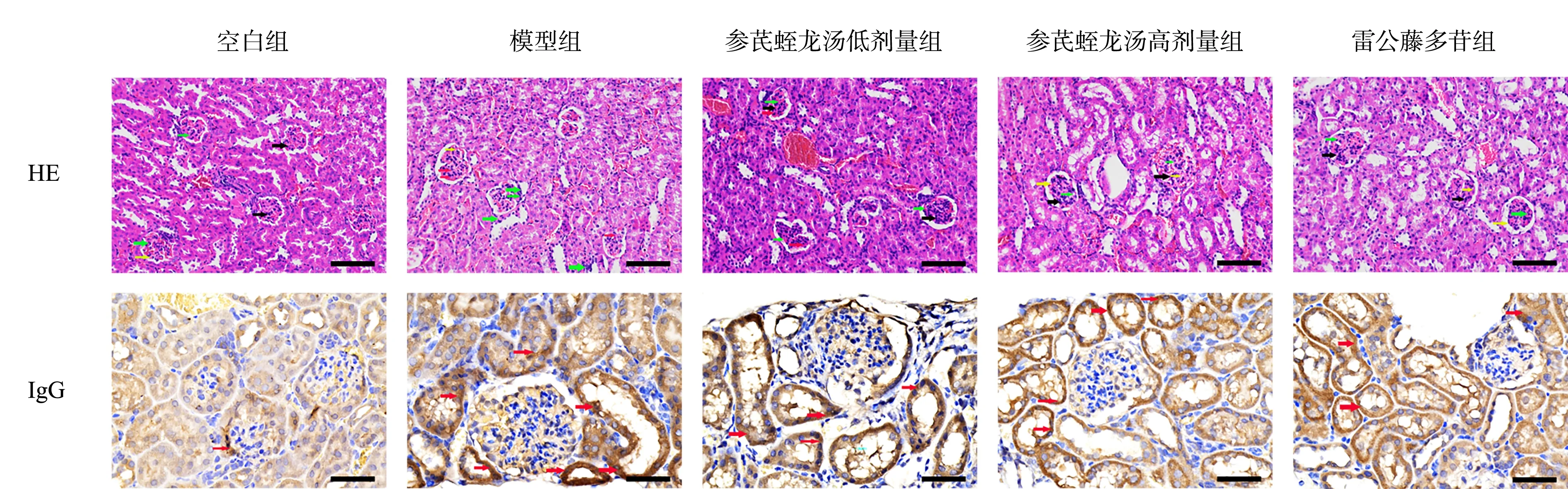
图1 参芪蛭龙汤对MN 小鼠肾脏病理形态及IgG 表达的影响(×200)Fig 1 Effects of Shenqi Zhilong Decoction on renal pathological morphology and IgG expression in MN mice(×200)
2.5 参芪蛭龙汤对MN 小鼠血清IL-6、IL-4、TNF-α含量的影响
与空白组比较,模型组小鼠血清IL-6、IL-4、TNF-α 含量均显著升高(P<0.01)。与模型组比较,参芪蛭龙汤低剂量、高剂量组及雷公藤多苷片组小鼠血清IL-6、IL-4 和TNF-α 的含量显著降低(P<0.05、P<0.01)。见表4。
表4 参芪蛭龙汤对MN 小鼠血清IL-6、IL-4、TNF-α 含量的影响(ng/L,n=10,±s)Tab 4 Effects of Shenqi Zhilong Decoction on serum IL-6,IL-4 and TNF-α in MN mice(ng/L,n=10,±s)

表4 参芪蛭龙汤对MN 小鼠血清IL-6、IL-4、TNF-α 含量的影响(ng/L,n=10,±s)Tab 4 Effects of Shenqi Zhilong Decoction on serum IL-6,IL-4 and TNF-α in MN mice(ng/L,n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
TNF-α 11.16±7.66 105.64±31.25**73.16±27.71#68.81±25.17##67.85±26.44##135.153 0.000组别空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组剂量(g/kg)--1 2 24 0.014 FP IL-6 105.62±7.92 125.74±18.06**110.39±10.65#105.73±11.59##102.60±16.43##22.367 0.000 IL-4 57.77±11.19 80.32±12.57**67.33±10.44#65.84±10.34#64.89±11.54#29.574 0.000
2.6 参芪蛭龙汤对MN 小鼠ERK/cPLA2 信号通路的影响
与空白组比较,模型组小鼠肾脏组织p-ERK1/2 和p-cPLA2 蛋白表达显著升高(P<0.01),cPLA2和ERK1/2 蛋白表达无显著变化(P>0.05)。与模型组比较,参芪蛭龙汤低剂量、高剂量及雷公藤多苷片组p-cPLA2 和p-ERK1/2 蛋白表达显著降低(P<0.05、P<0.01),cPLA2 和ERK1/2 蛋白表达无显著变化(P>0.05)。见表5、图2。
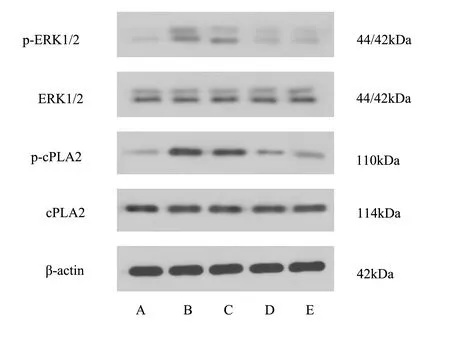
图2 参芪蛭龙汤对MN 小鼠ERK/cPLA2 信号通路的影响Fig 2 Effect of Shenqi Zhilong Decoction on ERK /cPLA2 signaling pathway in MN mice
表5 参芪蛭龙汤对MN 小鼠ERK/cPLA2 信号通路的影响(n=10,±s)Tab 5 Effect of Shenqi Zhilong Decoction on ERK / cPLA2 signaling pathway in MN mice(n=10,±s)

表5 参芪蛭龙汤对MN 小鼠ERK/cPLA2 信号通路的影响(n=10,±s)Tab 5 Effect of Shenqi Zhilong Decoction on ERK / cPLA2 signaling pathway in MN mice(n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别剂量(g/kg)相对表达量ERK1/2/β-actin 0.41±0.05 0.39±0.04 0.41±0.07 0.40±0.08 0.41±0.03 1.264 0.234 p-cPLA2/cPLA2 0.21±0.02 0.99±0.06**0.81±0.06##0.21±0.09##0.29±0.03##45.126 0.000空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组cPLA2/β-actin 0.59±0.03 0.57±0.05 0.60±0.04 0.60±0.03 0.57±0.04 1.147 0.341--1 2 24 0.014 FP p-ERK1/2/ ERK1/2 0.22±0.06 0.92±0.08**0.53±0.09##0.36±0.08##0.37±0.06##64.245 0.000
2.7 参芪蛭龙汤对MN 小鼠肾脏组织Nephrin、Podocin 和Neph1 表达的影响
与空白组比较,模型组小鼠肾脏组织Nephrin、Podocin 和Neph1 mRNA 表达显著降低(P<0.01)与模型对照组比较,参芪蛭龙汤低剂量、高剂量及雷公藤多苷片组小鼠肾脏组织中Nephrin、Podocin及 Neph1 mRNA 表达显著升高(P<0.01)。见表6。
表6 参芪蛭龙汤对MN 小鼠脏组织Nephrin、Podocin 和Neph1 表达的影响(n=10,±s)Tab 6 Effect of Shenqi Zhilong Decoction on the expression of Nephrin,Podocin and Neph1 in visceral tissue of MN mice(n=10,±s)
表6 参芪蛭龙汤对MN 小鼠脏组织Nephrin、Podocin 和Neph1 表达的影响(n=10,±s)Tab 6 Effect of Shenqi Zhilong Decoction on the expression of Nephrin,Podocin and Neph1 in visceral tissue of MN mice(n=10,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别剂量(g/kg)相对表达量Podocin 1.00±0.05 0.19±0.04**0.41±0.07##0.68±0.03##0.66±0.06##214.025 0.000 Neph1 1.00±0.06 0.22±0.02**0.58±0.11##0.85±0.11##0.81±0.09##132.015 0.000空白组模型组参芪蛭龙汤低剂量组参芪蛭龙汤高剂量组雷公藤多苷组--1 2 24 0.014 FP Nephrin 1.00±0.04 0.28±0.05**0.52±0.05##0.75±0.04##0.77±0.05##141.58 0.000
3 讨论
阳离子化牛血清白蛋白(cationic bovine serum albumin,C-BSA)诱导的MN 小鼠动物模型是目前应用较为广泛的模型之一[15]。cBSA 能够通过带正电荷的阳离子与肾小球基膜上的阴离子位点相结合,形成免疫复合物沉积在基膜上,导致肾小球滤过屏障破坏,出现大量蛋白尿[16]。本实验结果显示,参芪蛭龙汤可显著减少MN 小鼠尿蛋白定量数值,提高血清白蛋白水平,降低血脂CHO、TG 水平,表明参芪蛭龙汤对肾小球滤过屏障的破坏具有一定的保护作用。
肾小球滤过屏障是由毛细血管内皮、基底膜和裂隙隔膜构成,而裂隙隔膜蛋白(如Nephrin,Podocin 和Neph1 等)是保证肾小球滤过屏障功能的关键[17,18]。Nephrin 属于免疫球蛋白家族成员之一,是一种跨膜蛋白,由一个短的胞内结构域和连接有8个远端IgG 样基序和一个Ⅲ型连接蛋白样基序的胞外结构域构成,特异性表达于肾小球,对维持肾小球屏障的选择性通透性方面具有重要作用[19,20]。Podocin 是气孔蛋白家族成员之一,其C 端结构域可以与Nephrin 的胞质部分相结合,与CD2AP 相互作用所介导的PI3K/AKT 信号通路的激活,能够抑制足细胞凋亡[21,22]。Neph1 是跨膜蛋白Neph1 家族成员之一,Neph1 和Neph1 通过胞内结构域相互作用,传导由外到内的复杂信号,诱导肌动蛋白在质膜上聚集[23]。Nephrin,Podocin 和Neph1 作为裂孔隔膜的跨膜受体,组成了Nephrin-podocin-Neph1 受体复合物,而编码这些蛋白质的基因突变或丢失时,会导致人类肾病综合征的发生[24,25]。本研究结果显示,与空白对照组比较,参芪蛭龙汤可显著升高MN小鼠Nephrin、Podocin、Neph1 基因表达水平,表明参芪蛭龙汤能够通过调节Nephrin-Podocin-Neph1受体复合物相关基因表达,保护肾小球滤过屏障。
MN 是由于抗原和抗体形成的免疫复合物沉积于肾小球脏层上皮下并激活补体形成膜攻击复合物(C5b-9),导致肾小球上皮细胞(glomerular epithelial cells,GEC)损伤、足细胞功能障碍和肾小球屏障功能的丧失,产生蛋白尿[26]。胞质磷脂酶A2(cPLA2)是一种高度保守的脂质修饰酶,其通过催化SN-2 位置的水解键从甘油磷脂中裂解花生四烯酸,从而增加细胞内Ca2+浓度,是C5b-9 依赖性GEC 损伤的重要介质[27,28]。ERK1/2 的双位点Ser/Thr 被磷酸化后,激活ERK 信号通路,ERK 信号通路能促进细胞质靶蛋白磷酸化,其中cPLA2 是ERK磷酸化的主要靶点之一,因此ERK 信号通路的激活也可导致cPLA2 的激活[29]。ERK1/2 信号通路的激活能够促进TNF-α 等促炎因子的分泌[30]。此外,GEC 损伤能够分泌促炎细胞因子,从而加重炎症反应[31]。本实验结果发现,参芪蛭龙汤组基底膜明显增厚、肾小囊腔增大程度减轻;可显著抑制p-ERK1/2 和p-cPLA2 蛋白的表达;降低血浆中IL-6、IL-4 和TNF-α 含量,表明参芪蛭龙汤通过抑制ERK/cPLA2 途径的激活,减轻GEC 损伤,从而减少促炎细胞因子的分泌。
综上所述,参芪蛭龙汤对MN 小鼠具有较好的治疗作用,作用机制与调节Nephrin-podocin-Neph1受体复合物相关基因表达,保护肾小球滤过屏障,抑制ERK/cPLA2 途径的激活,减轻肾小球上皮细胞损伤,从而减少促炎细胞因子分泌有关。
作者贡献度说明:
实验由薛丕良设计及实验操作,徐梅秀、李星宇负责指标检测,李丽琦和徐梅秀对实验数据进行分析。文章由薛丕良撰写,最终由王顺进行审核。
以上作者对文章无利益冲突。

