过表达circRNA_LARP4对鼻咽癌细胞的肿瘤干细胞样特性和线粒体膜电位的影响*
尹永波, 李学申, 邱金霞, 籍玉青, 崔 静
邢台市人民医院,河北医科大学附属医院 1耳鼻喉科 2放射科,邢台 054000
鼻咽癌是指起源于鼻咽上皮组织,发生于鼻咽腔顶部和侧部的恶性肿瘤。据统计,中国鼻咽癌发病率占全球总鼻咽癌发病率的80%以上,且发病率呈逐年递增的趋势[1-2]。鼻咽癌的发病因素主要有遗传因素、病毒感染及环境因素等,其具体发病的分子机制有待进一步研究[3-4]。目前,临床上针对鼻咽癌的治疗方法主要有手术治疗、放化疗、药物治疗等,但治疗效果不佳,且副作用明显[5-8]。因此,探寻鼻咽癌新的治疗靶点至关重要[9-10]。研究表明,环状RNA(cricRNA)与鼻咽癌发生发展密切相关,circRNA_LARP4(circ_LARP4)是circRNA中的一员,据报道,circ_LARP4在多种肿瘤细胞中发挥着肿瘤抑制因子的作用,其可通过靶向FOXO3A抑制前列腺癌的细胞迁移和侵袭[11],通过调节SMAD7的表达抑制非小细胞肺癌的转移[12],作为miR-1323的海绵分子通过调节PTEN/PI3K/AKT通路抑制食管鳞状细胞癌的发生[13],还可以作为miR-513b-5p的海绵分子调节LARP4的表达进而抑制卵巢癌细胞增殖和迁移[14]。但circ_LARP4在鼻咽癌中的研究鲜见报道,因此,本研究通过细胞转染circ_LARP4,观察过表达circ_LARP4对鼻咽癌CNE2和5-8F细胞增殖、肿瘤干细胞特性和线粒体损伤的影响,从细胞水平上初步探寻鼻咽癌的治疗靶标。
1 材料与方法
1.1 主要实验材料
1.1.1 试剂及仪器 10%胎牛血清、RPMI1640培养液、胰酶、LipofectamineTM3000、pcDNA-circRNA_LARP4均购自美国Invitrogen公司,miR-135b-5p、miR-195-5p及对照miRNA类似物购自上海吉玛基因。Trizol试剂、RIPA裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、RT-PCR试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)试剂盒均购自北京索莱宝科技有限公司,Ki67兔单克隆抗体(ab197547)、p21小鼠单克隆抗体(ab86696)、OCT4兔多克隆抗体(ab19857)、Nanog小鼠单克隆抗体(ab173368)、ABCG2小鼠单克隆抗体(ab130244)、Bax小鼠单克隆抗体(ab3191)、Bcl-2兔多克隆抗体(ab194583)及辣根过氧化物(horseradish peroxidase,HRP)标记的山羊抗小鼠二抗均购自美国Abcam公司。
1.1.2 细胞培养及转染 鼻咽癌CNE1、HONE-1、CNE2和5-8F细胞及正常鼻咽上皮细胞系NP67均由中国科学院上海细胞库提供。用含10%胎牛血清的RPMI 1640培养液,于5% CO2、37℃细胞培养箱中培养,待细胞生长密度达80%且生长状态良好时以胰酶消化传代培养。取生长状态良好的鼻咽癌CNE2和5-8F细胞,接种于6孔板中,并进行分组。①将鼻咽癌CNE2和5-8F细胞分为Control组(空白对照组)、Vector组和circ_LARP4组。培养24 h后根据转染试剂盒说明书用Lipofectamine 3000空载Vector组细胞作阴性对照,circ_LARP4组细胞转染LARP4过表达载体,48 h后进行后续检测。②将鼻咽癌CNE2和5-8F细胞分为Vector组、circ_LARP4组、circ_LARP4+miR-135b-5p组、circ_LARP4+miR-195-5p组。培养24 h后根据转染试剂盒说明书用Lipofectamine 3000空载Vector组细胞作阴性对照,circ_LARP4组细胞转染LARP4过表达载体,circ_LARP4+miR-135b-5p组同时转染LARP4过表达载体和miR-135b-5p mimic,circ_LARP4+miR-195-5p组同时转染LARP4过表达载体和miR-195-5p mimic,转染48 h后通过qRT-PCR检测转染效率,进行后续实验。
1.2 实验方法
1.2.1 qRT-PCR检测circ_LARP4、miR-135b-5p和miR-195-5p的过表达效率 取生长状态良好的鼻咽癌CNE2和5-8F细胞,用Trizol提取试剂盒提取总RNA并测定RNA浓度及纯度,按逆转录试剂盒说明书合成cDNA,按RT-PCR试剂盒说明书配制反应体系,待逆转录反应(16℃ 30 min,37℃ 50 min,70℃ 15 min)完成后放入PCR仪中进行RT-PCR反应,反应条件:95℃、30 s,94℃、10 s,60℃、45 s,共45个循环。以目的基因和内参比值表示RNA相对表达水平,采用2-ΔΔCt法分析结果。引物由上海生工生物工程有限公司合成:circ_LARP4上游引物5′-GGGCAGGCTCCCTTTCCCAAT-3′,下游引物5′-GCATTGGGAAAGGGAGCCTFC-3′;miR-135b-5p上游引物5′-CAGTGCAGGGTCC-GAGGTAT-3′,下游引物5′-CGTCGTATGGCT-TTTTATTCC-3′;miR-195-5p上游引物5′-GCG-TAGCAGCACAGAAATATTGGC-3′,下游引物5′-CTGTCGTCGTAGAGCCAGGGAA-3′;U6上游引物5′-CGAGCACAGAATCGCTTCA-3′,下游引物5′-CTCGCTTCGGCAGCACATAT-3′;GAPDH上游引物5′-GACTCATGACCACAGTCCATGC-3′,下游引物5′-AGAGGCAGGGATGATGTTCTG-3′。
1.2.2 克隆形成实验检测克隆形成率 取各组生长状态良好的鼻咽癌CNE2和5-8F细胞,经胰酶消化处理后,将每组各100个细胞接种至6孔板中,待6孔板出现肉眼可见的细胞克隆时,弃培养液并用PBS清洗3次,用4%多聚甲醛固定细胞10 min,再加入适量的吉姆萨染液染色20~30 min,根据克隆形成数计算克隆形成率,克隆形成率=(克隆数/100)×100%。
1.2.3 成球实验检测成球数和成球直径 取各组对数生长期的鼻咽癌CNE2和5-8F细胞,胰酶消化处理细胞,血细胞计数器计数细胞密度。用RPMI 1640培养液清洗2次,然后用干细胞培养液[2% B27、20 ng/mL碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和20 ng/mL表皮细胞生长因子(epidermal growth factor,EGF)]在6孔板中培养,每孔接种100个细胞,置于5% CO2恒温培养箱中。每隔1 d补加新鲜培养液,倒置显微镜下拍照并记录成球直径和成球率。
1.2.4 流式细胞术检测线粒体膜电位变化 取各组对数生长期的鼻咽癌CNE2和5-8F细胞并制成细胞悬液,用PBS重悬3次,加JC-1染色液于37℃条件下避光孵育30 min,用提前预冷的JC-1染色缓冲液洗涤2~3次,加入1 mL的RPMI 1640培养液,于流式细胞仪上进行检测。正常细胞中JC-1聚集在线粒体中发出红色荧光,凋亡细胞因JC-1以单体形式存在胞质中而发出绿色荧光,计算红/绿荧光比值作为线粒体膜电位水平。
1.2.5 试剂盒检测SOD、MDA含量 收集各组对数生长期的鼻咽癌CNE2和5-8F细胞,严格按照SOD和MDA试剂盒说明书进行操作。
1.2.6 Western blot检测Ki67、P21、OCT4、Nanog、ABCG2、Bax和Bcl-2蛋白水平 收集对数生长期的鼻咽癌CNE2和5-8F细胞,胰酶消化细胞后制成细胞悬液,4℃、3000 r/min条件下离心10 min,取上清。用RIPA蛋白裂解液于冰上提取细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,经SDS-PAGE凝胶电泳、转膜、脱脂奶粉封闭后,加入Ki67兔单克隆抗体(1∶500)、p21小鼠单克隆抗体(1∶500)、OCT4兔多克隆抗体(1∶200)、Nanog小鼠单克隆抗体(1∶200)、ABCG2小鼠单克隆抗体(1∶200)、Bax小鼠单克隆抗体(1∶400)、Bcl-2兔多克隆抗体(1∶1000),4℃孵育摇床过夜。加入按比例稀释HRP标记的对应二抗(1∶4000),室温避光孵育2 h。采用ECL化学发光法于暗室下曝光显影,将胶片进行扫描存档,Photoshop整理去色,Alpha软件分析条带吸光度值。
1.3 生物信息学分析及验证
在Starbase 2.0数据库中选择miRNA-circRNA,输入LARP4,得到所有可能与circ_LARP4产生互作的miRNA。以名称排序,将不重复的RNA名输入dbDEMC2数据库的Meta-profiling Heatmap模块,选择鼻咽癌,并分别选择癌组织与正常、转移与未转移、早期和晚期的对比,产生热图,整合。得到不同状况下circ_LARP4的差异表达靶miRNA。
1.4 统计学方法
2 结果
2.1 circ_LARP4过表达效率
检测不同鼻咽癌细胞系CNE1、CNE2、HONE-1、5-8F和正常人鼻咽上皮细胞系NP67中circ_LARP4表达水平。与NP67细胞比较,CNE2、HONE-1细胞中circ_LARP4表达水平显著降低(P<0.05),CNE1、5-8F细胞中circ_LARP4表达水平亦显著降低(P<0.01)。转染后,与Control组比较,Vector组鼻咽癌CNE2和5-8F细胞中circ_LARP4表达水平无明显差异(P>0.05),circ_LARP4组CNE2和5-8F细胞中circ_LARP4表达水平均显著上调(P<0.05),见图1。结果提示,circ_LARP4过表达载体构建成功。
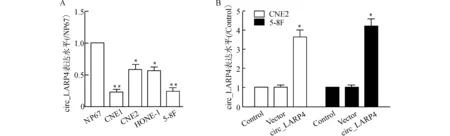
A:qRT-PCR检测不同鼻咽癌细胞系CNE1、CNE2、HONE-1、5-8F和正常人鼻咽上皮细胞系NP67中circ_LARP4表达水平,与NP67细胞比较,*P<0.05 **P<0.01;B:qRT-PCR检测过表达circ_LARP4后CNE2和5-8F细胞中circ_LARP4表达水平,与Control组比较,*P<0.05图1 qRT-PCR检测circ_LARP4表达水平Fig.1 Expression level of circ_LARP4 detected by qRT-PCR
2.2 过表达circ_LARP4对鼻咽癌CNE2和5-8F细胞增殖的影响
克隆形成实验检测鼻咽癌CNE2和5-8F细胞克隆形成率,与Control组比较,Vector组CNE2和5-8F细胞克隆形成率无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞克隆形成率均显著降低(均P<0.05),见图2A。Western blot检测Ki67和p21蛋白水平,与Control组比较,Vector组CNE2和5-8F细胞Ki67和p21蛋白水平均无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞中Ki67蛋白水平显著降低,p21蛋白水平显著增高(均P<0.05),见图2B。
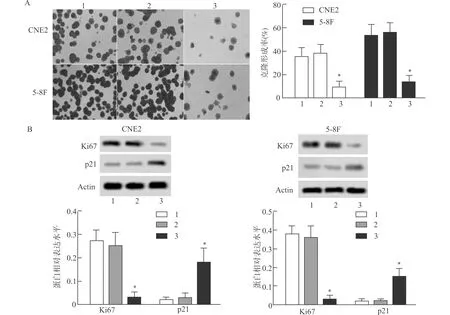
1:Control组;2:Vector组;3:circ_LARP4组;A:克隆形成实验检测克隆形成率;B:Western blot检测Ki67和p21蛋白水平;与Control组比较,*P<0.05图2 鼻咽癌CNE2和5-8F细胞增殖能力检测Fig.2 Proliferation of nasopharyngeal carcinoma CNE2 and 5-8F cells
2.3 过表达circ_LARP4对鼻咽癌CNE2和5-8F肿瘤干细胞特性的影响
显微镜观察并测量肿瘤干细胞成球数和成球直径,与Control组比较,Vector组CNE2和5-8F干细胞成球率及成球直径均无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F干细胞成球率及成球直径显著减小(均P<0.05),见图3A、3B和3C。Western blot检测干细胞标记物OCT4、Nanog和ABCG2蛋白水平,与Control组比较,Vector组鼻咽癌CNE2和5-8F细胞OCT4、Nanog和ABCG2蛋白水平均无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞OCT4、Nanog和ABCG2蛋白水平均显著降低(均P<0.05),见图3D、3E和3F。

1:Control组;2:Vector组;3:circ_LARP4组;A:成球实验;B:细胞成球率;C:细胞成球直径;D:蛋白条带图;E:鼻咽癌CNE2细胞OCT4、Nanog和ABCG2蛋白水平;F:鼻咽癌5-8F细胞OCT4、Nanog和ABCG2蛋白水平;与Control组比较,*P<0.05图3 鼻咽癌CNE2和5-8F干细胞样特性检测Fig.3 Detection of stem cell-like characteristics of nasopharyngeal carcinoma CNE2 and 5-8F cells
2.4 过表达circ_LARP4对鼻咽癌CNE2和5-8F细胞线粒体膜电位的影响
流式细胞术检测鼻咽癌CNE2和5-8F细胞的线粒体膜电位变化,Control组CNE2和5-8F细胞线粒体中可见大量红色荧光,仅见极少数绿色荧光。Vector组与Control组无明显差异,circ_LARP4组CNE2和5-8F细胞线粒体中绿色荧光明显增多。与Control组比较,Vector组CNE2和5-8F细胞JC-1红/绿荧光比(%)无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞JC-1红/绿荧光比(%)显著降低(均P<0.05),见图4。

1:Control组;2:Vector组;3:circ_LARP4组;与Control组比较,*P<0.05图4 鼻咽癌CNE2和5-8F细胞线粒体膜电位变化Fig.4 Changes of mitochondrial membrane potential in nasopharyngeal carcinoma CNE2 and 5-8F cells
2.5 过表达circ_LARP4对鼻咽癌CNE2和5-8F细胞线粒体凋亡蛋白水平及氧化应激指标的影响
Western blot检测鼻咽癌CNE2和5-8F细胞线粒体损伤标记物Bax、Bcl-2蛋白水平,与Control组比较,Vector组CNE2和5-8F细胞线粒体Bax/Bcl-2均无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞线粒体Bax/Bcl-2均显著升高(均P<0.05),见图5A。试剂盒检测鼻咽癌CNE2和5-8F细胞中SOD及MDA含量,与Control组比较,Vector组CNE2和5-8F细胞中SOD和MDA含量均无明显差异(均P>0.05),circ_LARP4组CNE2和5-8F细胞中SOD含量均显著降低(均P<0.05),MDA含量均显著增高(均P<0.05),见图5B、5C。

1:Control组;2:Vector组;3:circ_LARP4组;A:Bax、Bcl-2蛋白水平;B:SOD含量;C:MDA含量;与Control组比较,*P<0.05图5 鼻咽癌CNE2和5-8F细胞线粒体损伤标记物检测Fig.5 Detection of mitochondrial damage markers in nasopharyngeal carcinoma CNE2 and 5-8F cells
2.6 circ_LARP4靶向miRNA的筛选
Starbase与dbDEMC2的分析表明,对于鼻咽癌而言,circ_LARP4相关miRNA变化中,miR-135b-5p和miR-195-5p在癌组织与癌旁组织、转移瘤与原位瘤的比较中均显示出上调,见图6。

图6 鼻咽癌circ_LARP4相关miRNA Starbase与dbDEMC2分析预测的热图Fig.6 Heat map predicted by Starbase and dbDEMC2 of circ_LARP4-related miRNA in nasopharyngeal carcinoma
2.7 circ_LARP4靶miRNA的验证
在CNE2细胞中验证了miR-135b-5p与miR-195-5p对circ_LARP4的影响。如图7所示,与Control组比较,Vector组miR-135b-5p、miR-195-5p表达均无明显差异(均P>0.05),circ_LARP4组miR-135b-5p、miR-195-5p表达均显著上调(均P<0.05),见图7A。miR-135b-5p或miR-195-5p与circ_LAPR4共转染组逆转了circ_LAPR4过表达所致的细胞增殖和肿瘤干细胞特性,增加了凋亡细胞数(均P<0.05)(图7B~7F)。

1:Vector组;2:circ_LARP4组;3:circ_LARP4+miR-135b-5p组;4:circ_LARP4+miR-195-5p组;A:circ_LAPR4过表达模型中miR-135b-5p和miR-195-5p的表达水平;B:CNE2细胞中miRNA转染验证;C:Western blot检测蛋白表达;D:增殖相关蛋白表达;E:肿瘤干细胞特性相关蛋白表达;F:凋亡相关蛋白表达;与Control组比较,△P<0.05;与Vector组比较,*P<0.05;与circ_LARP4组比较,#P<0.05图7 鼻咽癌circ_LARP4相关miRNAFig.7 circ_LARP4-related miRNA in nasopharyngeal carcinoma
3 讨论
鼻咽癌发生发展依赖于癌细胞增殖、侵袭和转移等过程。研究发现,鼻咽癌发生过程中,circRNA通过其特殊的环状结构在鼻咽癌细胞增殖、侵袭和转移等过程中发挥调控作用。如circRNA SETD3通过miR-615-5p和miR-1538调节MAPRE1表达促进鼻咽癌细胞迁移和侵袭[15];circRNA-ITCH在鼻咽癌组织及细胞系中低表达,过表达circRNA-ITCH可明显抑制鼻咽癌CNE-2Z细胞的增殖和侵袭能力[16];circRNA-ARHGAP12通过调节ezrin蛋白介导的细胞骨架重塑促进鼻咽癌细胞的迁移和侵袭[17]等。Lin等[14]发现circ_LARP4过表达可通过调节miR-513b-5p/LARP4轴来抑制卵巢癌细胞的增殖和迁移。因此,本研究利用细胞转染技术,观察circ_LARP4过表达对鼻咽癌细胞增殖、肿瘤干细胞样特性及线粒体损伤的影响。结果发现,circ_LARP4过表达显著抑制了鼻咽癌CNE2和5-8F细胞增殖、肿瘤干细胞干性并促进线粒体损伤。数据库分析初步筛选出circ_LARP4的2种靶miRNA,miR-135b-5p和miR-195-5p,并在CNE2细胞中验证了其对circ_LARP4的拮抗作用。这些结果提示,circ_LARP4可作为鼻咽癌的新型潜在治疗靶点。
Ki67和p21是细胞增殖蛋白相关抗原,与细胞增殖密切相关。研究发现,Ki67在鼻咽癌细胞中高表达与鼻咽癌预后有关,p21是位于p53下游的细胞周期素依赖性激酶抑制因子,能够抑制癌细胞增殖、分化和转移[18]。本研究结果显示,过表达circ_LARP4显著抑制鼻咽癌CNE2和5-8F细胞克隆形成率及Ki67和p21蛋白水平。
肿瘤干细胞是指具有自我更新能力并产生异质性肿瘤细胞的细胞,肿瘤干细胞与肿瘤的发生发展、转移及抗药性有关。OCT4、Nanog和ABCG2是肿瘤干细胞标记物,是促进肿瘤细胞干性功能的主要基因。OCT4是POU转录因子家族中的一员,是最早发现的维持干细胞自我更新、分化和多潜能性的重要细胞因子。Nanog是维持肿瘤干细胞全能性的关键基因,研究发现,Nanog在鼻咽癌组织中高表达与患者不良预后、肿瘤增殖、肿瘤形成及治疗抵抗等一系列恶性疾病有关[19]。ABCG2是近年发现的多药耐药蛋白及肿瘤干细胞亚群侧群的分选标志,有报道指出,ABCG2在鼻咽癌细胞中高表达与鼻咽癌细胞增殖、分化及肿瘤干细胞样特性呈正相关性[20]。本实验结果显示,过表达circ_LARP4明显抑制鼻咽癌CNE2和5-8F细胞中肿瘤干细胞标记物OCT4、Nanog和ABNG2蛋白表达,同时降低肿瘤干细胞成球率。结果提示,过表达circ_LARP4通过下调肿瘤干细胞标记蛋白水平抑制鼻咽癌肿瘤干细胞样特性。
线粒体是细胞能量供应及代谢的主要场所,参与调节细胞能量转换、细胞凋亡及氧化应激等过程,与维持细胞正常功能密切相关。线粒体在产生能量时会将电化学势能储存于线粒体内膜,若线粒体膜两侧的质子及其它离子浓度分布不均匀就会形成膜电位,线粒体膜电位的稳定对维持细胞正常生理功能具有重要作用。Guo等[21]发现,鼻咽癌细胞线粒体膜电位能够抑制细胞增殖,并促进细胞凋亡和自噬。本研究结果显示,细胞转染过表达circ_LARP4后,鼻咽癌CNE2和5-8F细胞线粒体膜电位明显增高,后续我们又检测线粒体损伤标记物Bax、Bcl-2蛋白水平及SOD和MDA含量,结果显示,过表达circ_LARP4组细胞线粒体中Bax/Bcl-2显著增高,SOD含量降低,MDA含量升高。结果进一步提示,过表达circ_LARP4能够降低鼻咽癌细胞线粒体膜电位,加速细胞线粒体损伤。
大量的研究发现circRNA可作为miRNA的“分子海绵”,调控下游靶基因的表达,间接调控鼻咽癌的发生发展[22]。目前关于circ_LARP4在鼻咽癌中作用的研究还比较有限,本研究通过Starbase分析,得出一系列可能的circ_LARP4靶miRNA,在dbDEMC2数据库中分析发现,miR-135b-5p和miR-195-5p是其在鼻咽癌中潜在的靶标,并在CNE2细胞中简单验证了miR-135b-5p和miR-195-5p对circ_LARP4作用的影响。当然,局限于数据库不够成熟以及验证不够深入,这2种miRNA与circ_LARP4在鼻咽癌中的具体相互作用还有待研究。
综上所述,过表达circ_LARP4抑制鼻咽癌细胞增殖、肿瘤干细胞样特性,并促进细胞线粒体损伤,可能抑制鼻咽癌发生发展过程。

