肿瘤干细胞标志物DCLK1通过AKT信号通路促进鼻咽癌细胞的生长与转移*
刘 伟, 代伟林, 王英杰, 黄 晶
1华中科技大学同济医学院附属武汉中西医结合医院耳鼻咽喉头颈外科,武汉 430022 2 华中科技大学同济医学院附属协和医院肿瘤中心,武汉 430023
鼻咽癌(nasopharyngeal carcinoma,NPC)是最常见的头颈部肿瘤,起源于鼻咽上皮细胞[1-2]。虽然NPC在世界其他地区相对少见,但在中国南部和东南亚某些地区尤为流行,最高年发病率为30/10万[3-4]。由于鼻咽癌特殊的解剖位置,放射治疗仍然是主要的治疗方法。尽管随着现代放射治疗技术和诊断成像技术的进步,临床结局有了显著改善,但仍有20%和30%的鼻咽癌患者发生局部复发和远处转移[5]。由于复发和转移,鼻咽癌患者的5年生存率仍然很低,尤其是晚期患者[6]。因此,有必要寻找新的、有效的鼻咽癌治疗方法,以进一步改善鼻咽癌患者的预后。
DCLK1是一种微管相关蛋白激酶,是胰腺和肠道干细胞标记物。DCLK1在许多癌症中过度表达,如结肠癌、胰腺癌、肾癌、肝癌和食管癌[7]。越来越多研究证据表明,DCLK1在控制肿瘤干细胞、肿瘤转移、上皮间质转化(EMT)和癌细胞生长、自我更新的过程中起着关键作用[8-10]。Chandrakesan等[11]的研究表明,通过旁分泌机制和丝氨酸-苏氨酸蛋白激酶(ATM)介导的DNA损伤反应(DDR)的激活,DCLK1在簇状细胞中的表达促进了肠上皮放射性抵抗和自我更新及存活。此外,Ji等[7]发现,以DCLK1为靶点的miR-15b不仅抑制结直肠癌的自我更新和致瘤性,而且提高癌细胞对化疗/放疗的敏感性。最近,有研究表明,Niclosamide(一种FDA批准的驱虫药)可阻止淋巴增强子结合因子1(LEF1)介导的DCLK1转录,从而降低肿瘤干细胞特性,并使结直肠癌对放化疗敏感[12-13]。综上所述,DCLK1在肿瘤干性、肿瘤复发与转移、放化疗敏感性中扮演着非常重要的角色。然而,DCLK1在鼻咽癌中的表达及其生物学功能尚不明确。
本研究通过体内外实验探究DCLK1调控鼻咽癌生长与转移的生物学功能,以期为鼻咽癌寻找潜在的治疗靶点。
1 材料与方法
1.1 细胞与试剂
人鼻咽癌细胞系购自中国科学院细胞库(中国上海)。鼻咽癌细胞系在RPMI-1640培养液中培养,该培养液中添加10%胎牛血清和100 U/mL青霉素和链霉素,并在37℃、含5%CO2的湿空气中培养。鼻咽正常上皮细胞系NP69在角质形成细胞无血清培养液中培养(购于美国Invitrogen公司)。LipofectamineTM2000购于美国Invitrogen公司。抗DCLK1抗体购于美国Sigma公司。RPMI-1640、胎牛血清购于美国Gibco公司。AKT抑制剂(AKT-IN-1)购于美国MCS公司。DCLK1敲低shRNA质粒和过表达质粒购于中国上海吉凯公司。
1.2 实验方法
1.2.1 蛋白质印迹法 提取处理后细胞的蛋白质,测定蛋白质浓度,处理样品蛋白质和热变性。SDS-PAGE凝胶电泳,转移膜,包封,然后加入兔抗人RPA1一级抗体,孵育4℃过夜,TBST洗涤3次,5 min/次,加入二级抗体孵育2 h,TBST洗涤3次,5 min/次。使用NBT/BCIP显色。
1.2.2 免疫组织化学检测 脱蜡后组织切片抗原修复,水合(1 mmol/L草酸四乙胺,pH8.0),阻断非特异性蛋白1 h,RPA1抗体孵育30 min,加生物素标记的山羊抗鼠IgG和HRP工作液标记的亲和素酶,二氨基联苯胺(DAB)显色,脱水,透明,贴装。用0.01 mol/L PBS(pH7.5)代替RPA1抗体作为阴性对照,阳性切片作为阳性对照。RPA1的阳性结果为细胞核内的棕黄色颗粒。
1.2.3 克隆形成实验 单细胞悬液接种于6孔板(1000个/孔)中,24 h后,给予不同剂量的辐射(0、1、2、4、6 Gy),每个剂量设3孔。辐射后,继续在培养箱中培养10~14 d。用4%多聚甲醛固定细胞,结晶紫染色。显微镜下计数≥50个细胞的克隆,绘制生长曲线。
1.2.4 细胞增殖实验 单细胞悬浮液接种于24孔板(5000个/孔),设置5个复孔,培养时间适当。加入MTT溶液20 μL/孔(5 g/L MTT溶液),继续培养4 h,吸取培养液并加入DMSO 150 μL,振荡10 min,酶标仪读取470 nm处的吸光度值。
1.2.5 构建皮下移植瘤模型 将shControl和shDCLK1质粒转染鼻咽癌细胞CNE1,构建DCLK1敲低的稳定细胞株和对照细胞株。shDCLK1-#1、shDCLK1-#2是敲低DCLK1的2条shRNA,以鉴别假阳性。将上述鼻咽癌细胞接种于裸鼠皮下,构建小鼠原位移植瘤模型,观察裸鼠皮下移植瘤生长情况。
1.2.6 构建尾静脉转移瘤模型 将shControl和shDCLK1质粒转染鼻咽癌细胞CNE1,构建DCLK1敲低的稳定细胞株和对照细胞株。将上述鼻咽癌细胞通过尾静脉注射至裸鼠体内,构建小鼠尾静脉转移瘤模型,观察裸鼠肺转移瘤形成情况。
1.3 统计学方法
2 结果
2.1 DCLK1在鼻咽癌细胞和组织中异常高表达
如图1A、1B所示,与正常鼻咽上皮细胞NP69相比,DCLK1在鼻咽癌细胞株(CNE1、CNE2、5-8F)表达明显升高。本研究还检测了DCLK1在鼻咽癌和非鼻咽癌组织中的表达(n=20),与非鼻咽癌组织相比,在鼻咽癌组织DCLK1免疫组织化学染色中褐黄色颗粒增多。该结果表明,鼻咽癌DCLK1的表达显著高于非鼻咽癌组织(图1C、1D)(均P<0.05)。
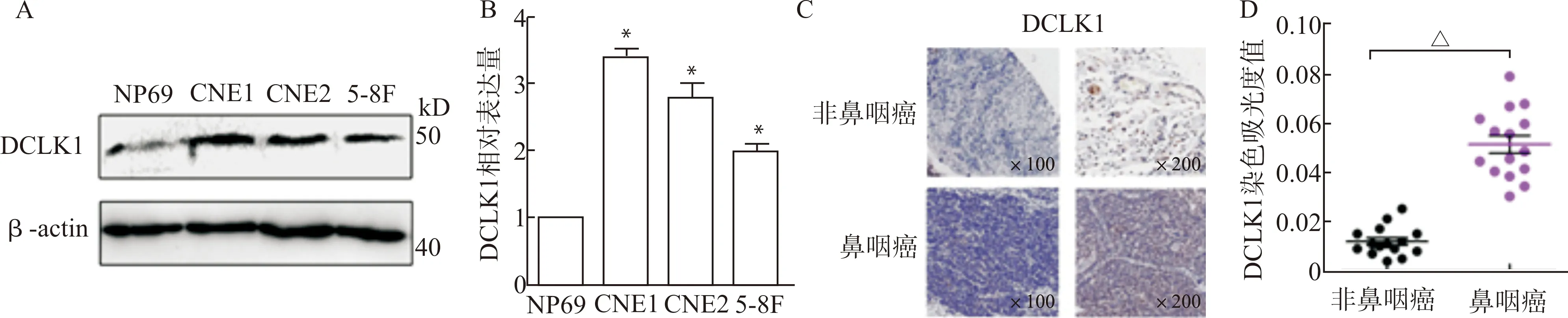
A:Western blot检测DCLK1在鼻咽癌细胞株中(CNE1、CNE2、5-8F)的表达;B:定量分析Western blot检测结果,与NP69比较,*P<0.05;C:免疫组化检测DCLK1在鼻咽癌组织中的表达;D:定量分析免疫组化检测结果(n=20),△P<0.05图1 DCLK1在鼻咽癌细胞和组织中异常高表达Fig.1 DCLK1 expression is extremely high in nasopharyngeal carcinoma cells and tissues
2.2 敲低DCLK1表达抑制鼻咽癌CNE1细胞的生长
首先,我们构建了DCLK1 shRNA质粒(shDCLK1),并验证了其对DCLK1的敲低效率(图2A)。细胞计数实验显示,与对照组(shControl组)相比,shDCLK1组的细胞数目明显减少(图2B)。该结果表明,敲低DCLK1表达可抑制鼻咽癌细胞的增殖能力。平板克隆实验显示,与对照组(shControl组)相比,shDCLK1组的细胞平板克隆数目明显减少(图2C、2D)。该结果表明,敲低DCLK1表达可抑制鼻咽癌细胞的平板克隆形成能力。而且,本研究构建了裸鼠皮下移植瘤模型,进行动物体内实验验证(图3A)。与对照组(shControl组)裸鼠皮下瘤相比,shDCLK1组裸鼠皮下瘤的体积明显较小(图3B)。

1:shControl;2:shDCLK1-#1;3:shDCLK1-#2;A:Western blot检测shRNA敲低DCLK1表达的效果;B:细胞计数实验检测敲低DCLK1表达对鼻咽癌细胞增殖能力的影响;C:平板克隆实验检测敲低DCLK1表达对鼻咽癌细胞平板克隆形成能力的影响;D:定量分析平板克隆形成实验结果;与shControl组比较,**P<0.01图2 敲低DCLK1表达可抑制鼻咽癌细胞的增殖能力Fig.2 Knockdown of DCLK1 expression inhibits the proliferation of nasopharyngeal carcinoma cells
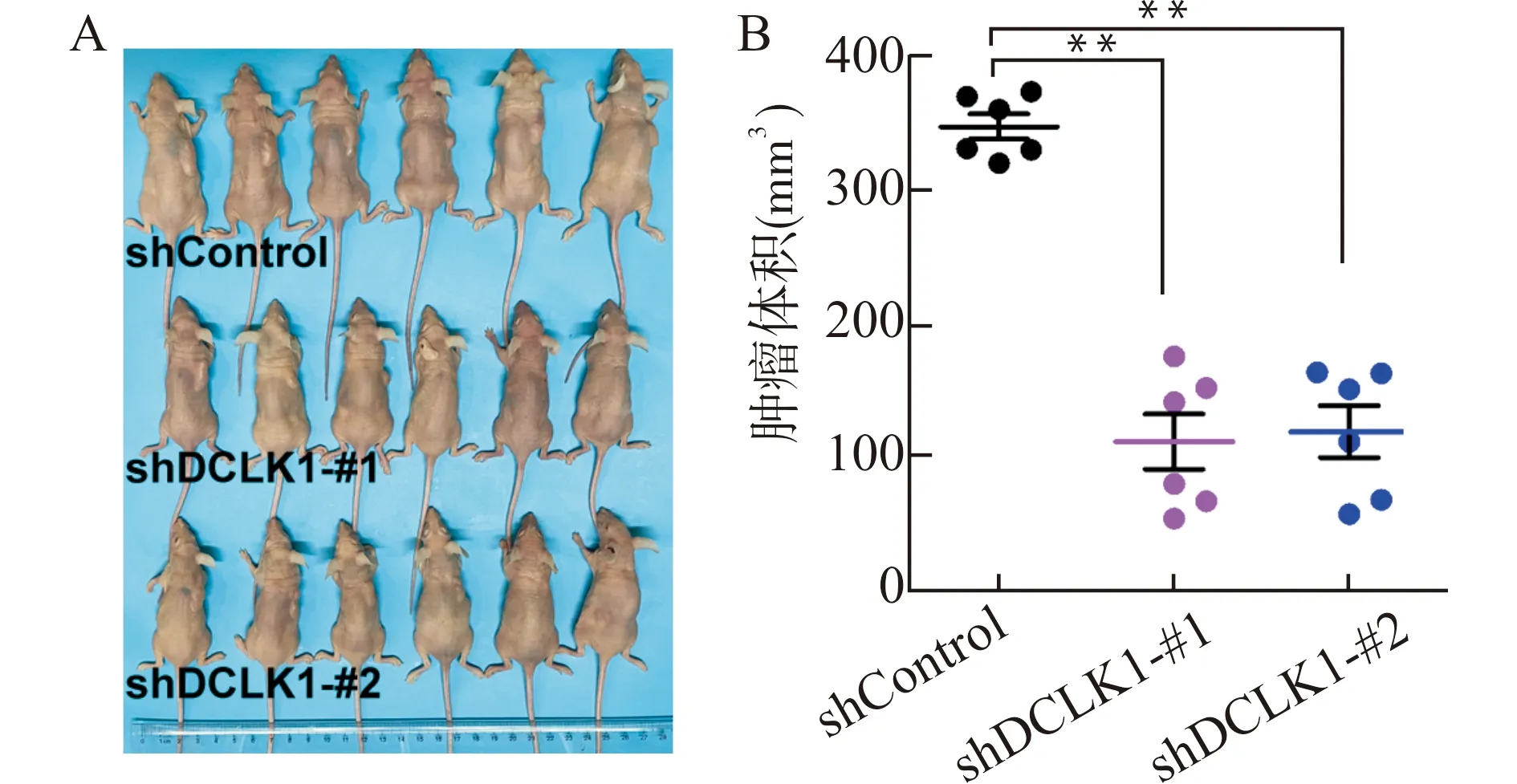
A:构建裸鼠鼻咽癌皮下移植瘤模型;B:观察记录各实验分组中裸鼠皮下瘤体积(n=6),**P<0.01图3 敲低DCLK1表达抑制裸鼠鼻咽癌皮下移植瘤的生长Fig.3 Knockdown DCLK1 expression inhibits subcutaneous tumor growth in nude mice with nasopharyngeal carcinoma
该结果表明,敲低DCLK1表达可抑制裸鼠鼻咽癌皮下移植瘤的生长。
2.3 敲低DCLK1表达抑制鼻咽癌CNE1细胞转移
DCLK1在鼻咽癌中高表达并调控鼻咽癌细胞的生长,本研究进一步检测了其对鼻咽癌细胞转移的影响。Transwell迁移实验显示,与对照组(shControl组)相比,shDCLK1组的细胞迁移数目明显减少(图4A)。该结果表明,敲低DCLK1表达可抑制鼻咽癌细胞的迁移能力。而且,本研究构建了裸鼠尾静脉注射转移瘤模型,进行动物体内实验验证。与对照组(shControl组)相比,shDCLK1组裸鼠肺转移瘤数目明显减少(图4B)。该结果表明,敲低DCLK1表达可抑制鼻咽癌裸鼠肺转移瘤形成。

1:shControl;2:shDCLK1-#1;3:shDCLK1-#2;A:Transwell实验检测敲低DCLK1表达对鼻咽癌细胞迁移能力的影响(5个视野,×100);B:构建裸鼠尾静脉转移瘤模型,观察裸鼠肺转移瘤形成情况,箭头所示为裸鼠肺转移瘤图4 敲低DCLK1表达抑制鼻咽癌CNE1细胞转移Fig.4 Knockdown of DCLK1 expression inhibits the metastasis of nasopharyngeal carcinoma CNE1 cells
2.4 DCLK1通过AKT信号通路促进鼻咽癌CNE1细胞的生长与转移
与对照组(shControl组)相比,shDCLK1组的p-AKT表达降低(图5A),表明敲低DCLK1可抑制AKT信号通路。为了进一步证明DCLK1是否通过AKT信号通路发挥促肿瘤发展的功能,本研究应用AKT抑制剂(AKT-IN-1)抑制AKT信号通路。细胞计数显示,与过表达对照组(Vector组)相比,DCLK1过表达组的细胞生长能力明显增强,而DCLK1+AKT-IN-1组的细胞生长能力显著减弱(图5B)。这表明DCLK1可促进鼻咽癌细胞的增殖,而DCLK1促肿瘤生长的生物学功能可被AKT抑制剂(AKT-IN-1)阻断。平板克隆实验显示,与Vector组相比,DCLK1过表达组的细胞平板克隆数目显著增加,而DCLK1+AKT-IN-1组的细胞平板克隆数目显著减少(图5C)。这表明DCLK1可促进鼻咽癌细胞的平板克隆形成,而DCLK1促肿瘤细胞平板克隆形成的生物学功能可被AKT抑制剂(AKT-IN-1)阻断。此外,Transwell迁移实验显示,与Vector组相比,DCLK1过表达组的细胞迁移数目明显增加,而DCLK1+AKT-IN-1组的细胞迁移数目显著减少(图5D)。这表明DCLK1可促进鼻咽癌细胞的迁移,而DCLK1促肿瘤转移的生物学功能可被AKT抑制剂(AKT-IN-1)阻断。上述研究结果表明,DCLK1通过AKT信号通路促进鼻咽癌CNE1细胞的生长与转移。

1:Vector;2:DCLK1;3:DCLK1+AKT-IN-1;A:Western blot检测shRNA敲低DCLK1表达对AKT、p-AKT蛋白表达的影响;B:细胞计数实验检测上调DCLK1表达及应用AKT抑制剂(AKT-IN-1)对鼻咽癌细胞增殖能力的影响,与Vector组比较,**P<0.01;C:平板克隆实验检测上调DCLK1表达及应用AKT抑制剂(AKT-IN-1)对鼻咽癌细胞平板克隆形成能力的影响;D:Transwell实验检测上调DCLK1表达及应用AKT抑制剂(AKT-IN-1)对鼻咽癌细胞迁移能力的影响图5 DCLK1通过AKT信号通路促进鼻咽癌CNE1细胞的生长与转移Fig.5 DCLK1 promotes the growth and metastasis of nasopharyngeal carcinoma CNE1 cells through AKT signaling pathway
3 讨论
据报道,有多种因素,如EB病毒感染、环境因素和遗传易感基因,都与鼻咽癌的发生有关[14]。由于鼻咽癌患者死亡的两个主要原因是复发和转移,因此进一步阐明鼻咽癌发生发展的分子机制至关重要。本研究表明,肿瘤干细胞标记物DCLK1在鼻咽癌组织和细胞中表达上调,并通过AKT信号通路促进鼻咽癌细胞的恶性生物学行为。
DCLK1是一个关键的调节因子,通过microRNA依赖性机制(即下调几种关键的肿瘤抑制因子microRNA)参与促进EMT、肿瘤转移等。例如,miR-613通过下调DCLK1从而抑制人肝细胞癌的生长和侵袭[15],而miR-137通过下调DCLK1进而抑制结肠癌的恶性生物学特征[16]。miR-424还通过直接调节DCLK1抑制神经母细胞瘤细胞的存活和侵袭[17]。此外,DCLK1的高表达已被证明可促进人胰腺癌的发生发展[18]。尤其重要的是,MicroRNA-223-5p通过靶向DCLK1抑制鼻咽癌的进展[19]。以上研究表明,DCLK1的异常高表达与肿瘤的恶性生物学行为密切相关。在本研究中,DCLK1在鼻咽癌细胞株和临床鼻咽癌组织标本中均高表达。体外实验表明,敲低DCLK1表达可抑制鼻咽癌CNE1细胞的增殖和克隆形成,以及降低CNE1细胞的迁移。动物体内实验表明,敲低DCLK1表达可抑制鼻咽癌CNE1细胞在裸鼠皮下移植瘤中生长,以及减少鼻咽癌CNE1细胞在裸鼠尾静脉转移模型中肺转移的形成。
据报道,DCLK1通过多种信号通路参与人类癌症的发生进展。例如,Wang等[20]报道DCLK1通过Wnt/β-连环蛋白信号通路促进乳腺癌的进展。Liu等[21]指出,lncRNA SNHG1通过DCLK1介导的Notch1途径促进胃癌细胞的上皮-间质转化。Zhang等[22]研究报道,DCLK1基因敲除可能通过抑制β-catenin/c-Myc途径调节食管鳞状细胞癌的增殖、迁移、侵袭和化疗敏感性,从而抑制食管鳞状细胞癌的进展。尤其重要的是,Liu等[23]研究报道DCLK1通过PI3K/Akt/Sp1轴诱导NF-κB p65亚单位表达,并通过PI3K/Akt/IκBα途径激活NF-κB p65,进而促进结直肠癌上皮-间质转化。本研究结果同样表明,在鼻咽癌CNE1细胞中DCLK1上调AKT信号通路,而且AKT抑制剂可抑制DCLK1诱导的癌细胞增殖及转移。
综上所述,本研究发现DCLK1在鼻咽癌中高表达,体内外实验表明DCLK1促进癌细胞的生长与转移。进一步分子机制研究表明,DCLK1通过AKT信号通路促进鼻咽癌细胞的生长与转移。因此,本研究表明DCLK1具有调控鼻咽癌生长与转移的生物学功能,有可能成为鼻咽癌潜在的治疗靶点。

