TRPC6通过GSK-3β/β-catenin通路调控EMT减轻TGF-β1诱导的肾小管上皮细胞损伤*
张彦红, 韩永明, 陈泽斌, 廖燕宏
1湖北中医药大学基础医学院解剖学教研室,武汉 430065 华中科技大学同济医学院基础医学院 2解剖学系,3神经系统疾病教育部重点实验室,武汉 430030
我国慢性肾脏病(chronic kidney disease,CKD)流行病学调查结果发现,中国成人CKD患病率约为10.8%,据此推算每10个成年人就有1人患病。而肾纤维化是引起各种CKD的共同病理特征[1]。近年来大量的文献证实,肾小管上皮细胞(tubular epithelial cell,TEC)通过上皮间质转化(epithelial-mesenchymal transition,EMT),可从不同方面促进肾纤维化的发生发展[2-3]。瞬时受体电位通道(transient receptor potential channels,TRPCs)是一种非选择性阳离子通道,包含7个成员,其中TRPC6参与多种肾病的发生发展[4-5]。有研究发现抑制TRPC6活性或者敲除TRPC6基因具有一定的抗纤维化作用[6],从而对肾脏具有一定的保护作用,但其中涉及的分子机制还不是十分清楚。本实验以TRPC6基因敲除型(TRPC6 knockout,TRPC6-/-)和野生型(wild type,WT)小鼠为实验对象,分离培养原代TEC,从细胞水平研究TRPC6通过调控EMT减轻肾纤维化损伤的分子机制。
1 材料与方法
1.1 动物与试剂
本实验以SPF级成年雄性TRPC6-/-和WT小鼠为实验对象。其中WT小鼠为构建TRPC6-/-小鼠的背景小鼠129 SvEv,购买于北京维通利华实验动物技术有限公司,TRPC6-/-小鼠由美国NIH/NIEHS Lutz Birnbaumer实验室提供。EMT分子标记和通路相关抗体购买于CST公司。
1.2 分离培养TEC与实验分组
在前期实验的基础上,分离培养原代TEC,具体步骤如下:①取体质量20~25 g的雄性成年小鼠1~2只,无菌室颈椎脱臼,75%乙醇浸泡消毒,获取肾脏,剥去被膜,放置冰上;②分离肾皮质和浅髓部分,切成1~3 mm3大小的组织块,随后转移至新的50 mL离心管中;③离心管中加入2.5~3.0 mL含有0.1% Ⅱ型胶原酶的消化液于37℃恒温水浴锅中振荡消化10~15 min,吸取上清,随后加入等体积预冷的含10%血清培养液终止消化;④重复上述步骤3次左右,集合所有消化液,分别使用80目和200目细胞筛双重过滤,获得肾小管节段;⑤用含有10% FBS的DMEM-F12培养液重悬肾小管节段并转移至培养皿中,放入37℃ 5% CO2细胞孵育箱中静置培养。第3天,细胞从肾小管节段周围长出,换液,第4~5天TEC可铺满整个培养皿。分离培养的原代TEC,经TGF-β1诱导处理后,进行后续实验。实验分为4组:WT对照组、WT TGF-β1组、TRPC6-/-对照组、TRPC6-/-TGF-β1组。
1.3 培养的TEC进行TGF-β1诱导处理
TEC在培养3 d时,加入5 ng/mL的TGF-β1进行诱导处理72 h,对照组加入同等体积的无菌柠檬酸盐(pH=3.0),倒置显微镜下观察细胞的生长情况并采集图像。
1.4 免疫荧光染色技术观察细胞内β-catenin的表达水平
TEC从细胞孵育箱拿出,弃掉培养液后加入4%的多聚甲醛室温固定15 min;以1%的Triton X-100/PBS室温破膜10 min;1∶100的一抗/PBS稀释液37℃孵育1.5 h;1∶150的荧光二抗/PBS稀释液室温避光孵育2 h;DAPI染核;抗猝灭封片剂封片;共聚焦显微镜下观察β-catenin的表达水平。
1.5 采用Western blot技术检测TEC中TRPC6及肾纤维化相关蛋白的表达水平
细胞总蛋白提取:收集各组TEC,用超声仪将细胞裂解,离心后取上清。
以10%或12%的PAGE胶电泳,PVDF膜进行转膜75 min,5%脱脂牛奶封闭30 min;摇床上4℃过夜孵育一抗,室温孵育二抗1.0~1.5 h,新鲜配置的ECL显影液均匀平铺在膜上,观察并采集图像。利用Western blot检测TEC中TRPC6、EMT分子标记物(E-cad,Cadh16,α-SMA)和GSK-3β/β-catenin通路相关蛋白的表达。
1.6 统计学方法
2 结果
2.1 原代TEC的分离培养
小鼠颈椎脱臼处死,经过75%乙醇消毒,在无菌条件下获取新鲜肾脏,取得皮质和浅层髓质的肾小管节段。
细胞培养箱内培养3 d后,TEC从肾小管节段周缘慢慢爬出,细胞不断地增殖,数量逐渐增多,最终可平铺整个培养皿。正常条件下,培养的TEC呈鹅卵石状或者不规则的多边形(图1)。
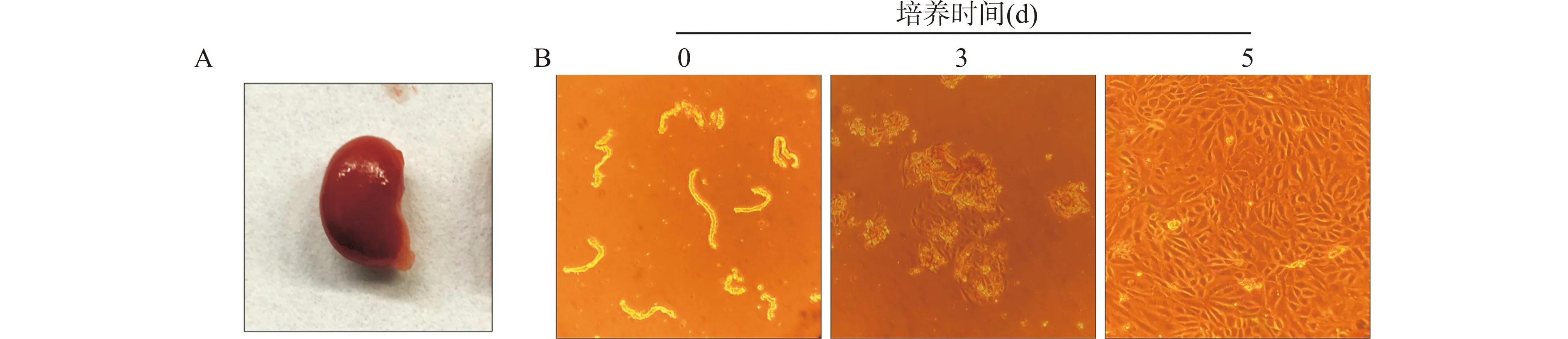
A:新鲜分离的小鼠肾脏;B:分离的原代TEC随培养时间延长的形态变化,培养3 d后,少量细胞从肾小管节段组织周围长出,培养第5天,细胞长满培养皿图1 原代TEC的分离培养Fig.1 The isolation and culture of primary TEC
2.2 原代TEC经TGF-β1处理后TRPC6表达水平升高
分离培养的WT小鼠原代TEC,加入5 ng/mL TGF-β1,处理0、12、24、48、72 h,收集细胞,采用Western blot技术检测各实验组TRPC6的表达水平。结果(图2)显示,原代TEC经TGF-β1处理48、72 h后,TRPC6的表达水平明显增高(均P<0.01)。
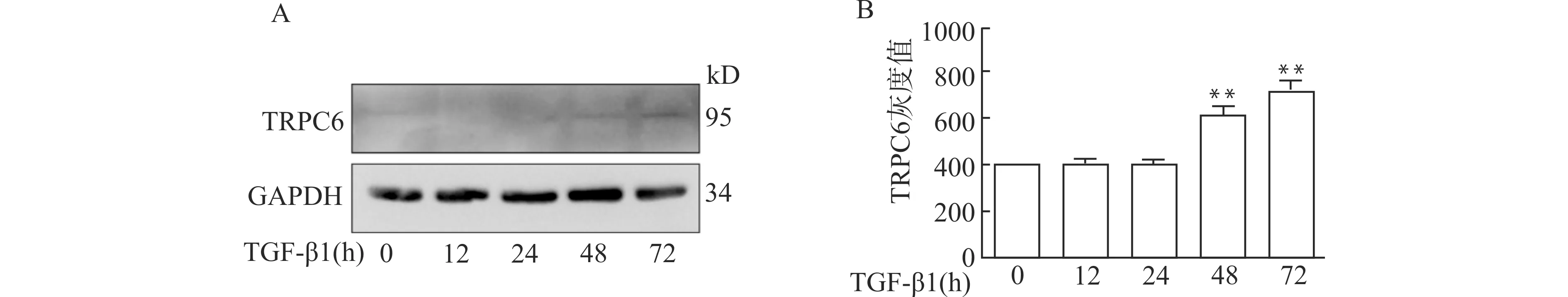
WT小鼠原代TEC经TGF-β1处理0、12、24、48、72 h后,A:采用Western blot技术检测TRPC6蛋白的表达情况;B:Western blot检测结果的统计学分析,与TGF-β1 作用0 h组比较,**P<0.01,n=3图2 WT小鼠原代TEC经TGF-β1处理后TRPC6的表达水平Fig.2 The expression level of TRPC6 in primary TEC stimulated with TGF-β1
2.3 原代TEC经TGF-β1处理后发生EMT且GSK-3β/β-catenin被激活
为了研究肾纤维化是否与EMT有关,以及其中涉及的分子机制,WT小鼠原代TEC经TGF-β1处理0、12、24、48、72 h,采用Western blot技术测定各组细胞内EMT分子标记以及GSK-3β/β-catenin信号通路相关蛋白的表达情况。Western blot结果(图3A~D)显示:原代TEC经TGF-β1处理0、12、24、48、72 h后,在WT小鼠中,与对照组(作用0 h)相比,随着TGF-β1作用时间的延长,EMT分子标记出现明显变化,E-cad和Cadh16的表达水平降低,而α-SMA的表达水平升高,这说明原代TEC经TGF-β1处理后发生EMT。
另外,Western blot结果(图3E~G)显示:原代TEC经TGF-β1处理0、12、24、48、72 h后,p-GSK-3β和β-catenin的表达水平均明显升高,这显示原代TEC经TGF-β1处理后细胞内GSK-3β/β-catenin通路被激活。
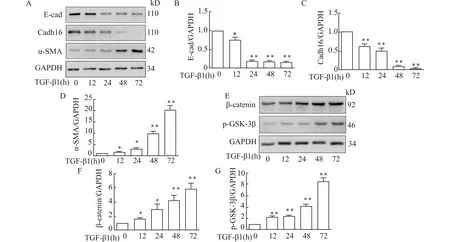
WT小鼠原代TEC经TGF-β1处理0、12、24、48、72 h,A:采用Western blot技术检测EMT分子标记(E-cad,Cadh16,α-SMA)的表达情况;B、C、D:EMT分子标记(E-cad,Cadh16,α-SMA)的Western blot结果的统计学分析;E:采用Western blot技术检测p-GSK-3β和β-catenin的表达水平;F、G:Western blot结果的统计学分析;与TGF-β1 作用0 h组比较,*P<0.05 **P<0.01,n=3图3 WT小鼠原代TEC经TGF-β1处理后发生EMT及GSK-3β/β-catenin通路被激活Fig.3 The appearance of EMT and activation of GSK-3β/β-catenin signaling pathway in TEC stimulated with TGF-β1
2.4 TRPC6敲除后EMT被抑制
为了从细胞水平进一步研究敲除TRPC6对肾脏的保护作用,本实验以WT和TRPC6-/-小鼠为研究对象,分离培养TEC,并经TGF-β1处理72 h后,采用Western blot技术检测各实验组细胞内EMT分子标记(E-cad,Cadh16,α-SMA)的表达情况。
Western blot(图4)结果显示:在WT小鼠中,与对照组比较,TEC经TGF-β1处理72 h后,E-cad和Cadh16表达下降,α-SMA表达升高;TRPC6-/-小鼠与WT小鼠相比,EMT分子标记的表达出现逆转,即TGF-β1处理后表达下降的E-cad和Cadh16出现回升,表达升高的α-SMA出现了下降。
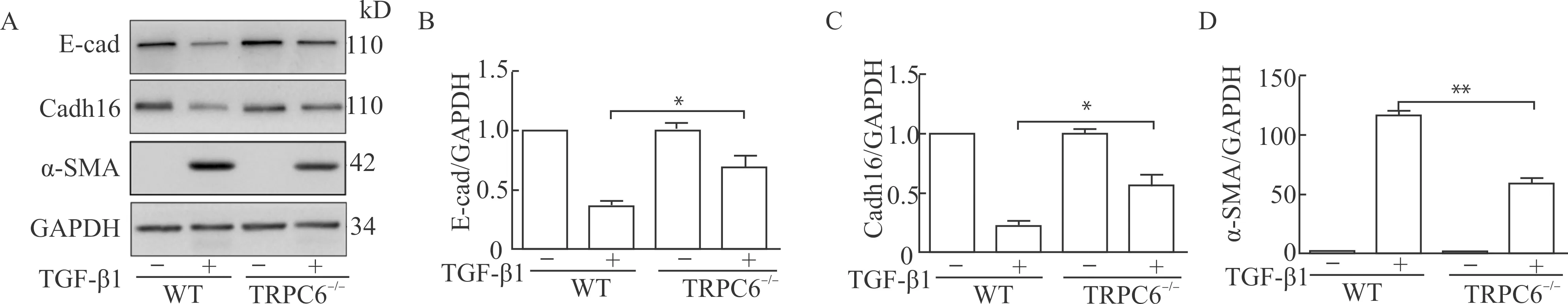
TEC经TGF-β1处理72 h后,A:采用Western blot技术检测WT和TRPC6-/-小鼠TEC中EMT分子标记(E-cad,Cadh16,α-SMA)的表达情况;B、C、D:EMT分子标记的Western blot结果的统计学分析,*P<0.05 **P<0.01,n=3图4 敲除TRPC6对TGF-β1处理后TEC中EMT的调控作用Fig.4 The regulatory effect of TRPC6 knockout on EMT in TEC stimulated with TGF-β1
这说明敲除TRPC6可在一定程度上抑制肾纤维化中TGF-β1所致EMT进程,但其中涉及的分子机制还需要进一步探索。
2.5 TRPC6敲除后GSK-3β/β-catenin信号通路下调
为明确肾纤维化中TRPC6调控EMT的分子机制是否与GSK-3β/β-catenin信号通路相关,TEC经TGF-β1处理72 h后,采用免疫荧光技术和Western blot技术检测各实验组细胞内p-GSK-3β和β-catenin的表达情况。免疫荧光结果(图5A)显示:在WT小鼠中TEC经TGF-β1处理72 h后,与对照组比较,细胞中β-catenin的表达升高,而TRPC6敲除后,TGF-β1刺激所致细胞内升高的β-catenin表达明显下降。Western blot(图5B、5C、5D)结果显示:原代TEC经TGF-β1处理72 h后,p-GSK-3β和β-catenin表达明显升高,而TRPC6敲除后,TGF-β1引起的p-GSK-3β和β-catenin的表达升高均被下调。
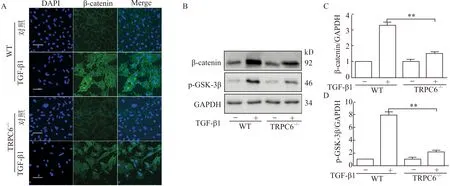
TEC经TGF-β1处理72 h后,A:采用免疫荧光技术检测WT和TRPC6-/-小鼠中β-catenin的表达情况,标尺=20 μm;B:采用Western blot技术检测WT和TRPC6-/-小鼠中p-GSK-3β和β-catenin的表达情况;C、D:Western blot结果的统计学分析,**P<0.01,n=3图5 敲除TRPC6下调GSK-3β/β-catenin信号通路Fig.5 TRPC6 knockout negatively regulates the GSK-3β/β-catenin signaling pathway
这充分说明了TEC经TGF-β1处理后,GSK-3β/β-catenin信号通路被激活,敲除TRPC6后GSK-3β/β-catenin信号通路被下调,这可能与TRPC6调控的EMT密切相关。
3 讨论
纤维化是一种正常的组织修复过程,反应过度就会导致细胞外基质和胶原纤维超负荷产生和累积,使得器官硬化从而导致功能下降,直至末期器官功能衰竭。肾纤维化是CKD发展到一定阶段的共同通路,最终将导致终末期肾衰竭。此过程中发挥功能的主要效应细胞是肌成纤维细胞,但其来源颇具争议[7]。有研究发现TEC经EMT,是肌成纤维细胞的一个重要来源,促进肾纤维化的发生发展[8-9]。
TEC是构成肾小管的最主要细胞,对维持肾脏正常的生理功能非常重要。在外界损伤因素的刺激下,TEC经EMT,可从多方面促进肾纤维化的发生发展:①使细胞停滞在G2/M期,影响细胞更新,阻止自我修复;②分泌炎性因子,扩大炎症反应;③通过旁分泌作用,刺激固有的成纤维细胞增殖活化以及外周细胞向肌成纤维细胞的转化,增加胞外基质的合成、分泌和沉积;④分泌和活化多种促纤维化的细胞因子,比如PDGF、TGF-β1、MMP等[10-11]。
有关肾纤维化TEC的研究在细胞水平大多集中在细胞系,比如NRK-52E、HEK293T和HK-2,以原代TEC进行的相关研究却非常少见[12-13]。本实验为了探索TEC在肾纤维化中的重要作用,采用组织爬片法从新鲜肾脏中分离培养原代TEC,首先通过细胞筛的双重过滤获取肾小管节段,将其放在合适的培养液中,随后组织周缘逐渐长出多边形的TEC,以此为实验对象研究TRPC6对肾纤维化中EMT的调控作用及分子机制。
EMT是一个比较复杂的过程,在各种刺激因素的作用下,上皮细胞典型的上皮标记分子表达降低,而细胞中原本没有或者表达量低的间质标记分子表达升高,这在多种细胞的分化和重塑中都发挥了重要作用[14]。在肾纤维化过程中,EMT也具有明显的促进作用[12,15]。有关纤维化的报道中,TGF-β1是研究最为广泛的一个细胞因子,在多种器官的纤维化和炎症中都至关重要[16-17]。且纤维化过程中表达升高的TGF-β1还与EMT进程密切相关,可通过不同的信号通路促进EMT的发生发展,因此它常用来作为EMT发生的体外诱导剂[18-20]。TGF-β1诱导EMT发生所涉及的信号通路有很多,其中GSK-3β/β-catenin信号通路在EMT的调控中具有重要的促进作用[21-22]。本实验中,原代培养的TEC经TGF-β1诱导后,细胞内EMT分子标记表达水平发生明显的变化,细胞内GSK-3β/β-catenin信号通路相关蛋白表达也明显升高,这说明原代TEC经TGF-β1刺激后细胞发生EMT,同时GSK-3β/β-catenin信号通路被激活,这在一定程度上揭示原代TEC经TGF-β1刺激后发生的EMT与GSK-3β/β-catenin信号通路密切相关。
TRPC6是瞬时受体电位通道家族中的一员,广泛表达在肾脏的多种细胞上,包括肾小管上皮细胞、足细胞和系膜细胞等,且与多种肾脏疾病密切相关[4,6]。TRPC6基因突变还会引发肾小球硬化症,影响肾脏的正常过滤功能[23]。而敲除TRPC6基因或者抑制TRPC6活性,对危险因素引起的肾损伤具有一定的保护作用。因此TRPC6作为治疗肾病的一个潜在靶点,一直以来受到人们的广泛关注。本实验中,为了研究TRPC6对肾纤维化的影响,我们分离培养原代TEC,经TGF-β1诱导后,细胞内TRPC6的表达水平明显升高,同时TEC经TGF-β1诱导后细胞内发生EMT,这说明TRPC6与TGF-β1诱导的细胞ETM密切相关,而TRPC6-/-小鼠与WT小鼠相比,其TEC经TGF-β1诱导后,细胞内EMT分子标记的改变明显发生逆转,这说明敲除TRPC6可在一定程度上抑制TGF-β1诱导的EMT,同时,TRPC6敲除后,因TGF-β1刺激升高的p-GSK-3β和β-catenin表达明显下降,说明该信号通路被下调,据此我们推测TRPC6可能通过GSK-3β/β-catenin信号通路调控EMT,从而影响TGF-β1诱导的TEC损伤。
综上所述,本实验发现敲除TRPC6可通过抑制EMT减轻TGF-β1诱导的TEC损伤,且与GSK-3β/β-catenin信号通路密切相关,在细胞水平上证实敲除TRPC6可减轻肾脏的纤维化损伤,从而对肾脏具有一定的保护作用,为以后治疗CKD新策略的研发提供了理论依据。同时,虽然已有大量研究证实损伤TEC发生的EMT在肾纤维化过程中是必需的,且抑制EMT可有效减轻肾纤维化损伤,但肾纤维化中EMT发生的分子机制还不是十分清楚。因此,研究EMT发生的相关分子机制,对于充分理解和研究肾纤维化进程以及抗纤维化策略也有非常重要的现实意义。

