膜性肾病的多靶点治疗一例)
李双喜 许 静 李 娟 孙 婧 董 睿 边 琪 郭志勇
1 临床资料患者男,52岁,因“发现尿中泡沫增多2月,伴双下肢水肿19 d”于2021年1月29日收入海军军医大学第一附属医院肾内科。患者于2020年11月24日在无明显诱因下出现尿中泡沫增多,至海军军医大学第一附属医院就诊,检查提示尿蛋白(++++),尿白细胞、尿红细胞均呈阴性,当时未予重视。2021年1月10日患者突发胸前区疼痛,无放射痛,伴双下肢水肿,于当地医院检查肌钙蛋白<0.01 ng/mL,D-二聚体1 601 ng/mL,尿蛋白(+++),尿隐血(++),血白蛋白15.2 g/L,血肌酐65.9 μmol/L,血常规未见明显异常。胸部CT检查结果示:右肺中叶及左肺上叶结节,右肺中叶及左肺上舌段慢性炎症,右肺多发肺大泡。于2021年1月13日在当地医院行肾脏穿刺活组织检查(简称活检),结果示:光学显微镜(简称光镜)下见8个肾小球,未见肾小球球性硬化及节段性硬化。肾小球系膜细胞和基质轻度弥漫性增生,毛细血管襻开放,外观显僵硬,基底膜增厚,可见少量钉突样结构,上皮下、系膜区可见嗜复红蛋白沉积(图1A、1B),未见纤维素样坏死,未见白金耳样结构,壁层上皮细胞无增生,未见新月体形成。肾小管上皮细胞空泡及颗粒变性,个别肾小管萎缩,肾间质少量炎症细胞浸润伴轻度纤维化,小动脉管壁轻度增厚。刚果红染色、氧化刚果红染色、油红“O”染色结果均呈阴性。免疫荧光染色结果示:IgG弥漫、球性沿毛细血管襻呈融合性颗粒状沉积(图1C),磷脂酶A2受体(PLA2R)呈阴性。电子显微镜(简称电镜)下见基底膜不规则增厚,足突弥漫融合,上皮下、基底膜内、系膜区大量电子致密物沉积(图1D)。血抗PLA2R呈阴性。结合患者症状、体征及检查结果,符合膜性肾病诊断,需排除继发性可能。为求进一步诊治至海军军医大学第一附属医院就诊。
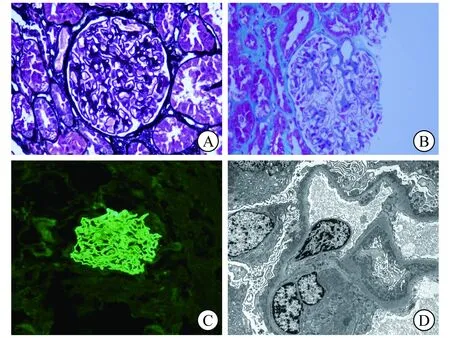
A、B 过碘酸六胺银染色(PASM)、Masson染色(×400)显示,基底膜增厚,可见少量钉突样结构,上皮下、系膜区可见嗜复红蛋白沉积 C 免疫荧光染色(×400)显示,IgG弥漫、球性沿毛细血管襻呈融合性颗粒状沉积 D 电镜(×5 000)显示,基底膜不规则增厚,足突弥漫融合,上皮下、基底膜内、系膜区大量电子致密物沉积图1 肾脏穿刺活检病理学检查结果
入院后体格检查示:血压130/75 mmHg(1 mmHg=0.133 kPa),心率88次/min,体重60 kg,颜面部水肿,双肺听诊未闻及干湿性啰音,双下肢重度水肿。实验室检查示:血白蛋白14 g/L,血肌酐73 μmol/L,肾小球滤过率(MDRD公式)104 mL/min,TC 16.45 mmol/L,TG 4.05 mmol/L,LDL-C 13.51 mmol/L,D-二聚体 4.99 μg/mL,24 h尿蛋白定量23 745 mg,标本量500 mL,尿IgG 1 360 mg/L,血IgG 17.90 g/L,血IgG4 9 g/L。住院期间复查血IgG4 1.7 g/L,另行肾脏组织lgG4免疫组织化学(简称免疫组化)染色,结果为阴性。糖耐量、自身抗体、免疫固定电泳、肿瘤标志物检查均呈阴性;消化道内镜检查提示,慢性萎缩性胃炎伴糜烂。盆腔CT检查见包裹性肿块,多发淋巴结肿大,前期行CT引导下穿刺引流及病理学检查未见恶性细胞。淋巴结活检病理学检查结果未见异常。全身PET-CT检查未见活动性肿瘤病变。病毒性肝炎各项指标检查未见异常。结核感染T细胞检测呈阳性。追问病史,患者既往有饮酒史和大量吸烟史,已戒烟、戒酒1年;既往有“听神经良性肿瘤”切除史;无特殊用药史。
结合患者的临床表现及辅助检查结果,排除继发性膜性肾病可能,诊断为PLA2R阴性的特发性膜性肾病(IMN)。给予补充白蛋白、利尿消肿、降脂、抗凝、降尿蛋白等对症支持治疗。因患者结核感染T细胞检测呈阳性,给予异烟肼和利福平预防性抗结核治疗。排除相关禁忌证后,于2021年2月5日给予静脉滴注甲泼尼龙琥珀酸钠80 mg/d,连用3 d,改为强的松60 mg/d口服,1个月后予减量,每周减5 mg,4个月内停用糖皮质激素。2月22日和3月7日分别给予利妥昔单抗(RTX)1 g治疗。3月11日始每半月予环磷酰胺(CTX)0.4 g行冲击治疗,累积冲击4次,CTX累积剂量1.6 g。RTX治疗5个月后复查CD19明显升高,尿蛋白未完全转阴,于7月17日给予第3次RTX 1 g治疗(累计3 g)。治疗过程中给予复方甲恶唑预防卡氏肺孢子病,丙种球蛋白提高免疫力、预防感染。随访数据详见表1。RTX治疗完成后出院,随访至今。

表1 住院及随访期间患者重要数据值的变化情况
2 讨 论膜性肾病是肾病综合征常见的病因之一,大约75%为IMN所致[1-2]。其中,30%~35%可自行缓解, 30%~40%的患者最终在5~15年内发生肾衰竭,需行肾脏替代治疗或肾脏移植。因此,大部分患者需要行积极的免疫抑制剂治疗,尤其是存在高风险进展为终末期肾病(ESRD)的患者。根据2019年改善全球肾脏疾病预后组织(KDIGO)制订的关于膜性肾病的诊治指南中提出:综合起始的肾功能是否受损、蛋白尿程度及选择性、肾病综合征并发症和PLA2R抗体水平以评估患者肾功能进展的风险[3]。对于高危及以上的患者建议给予免疫抑制剂治疗。本例患者虽然PLA2R呈阴性,排除了继发性膜性肾病,但入院后相关检查显示24 h尿蛋白定量>23 000 mg,血白蛋白为14 g/L,伴有严重的脂质代谢紊乱,肾功能轻度下降,属于高危患者,需要接受免疫抑制剂治疗。
鉴于肾小球激光显微解剖和溶解性消化蛋白质谱技术的发展,发现了多种膜性肾病相关的抗原,70%~80% IMN患者血清中PLA2R呈阳性[4],1%~3%IMN患者1型血小板反应蛋白7A域(THSD7A)呈阳性[5],同时还含有一些未知的靶抗原。近年来,有学者认为B淋巴细胞介导的体液免疫引起的肾小球基底膜上皮侧免疫复合物的沉积与IMN相关[6]。RTX是一种嵌合的小鼠/人单克隆抗体,可诱导B细胞凋亡,通过消除B细胞来治疗膜性肾病。根据KDIGO指南,RTX应用于严重肾病综合征或传统免疫抑制治疗无效的患者。有研究[6]提示,RTX治疗后部分缓解率虽低于CTX治疗,但蛋白尿完全缓解率和终点事件发生率与CTX治疗相比无显著差异。MENTOR研究[7]结果表明,RTX可取代环孢霉素作为一线免疫抑制药物。STARMEN 研究[8]和 RI-CYCLO 研究[9]均提示,RTX治疗膜性肾病的效果不劣于CTX联合糖皮质激素的治疗方案。近年来,关于RTX在IMN中的临床试验获得了一些鼓舞人心的结果。
虽然,众多的临床试验确定了RTX治疗IMN的有效性,但RTX治疗的无反应率约为35%[10-11]。既往的研究[12]提示,RTX起效较CTX慢。在RI-CYCLO 研究[9]中,随访12个月时,采用CTX联合糖皮质激素治疗的患者完全缓解率为32%,RTX治疗的完全缓解率为16%;而随访至24个月时,CTX联合糖皮质激素治疗的完全缓解率为42%,RTX治疗的完全缓解率为43%。这也提示RTX起效时间较慢。因此,对于风险较高、肾功能快速丧失、严重低蛋白血症的患者应选择起效更快的药物治疗。本例患者短期内已有血肌酐水平轻度升高,严重的低蛋白血症伴严重的胸腹水,选择一种能使得患者病情快速缓解的方案尤为重要。根据既往的报道,本例患者可选择CTX联合糖皮质激素治疗。
但目前,即使在延长随访时间的情况下,使用标准方案CTX和糖皮质激素治疗后的患者完全缓解率为35%~60%[13-14]。同样,RTX单药治疗的研究[15]显示,完全缓解率也只有30%~43%。一项纳入小样本量的行RTX联合小剂量CTX及糖皮质激素治疗膜性肾病的研究[16]显示,随访1年,患者的部分缓解率为100%,完全缓解率为93%。强的松和CTX靶向浆母细胞和浆细胞,而RTX清除了补充浆细胞群所需的B细胞,三者联合的多靶点治疗,大大提高了IMN的缓解率。本例患者就诊时24 h尿蛋白定量>23 000 mg,肾功能轻度下降,如不能快速有效地改善尿蛋白情况,发生急性肾衰竭和血栓等严重并发症的风险较高。结合既往文献报道的CTX联合糖皮质激素起效较快而RTX起效较慢的特点,应给予患者足量糖皮质激素联合CTX,同时给予RTX治疗。RTX起效后维持时间长,因此可在早期、短期给予小剂量CTX,本例患者仅接受了每2周1次的小剂量CTX冲击治疗(即0.4 g×4次)。同时,强的松快速减量,4个月后已完全停用强的松。患者临床症状得到快速缓解,尿蛋白量显著减少。RTX联合糖皮质激素和小剂量CTX的治疗方案在本例患者中取得了较好的疗效,治疗1个月后即达到部分缓解,3个月后尿蛋白下降了85.2%,血白蛋白水平稳步上升。7月15日复查,CD19绝对计数已为6个,结合患者尿蛋白未完全缓解,给予第3次的1.0 g RTX治疗。
同时使用3种免疫抑制药物是否会增加患者感染风险?本例患者强的松快速减量,1个月后每周减少5 mg,4个月后完全停用,避免了长期服用糖皮质激素导致的不良反应。CTX的使用量显著低于标准剂量。CTX导致的尿路上皮癌、骨髓增生异常综合征、白血病和其他恶性肿瘤的风险呈剂量依赖性[17-18],调整CTX剂量可进一步减少潜在的不良反应发生。瘙痒和输注相关反应在RTX的用药治疗中比较常见。本例患者3次RTX输注过程均无明显的不良反应。一项关于抗中性粒细胞胞浆抗体(ANCA)相关性血管炎的研究[19]显示,采用RTX进行诱导治疗和维持治疗,平均随访2.1年,未见明显的不良反应。本例患者随访过程中,无严重感染发生,耐受良好。本例所采用的治疗方案能否广泛应用于临床IMN的治疗值得进一步的研究与探索。

