可回收再生NiO/NaBr催化剂蒸汽重整甲醛制氢
王忠华,储 林,葛展志,丁 妍,刘优林,,沈岳松,*
(1.江苏索普(集团)有限公司,江苏 镇江 212006;2.南京工业大学 材料科学与工程学院,江苏 南京 211816)
0 引 言
挥发性有机废气(VOCs)不仅具有很强的毒性,严重危害人体健康,同时也是PM2.5和臭氧的重要前体物[1-2],成为恶化大气质量的主要因素之一,是国家“十三五”以来大气污染治理的重点。目前治理VOCs的主要技术有直接燃烧法[3-4]、催化燃烧法[5-7]、吸附法[8-9]、吸收法[10]、冷凝法[11-12]、光催化降解法[13-15]和生物处理法[16-17]等,其中燃烧法和催化燃烧法为当前工业应用的主流技术,其实质是将VOCs转化为CO2和H2O,但也牺牲了其作为化学资源的价值。如能对VOCs进行无害化处置的同时,还能实现变废为宝,将具有重大研究意义。
目前,化学储氢和释氢成为能源领域研究的热点[18],鉴于VOCs富含氢,如能对其进行高效释氢,将具有广阔的应用前景。在现有有机物制氢技术中,重整制氢技术成熟[19-20]、效率高、稳定性好,成为化工制氢的主流技术,催化剂为其技术核心。然而,商用催化剂大多为贵金属类,成本高昂,特别是其失效后难以回收利用,造成了极大的资源浪费。为实现重整催化剂的循环再生,并增强其对VOCs反应物分子的高效吸附,本论文设计了以对VOCs反应物分子有强吸附作用、熔点高且易水溶的NaBr为载体,以具有与贵金属断裂C—C、C—H和C—O键能力相媲美的NiO为活性组分[21],构建了低成本可循环回收的NiO/NaBr催化剂体系,以甲醛作为VOCs的典型代表,对NiO/NaBr催化剂蒸汽重整甲醛制氢进行研究,并采用XRD、N2吸附/脱附、SEM、XPS、H2-TPR、insituDRIFTS等表征技术,分别对NiO/NaBr催化剂的物相结构、比表面积、微观形貌、元素价态、氧化还原性质及蒸汽重整反应瞬态进行表征,以此探讨VOCs重整制氢的可行性。
1 实验部分
1.1 NiO/NaBr催化剂的制备
采用超临界水热合成法制备NiO质量负载量分别为1%、2%、3%、4%和5%的NiO/NaBr催化剂。首先,称取20 g NaBr、2 g去离子水和相应质量比例的Ni(NO3)2·6H2O,置于聚四氟乙烯消解罐中。随后将消解罐装入水热反应釜中,在180 ℃ 条件下保温12 h。待水热反应釜降至室温,将消解罐中的样品于马弗炉中650 ℃焙烧2 h;冷却后,将样品取出,破碎并筛分造粒,得到粒度为20~40目的催化剂,用于蒸汽重整甲醛制氢性能评价。制备的催化剂样品标记为X%NiO/NaBr(X=1、2、3、4、5)。
1.2 NiO/NaBr催化剂的回收再生
采用水洗和酸洗工艺直接回收使用过后的NiO/NaBr催化剂中的NaBr载体和NiO活性组分。首先,将使用过后的催化剂置于去离子水中超声溶解NaBr,然后离心分离NaBr水溶液和NiO/Ni/C沉淀。NaBr水溶液经过油浴加热蒸干得到最终的NaBr粉末。其次,在NiO/Ni/C混合物中缓慢加入适量浓硝酸(浓度为65%~68%),并置于常温环境下反应72 h(2NiO+4HNO3→2Ni(NO3)2+2H2O),得到硝酸镍溶液。然后离心收集上层绿色硝酸镍清液并干燥12 h,获得硝酸镍固体。将上述回收得到的NaBr和硝酸镍通过超临界水热合成法重新制备该催化剂进行循环使用。
1.3 NiO/NaBr催化剂蒸汽重整甲醛制氢性能评价
制氢性能评价在实验室蒸汽重整固定床反应系统中进行。采用内径为8 mm、壁厚2 mm、长度800 mm的不锈钢管反应器,装填1 g催化剂置于管道中央。为了固定催化剂,在其进气端填充长约15 mm的石英砂(粒径0.30~0.71 mm),在出气端填充长约10 mm的石英棉。催化剂两端各安装一根热电偶,用于监测催化剂床层两端的温度变化。配制H2O/HCHO摩尔比为2.5的甲醛溶液,通过蠕动泵输送,设定流速为10 mL/h;通过预热单元(200 ℃)加热溶液成气体,以N2为载气,控制空速(GHSV)为20 000 h-1。预热后通入反应器,在催化剂的作用下发生蒸汽重整反应。反应产物经过冷凝装置除去未反应的甲醛和水,之后随载气一同进入气相色谱仪(GC-2014),进行在线定量分析H2、CO、CH4和CO2。测试温度为300~500 ℃,间隔为50 ℃;不同反应温度下维持反应1 h,以获得稳定的测试结果,并且每个温度点进行3次测试以减少随机误差。
本测试用气相色谱仪(GC-2014)配备TDX-01色谱柱的热导检测器(TCD)检测气体,并配备PEQ毛细管柱的火焰电离检测器(FID)检测液体。在甲醛蒸汽重整反应中,HCHO中的C与H2O中的H之比为1∶2,即1 mol HCHO和1 mol H2O产生2 mol H2,具体反应方程式如下:
(1)
(2)
(3)
(4)
(5)
(6)
式(2)~(6)中:甲醛转化率以XF表示,H2、CO、CH4和CO2的选择性分别以SH2,SCO,SCH4和SCO2表示;molF,in代表通入反应体系的甲醛的摩尔总数,molF,out代表未反应的甲醛摩尔数。
1.4 NiO/NaBr催化剂表征
使用X射线衍射仪(D/MAX-RB,Rigaku)对催化剂样品的物相结构进行测定,2θ扫描范围为10°~80°,扫描步长5°/min,加速电压40 kV。使用表面积分析仪(3H-2000PS2,Best)通过N2吸附/脱附等温线法(N2-BET法)测量催化剂样品的比表面积。使用化学吸附分析仪(TPD/TPR 2900,Micromeritics)对催化剂样品的还原性质进行测定,在H2-TPR实验之前,将所选样品在Ar流中400 ℃处理1 h,然后冷却至50 ℃。使用5% H2/Ar以20 mL/min的流速获得还原曲线,温度以10 ℃/min从100 ℃升到700 ℃。采用SEM(JSM-6510,JEOL)测量催化剂样品表面的微观形貌,测试前在样品上涂上Au导电膜以避免放电效应,观测时使用15 kV的加速电压进行分析。使用X射线光电子能谱仪(AXIS-ULTRA DLD,KRATOS)对催化剂样品的元素价态进行测定,单色Al-Kα辐射用作激发源,XPS设备的真空度维持在10-7Pa,用研杵和研钵研磨样品,制成用于制片的粉末,将催化剂在100 ℃下干燥24 h完全除去水分后,无需表面溅射或蚀刻直接对催化剂进行分析。使用红外光谱仪(Is10,Thermo Nicolet)对催化剂样品进行原位漫反射红外傅里叶变换光谱分析,将催化剂样品放入DRIFT池中,然后在质量流量计的控制下,将反应气体混合物(HCHO/H2O/N2,50 mL/min)通入DRIFT池中,光谱仪装备有液氮冷却MCT检测器。每条光谱经过32次扫描获取,分辨率为4 cm-1。
2 结果与讨论
2.1 NiO/NaBr催化剂蒸汽重整甲醛制氢性能
1%~5%NiO/NaBr催化剂蒸汽重整甲醛的H2、CO、CH4和CO2选择性如图1所示。从图1(a)中可见,在300~450 ℃内,1%~5%NiO/NaBr催化剂的制氢选择性都随反应温度的升高而增加;其中1%~4%NiO/NaBr催化剂均在450 ℃时H2选择性达到最大值,并且2%NiO/NaBr在450 ℃ 时H2选择性最高,达到104%。之所以其H2选择性超过100%,主要是因为水煤气变换反应(WGSR,CO + H2O→CO2+ H2)的额外贡献[22]。此外,随着NiO负载量进一步增加,5%NiO/NaBr催化剂的低温H2选择性明显降低,这可能是高负载量的NiO富集结晶降低了其在载体表面的分散,从而减少了其与反应物分子之间的有效接触,但其在450 ℃的H2选择性仍能达到82%。随着反应温度的继续升高,1%~4%NiO/NaBr催化剂的H2选择性在500 ℃时均有降低,而5%NiO/NaBr催化剂却在500 ℃略有升高,可能是高负载量的NiO有利于高温的制氢稳定性。
由图1(b)可见,CO的选择性随反应温度升高的变化趋势与H2选择性的变化一致,特别是在300~450 ℃内,CO选择性逐步增加,可能是甲醛的热分解反应(HCHO→H2+CO)随温度升高更加突出[23]。在450~500 ℃段,1%~4%NiO/NaBr催化剂的H2和CO的选择性均有下降,结合此温度段CO2选择性上升趋势,可能是高温下甲醛热解反应减弱,以重整反应为主。由图1(c)可见,CH4的选择性都非常低,不超过1%,说明NiO/NaBr催化剂蒸汽重整甲醛过程中产生的H2不会大量消耗生成碳氢类副产物,对制氢选择性有利。由图1(d)可见,1%、2%和4%NiO/NaBr催化剂的CO2选择性呈“N”型变化,在350 ℃取得最大值,其中2%NiO/NaBr催化剂350 ℃时最高CO2选择性为66%。3%NiO/NaBr催化剂的CO2选择性呈“凹”型变化;5%NiO/NaBr催化剂的CO2选择性呈“凸”型变化,最大CO2选择性出现在400 ℃。上述CO2的选择性之所以变化大,主要是因为该制氢过程是存在蒸汽重整、甲醛裂解、水煤气变换等复杂交错的反应导致。此外,在300~350 ℃期间,NiO/NaBr催化剂的H2和CO2选择性几乎同步上升,说明此温度段甲醛蒸汽重整反应占主导。
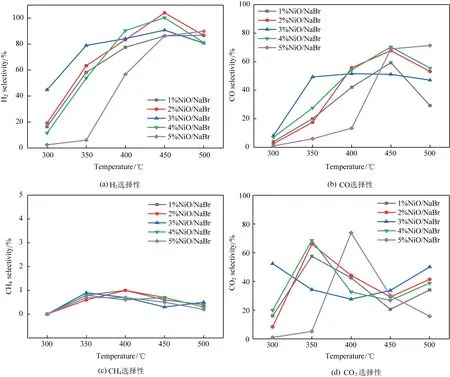
图1 NiO/NaBr催化重整产物的选择性Fig.1 Reforming products selectivity of NiO/NaBr
1%~5%NiO/NaBr催化剂蒸汽重整甲醛的碳平衡和甲醛转化率分别如图2和图3所示。在350 ℃,2%NiO/NaBr催化剂的甲醛转化率超过90%,碳平衡超过80%;在400~500 ℃内,2%NiO/NaBr催化剂的碳平衡和甲醛转化率接近100%。
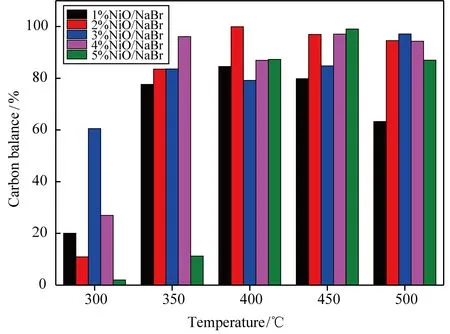
图2 1%~5%NiO/NaBr催化剂的碳平衡Fig.2 Carbon balance of 1%~5%NiO/NaBr catalyst

图3 2%NiO/NaBr催化剂的HCHO转化率Fig.3 HCHO conversion of 2%NiO/NaBr catalyst
这说明2%NiO/NaBr催化剂能有效地将甲醛转化为H2和COX,且催化剂不易积碳。经一次回收再生的2%NiO/NaBr催化剂蒸汽重整甲醛的H2选择性如图4所示,其H2选择性能基本恢复到新鲜催化剂的水平,450 ℃的H2选择性达到97%。图5展示了2%NiO/NaBr催化剂在450 ℃下蒸汽重整甲醛制氢的稳定性,经60 h稳定运行,H2选择性维持稳定且均高于95%。

图4 新鲜与一次再生的2%NiO/NaBr催化剂的H2选择性Fig.4 H2 selectivity of fresh and once regenerated 2%NiO/NaBr catalyst

图5 2%NiO/NaBr催化剂的制氢稳定性Fig.5 Hydrogen production stability of 2%NiO/NaBr catalyst
2.2 NiO/NaBr催化剂的表征分析
新鲜的1%~5%NiO/NaBr催化剂和使用后的2%NiO/NaBr催化剂的粉末XRD图谱如图6所示。2θ为25.82°、29.82°、42.76°、50.62°、53.04°、62.08°、68.40°、70.48°和78.32°的特征衍射峰均对应NaBr相的不同晶面。在新鲜催化剂的XRD图谱中,2θ为37.28°和42.29°处的特征衍射峰归属于NiO相,并且NiO特征峰的峰强度与其负载量正相关。在使用后的2%NiO/NaBr的XRD图谱中没有发现属于NiO的特征峰,但在2θ为44.48°处观察到属于金属Ni相的特征峰。金属Ni相的出现可能是由于甲醛的热分解产生的还原性气体(H2和CO)还原所致,同时也存在NiO被甲醛直接还原的可能。考虑到使用后的2%NiO/NaBr催化剂没有失活,这说明Ni可以替代NiO在甲醛蒸汽重整反应过程中充当活性组分的作用。

图6 1%~5%NiO/NaBr和使用后的2%NiO/NaBr的粉末X射线衍射图谱Fig.6 XRD patterns of 1%~5%NiO/NaBr and used 2%NiO/NaBr
为了分析不同催化剂组分的氧化还原性质及载体与活性组分相互作用对氧化还原性质的影响,图7显示了NiO、NaBr、2%NiO/NaBr和2%NiO+NaBr(纯NiO和NaBr机械混合)4个样品的H2-TPR曲线。纯NiO的H2-TPR曲线在384 ℃有一个显著的耗氢峰及在452 ℃有一个微弱的耗氢峰,均归因于NiO的还原[24]。纯NaBr载体的H2-TPR曲线没有出现耗氢峰,一方面表明其氧化还原性质非常弱;另一方面,说明NaBr载体在氢气氛下非常稳定,不会生成HBr等气体,此与蒸汽重整产物没有检测到HBr相一致。2%NiO/NaBr催化剂的耗氢峰出现在344 ℃,这意味着NiO/NaBr催化剂的氧化还原性质是由NiO活性组分贡献的,但是其耗氢峰温度明显低于NiO的低温耗氢峰,表明2%NiO/NaBr催化剂具有比纯NiO更好的低温氧化还原性质。为了揭示NaBr载体和NiO活性组分之间的相互作用对催化剂氧化性质的影响,对比了机械混合的2%NiO+NaBr和2%NiO/NaBr的两者的氧化还原性质,由图可见,2%NiO+NaBr的耗氢峰出现在435 ℃,尽管比纯NiO的高温耗氢峰温度低,但比2%NiO/NaBr催化剂的耗氢峰温度高了91 ℃,表明NaBr载体与NiO活性组分之间的强相互作用有利于提高催化剂的低温氧化还原性质。

图7 NiO、NaBr、2%NiO/NaBr及2%NiO+NaBr的H2-TPR曲线Fig.7 H2-TPR curves of NiO,NaBr,2%NiO/NaBr and 2%NiO+NaBr
本课题组前期设计制备了8NiO/V2O5(WO3)/TiO2(8N/VWT)催化剂,其中NiO为活性组分,V2O5(WO3)/TiO2为载体,并用于甲醛蒸汽重整。实验结果显示其H2选择性在500 ℃时达到最高值100%,H2-TPR耗氢峰出现在541 ℃[25]。与8N/VWT相比,2%NiO/NaBr催化剂蒸汽重整甲醛的最佳反应温度降低了50 ℃,还原温度降低了192 ℃。鉴于两种Ni基催化剂的区别就是载体不同,由此可以推测,NiO会受到NaBr载体中Br-或Na+离子的场作用,使得Ni—O键被弱化,这也是NiO/NaBr比8N/VWT催化剂有更低温高效制氢性能的主要原因。
1%~3%NiO/NaBr催化剂的比表面积如表1所示。BET测试的结果表明NiO/NaBr系列催化剂的比表面积都很小,在0.56 m2/g至0.89 m2/g范围内。其中,制氢性能较优的2%NiO/NaBr催化剂的比表面积仅为0.89 m2/g,远低于其他难再生的高比表面镍基催化剂[26]。因此,NiO/NaBr在蒸汽重整甲醛制氢过程中均突破了低比表面催化剂难以获得高质量催化活性的瓶颈。

表1 1%~3%NiO/NaBr的BET比表面积Table 1 BET specific surface area of 1%~3%NiO/NaBr
新鲜与使用后的2%NiO/NaBr催化剂的SEM微观形貌如图8所示。由图8(a)和(b)可以发现,新鲜的催化剂表面凹凸不平,呈峰峦结构,但是凸起的峰峦结构的表面光滑密实,这直观地解释了NiO/NaBr催化剂比表面积很小的原因。NiO颗粒分散在催化剂表面,平均粒径为100 nm。
由图8(c)和(d)可见,使用后的催化剂表面分散的颗粒尺寸有所降低,主要是NiO被还原金属Ni。此外,没有观察到明显的焦炭沉积,表明NiO/NaBr催化剂具有良好的抗积碳能力。鉴于NiO/NaBr催化剂的比表面积非常小,表面致密,可推测其蒸汽重整甲醛反应是快速的表面反应过程。
采用insituDRIFTS分析了450 ℃时NaBr、NiO和2%NiO/NaBr上的吸附中间体,其结果如图9所示,特征波数及对应的物种信息如表2所示。在NaBr的原位红外吸收光谱中,波数2 933 cm-1为甲酸物种(HCOO—)的v(OH)的特征峰。波数1 769 cm-1属于吸附态甲醛(HCHOab)的v(CO)的特征峰,波数1 146 cm-1为吸附的聚甲醛的特征峰,波数1 056 cm-1和1 009 cm-1均为吸附的甲醛的特征峰。另外,波数2 382 cm-1和2 304 cm-1都属于吸附的CO2的特征峰。载体上没有观察到明显的吸附水和羟基的特征波数峰,但观察到了吸附的聚甲醛和甲醛的特征波数峰,峰强度与反应时间正相关。这也说明了NaBr载体对甲醛具有很强的吸附能力,从而弥补因NiO/NaBr催化剂比表面小而造成接触反应物几率小的不足。同时,在NaBr载体上发现甲酸物种和CO2的特征波数峰,这也表明甲醛本身在高温下会有一定的分解。

图9 催化剂不同吸附时间的原位红外光谱Fig.9 In situ DRIFTS spectra of catalysts with different adsorption times
在NiO的原位红外吸收光谱图中,波数3 673 cm-1和3 615 cm-1均归属于v(OH)和vs(H2O) 的特征峰[27-28],也发现了属于甲酸物种(HCOO—)的特征波数,分别为2 807 cm-1的v(CH)、1 604 cm-1处的vas(COO)和1 318 cm-1处的vs(COO)。波数2 186 cm-1属于吸附的CO的特征峰,而波数2 304 cm-1属于吸附的CO2的特征峰[30,35]。波数1 397 cm-1处对应亚甲二氧基(DOM)的v(OCO)的特征峰[32],波数1 209 cm-1和1 053 cm-1均为吸附态的HCHO的特征峰。在NiO上未观察到聚甲醛的特征波数,这表明甲醛的聚合反应主要发生在NaBr载体上。NiO上的吸附水、羟基、甲酸物种、DOM和甲醛的特征波数峰强度随着反应时间的增加而增加,说明NiO能够有效吸附甲醛和水,并产生大量活性羟基参与反应。

表2 特征波数及对应的物种信息Table 2 Characteristic wave numbers and corresponding species information
在2%NiO/NaBr催化剂的原位红外吸收光谱图中,可以观察到属于甲酸物种、吸附态的CO和CO2、DOM、甲醛及聚甲醛的特征波数峰,没有观察到明显的吸附水和羟基的特征波数峰。NiO/NaBr催化剂蒸汽重整甲醛反应的中间产物为DOM和HCOO—。与NiO的DRIFTs相比,NiO/NaBr催化剂上甲酸中间物种的特征波数的峰强更高,说明NaBr载体的存在有利于促进催化剂转化甲醛。
采用XPS分析新鲜和使用后的2%NiO/NaBr催化剂表面Ni、O和Br元素的详细化学状态变化,结果如图10所示。由图10(a)可见,新鲜催化剂的Ni 2p3/2的特征峰出现在结合能(简称BE)为854.1 eV处,Ni 2p1/2的特征峰出现在BE为871.9 eV 处[36]。出现在BE为859.2 eV和878.5 eV的特征峰归属于卫星峰,这是由于存在Ni3+↔Ni2+的转变[37-38]。使用后催化剂的Ni 2p特征峰的结合能比新鲜催化剂要高,峰面积也明显降低,这可能由于反应前后化学状态发生变化导致的。对于Ni 2p3/2中的Ni2+峰,据报道该峰的强度随缺陷浓度的增加而增加[39]。与NiO的XPS谱图相比,NiO/NaBr催化剂中Ni的位置略微移至较低的结合能处,发生这种变化的主要原因是由于表面上存在氧空位,这说明NiO/NaBr催化剂具有更优异的低温氧化性能。图10(b)显示了使用前后催化剂在O 1s区域的XPS光谱。新鲜催化剂的XPS曲线由三个主峰组成,在531.3 eV处的峰归属于晶格氧,在533.2 eV处较弱的峰归属于表面羟基,在536.4 eV处最强的峰归属于吸附水[40]。使用后催化剂的三个峰的结合能比新鲜催化剂的要弱,吸附水峰的面积也明显增大,说明NiO/NaBr催化剂对水有一定的吸附能力。图10(c)显示了使用前后催化剂在Br 3d区域的XPS光谱。新鲜催化剂的Br 3d光谱图拟合到两个峰,分别出现在BE为70.5 eV和65.0 eV处。使用后催化剂的Br 3d特征峰的结合能明显后移,这可能是由于化学环境变化导致的。
3 结 论
采用超临界水热合成法制备的1%~5%NiO/NaBr催化剂均能高效蒸汽重整甲醛制氢,其中2%NiO/NaBr催化剂在450 ℃时表现出较佳的制氢性能,得到接近100%的甲醛转化率及104%的H2选择性;使用后的催化剂一次再生后的制氢性能恢复到新鲜水平。XRD分析表明,在NiO/NaBr催化剂蒸汽重整甲醛反应过程中,活性成分NiO还原为Ni,不影响制氢性能。新奇的是,该系列NiO/NaBr催化剂的比表面积非常小,却具有高效的制氢性能,突破了小比表面催化剂难以获得高质量催化活性的局限,该催化剂蒸汽重整甲醛反应是表面快速反应的过程。NaBr载体在此过程中起到了关键作用,不仅对甲醛具有很强的吸附作用并生成聚甲醛,还能与NiO发生强相互作用,进而提升了NiO/NaBr催化剂的低温氧化还原性质,促使催化剂具有高效的低温制氢活性。该研究不仅实现了重整催化剂的循环回收再生,也为小比表面高活性催化剂的设计及其在有机催化中的应用拓宽了思路。

