配对盒基因6抑制肝星状细胞活化的作用机制*
张 迪,谭悦浩,刘漪沦,李 灿,刘 蓉,胡 雪,唐 斌,邓峰美△
1.成都医学院 基础医学院(成都 610500);2.成都医学院第一附属医院(成都 610500);3.雅安市名山区人民医院(雅安 625000)
目前,慢性肝脏疾病是危害人类健康的主要因素之一,全球1%~2%的患者有肝脏相关疾病[1]。据2022年统计,我国患有慢性肝炎、脂肪肝和肝硬化等肝脏疾病的患者超过4.47亿人[1]。基于现有人口规模估计,未来患有慢性肝脏疾病人数最多的国家将是中国[2]。肝纤维化是由多种慢性致病因子导致的结缔组织异常增生的病理生理过程[3]。有研究[4-5]认为,肝星状细胞(hepatic stellate cells,HSCs)活化生成成纤维细胞,导致纤维化疤痕生成,从而造成肝损伤。肝纤维化不是一个独立的疾病,是所有慢性肝病的必经过程,可增加肝硬化和肝细胞癌风险[6]。目前肝纤维化对现有药物治疗的反应较差,因此寻找能有效防治肝纤维化的方法,是阻止慢性肝病进一步恶化的重要途径。
研究[5]证实,肝纤维化形成的中心环节是HSCs的活化与增殖,因此抑制HSCs的活化与增殖,在理论上可实现逆转肝纤维化[7]。研究[8-9]表明,血小板衍生生长因子(platelet derived growth factor,PDGF)是目前发现的促HSCs增殖有效的因子,其中PDGF-BB对HSCs的活化作用最强。40 μg/L浓度下PDGF-BB激活的人HSCs(LX-2)细胞状态最接近人体病理发展过程[10],故本实验采用PDGF-BB诱导HSCs活化。配对盒基因6(Pax6)属于配对盒家族,在中枢神经系统和胰腺等发育中起重要作用[11]。有研究[12-13]表明,Pax6不仅促进肿瘤细胞增殖与侵袭,还可调节细胞的分化与周期,推测Pax6可能与HSCs活化存在关联。因此,本研究采用PDGF-BB诱导LX-2细胞活化,慢病毒转染,敲降Pax6,以探究Pax6能否干预治疗肝纤维化。
1 材料与方法
1.1 细胞
LX-2购自复旦IBS细胞中心,培养箱(37 ℃、5% CO2)、培养基(10%胎牛血清+双抗+DMEM-H)内培养,间隔1 d进行细胞换液,3~5 d进行细胞传代。
1.2 主要试剂
DMEM高糖培养基、胎牛血清、胰蛋白酶、青链霉素双抗、0.25%胰酶均购自美国Gibco公司;E-cad及N-cad单克隆抗体购自美国CST公司;PDGF-BB购自美国MCE公司;DAPI、Cy3标记山羊抗兔IgG(H+L)购于北京碧云天生物技术有限公司;Transwell小室购自美国康宁公司;敲降慢病毒pGMLVSC5RNAi购于上海Genomeditech公司。
1.3 细胞株shPax6的构建
细胞汇合度达90%时,接种于24孔板中培养,等到细胞生长达到50%后,按慢病毒说明书加入慢病毒,分为4组:shNC+PBS组、shPax6+PBS组、shNC+PDGF-BB组、shPax6+PDGF-BB组。观察感染率,待细胞表达绿色荧光达到60%时,更换新培养基。正常LX-2细胞接种于24孔板,选择浓度为1、2、5、100 mg/L的嘌呤霉素处理,观察统计细胞死亡率,选择72 h下能完全杀死细胞的浓度(5 mg/L)作为筛选浓度。嘌呤霉素筛选浓度处理已转染的细胞,培养72 h后,显微镜下观察到细胞均表达绿色荧光蛋白的稳转细胞株后,更换新培养基,进行传代培养,提取相关蛋白,进行后续实验。
1.4 PDGF-BB处理细胞及分组
生长对数期生长的细胞,加胰酶消化后,终止消化,将细胞悬液分为4组:shNC+PBS组、shPax6+PBS组、shNC+PDGF-BB组、shPax6+PDGF-BB组,采用40 μg/L PDGF-BB处理细胞24 h,进行后续实验。
1.5 细胞划痕实验
生长对数期的细胞用胰酶消化后,培养基中和消化,新加1 mL培养基重悬,配置成悬浮液,血球计数板计数,以6×105个/孔的密度接种于6孔板,培养箱培养过夜。细胞长满约85%时,用无菌尺辅助,枪头在每孔内划痕,PBS溶液清洗未贴壁以及划落细胞,显微镜拍照记录。慢病毒转染后的细胞分为4组,40 μg/L PDGF-BB处理24 h后,镜下观察划痕宽度。
1.6 Transwell 实验
细胞培养在24孔板中,每孔密度为5×104个/孔,接种于Transwell小室。细胞培养过夜后,40 μg/L PDGF-BB处理24 h,取出小室,弃培养基,加入PBS清洗,固定,结晶紫染色,PBS清洗。镜下观察拍照并记录。
1.7 蛋白质印迹技术实验
将处理好的4组细胞培养至汇合度为90%,适量的细胞裂解液裂解细胞,收集的蛋白用BCA法测定。蛋白样品加入上样孔,进行电泳实验,浓缩胶90 V持续20 min,分离胶120 V持续40 min。电泳完毕,转膜90 min。转膜后,5%脱脂牛奶,室温封闭1 h。4 ℃孵育一抗过夜,TBST洗膜5 min×3次,二抗室温孵育1 h,TBST洗膜5 min×3次。曝光,检测蛋白表达。
1.8 细胞免疫荧光实验
细胞培养24孔板,爬片处理后,4%多聚甲醛固定,PBS漂洗;0.1%的Tritonx-100处理15 min;PBS漂洗,5%山羊血清封闭1 h,4 ℃孵育一抗过夜;PBS漂洗细胞;荧光二抗Cy3标记的山羊抗兔IgG(H+L),37 ℃下避光孵育1 h,PBS漂洗;DAPI染5 min,PBS漂洗3次;捞出爬片,封片,荧光显微镜观察采集,全程在暗室下进行实验。
1.9 统计学方法

2 结果
2.1 慢病毒构建 shPax6 细胞
采用慢病毒构建LX-2细胞,设计目标序列(5′-GCAGACGGCATGTATGATA-3′)插入pGMLV-SC5RNAi慢病毒载体;同时,随机采用一个shRNA作为阴性对照(shNC);慢病毒感染48 h后,在荧光显微镜下,明显观察到绿色荧光蛋白的表达,表明慢病毒感染的shNC、shPax6细胞株为稳转细胞株(图1)。
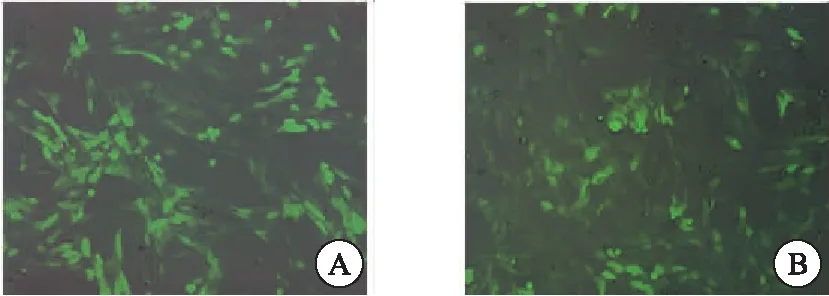
图1 慢病毒构建shPax6细胞(400×)
2.2 Pax6对PDGF-BB刺激后HSCs划痕的影响
划痕实验结果显示,敲降Pax6后对LX-2的迁移能力无影响;加入PDGF-BB后能激活正常LX-2,使其具有趋化性,敲降Pax6后发现细胞的迁移能力受到一定抑制(图2)。

图2 Pax6对PDGF-BB刺激后HSCs划痕的影响
2.3 Pax6对HSCs迁移的影响
Transwell实验结果表明,PDGF-BB激活后的LX-2细胞迁移能力增强,但是敲降Pax6后能明显减少有迁移能力的细胞(表1、图3)。
表1 shPax6处理下的LX-2各组细胞迁移数目

图3 Pax6对HSCs迁移的影响(100×)
2.4 Pax6对活化HSCs相关蛋白的影响
蛋白质印迹技术实验检测细胞转移的重要标志物:E-钙黏蛋白(E-cadherin,E-cad)、神经型钙黏附蛋白(N-cadherin,N-cad)[14]。结果显示,PDGF-BB活化后的细胞中,E-cad表达增加,N-cad表达降低;敲降Pax6后能明显减少N-cad表达,增加E-cad表达。免疫荧光实验发现,在PDGF-BB激活下,LX-2细胞Vimentin表达增加,敲降Pax6能抑制PDGF-BB诱导的Vimentin表达(表2~3、图4~5)。
表2 shPax6处理下的LX-2各组N-cad蛋白表达情况
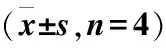
表3 shPax6处理下的LX-2各组E-cad蛋白表达情况
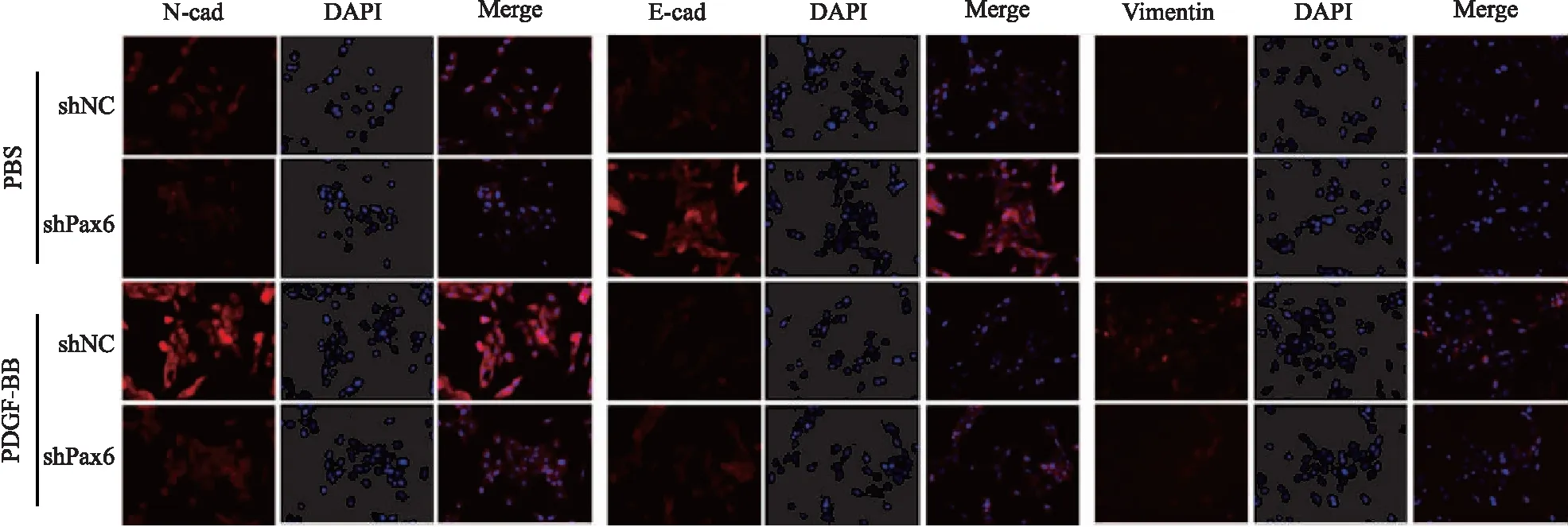
图4 Pax6对活化的HSCs免疫荧光检测(400×)
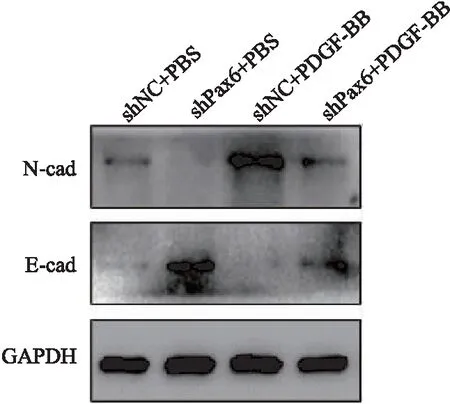
图5 Pax6对活化的HSCs相关蛋白的影响
3 讨论
肝纤维化是一种常见的慢性肝病[15],其患病率高,但治疗策略有限。目前肝纤维化尚无确切的治疗方法,且会发展为难治愈的肝硬化,甚至是肝癌。
LX-2是被永生化的人HSCs株,保留了HSCs的大部分特性,因此更接近人体生理条件下的细胞[16]。Pax6是PAX基因家族中的一个重要成员,在进化过程中高度保守,是关键细胞周期调节因子[13]。有研究[17]表明,HSCs活化过程常伴有迁移能力增加。因此,抑制迁移能力成为本研究的重点,是有效抑制肝纤维化加重,乃至逆转肝纤维化的重要靶点。为此,本研究采用PDGF-BB诱导LX-2活化,活化后其迁移能力增强;但使用慢病毒转染细胞,敲降Pax6后,发现LX-2的迁移能力受到一定限制。该结果表明,Pax6能明显抑制LX-2迁移能力,进而减缓或(和)抑制纤维化进程。研究[17]表明,HSCs活化是导致肝纤维化的必要环节,其特征为细胞增殖能力增强,而敲除Pax6能够抑制HSCs增殖,与本研究结果一致。
为进一步验证Pax6对HSCs活化后迁移能力的抑制作用,本研究采用蛋白质印迹技术实验及免疫荧光实验检测,结果表明活化后的LX-2中E-cad表达增加,而N-cad表达降低;敲降Pax6结果与上述相反,进一步表明Pax6可抑制PDGF-BB刺激导致的HSCs迁移能力增强。已知Pax6能调节多种生物发育,包括细胞增殖、凋亡、迁移和分化,并影响细胞周期[18]。有研究[19]报道,Hedgehog信号通路是正常胚胎发育所必需,且在组织维持、更新和再生过程中发挥关键作用。研究[20]认为,肝纤维化发生发展过程中,Hedgehog信号通路的异常激活是导致HSCs激活的关键因素,表明Pax6和Hedgehog之间存在密切关联,可能会激活Hedgehog信号通路,使得静态HSCs发生激活和增殖。由此推测,Pax6能够活化Hedgehog信号通路,以介导HSCs的活化与迁移能力。
综上所述,敲降Pax6能够抑制HSCs的迁移能力,可能通过激活Hedgehog信号通路发挥作用,表明Pax6可能是抑制肝纤维化发展病变中的关键治疗靶点。目前对于Pax6激活Hedgehog信号通路的机制还需进一步研究。本研究不足之处在于未进行Pax6的过表达,以及其相关通路的深入研究,今后研究中需进一步探讨。