基于网络药理学及细胞验证探讨肉桂油的抗肿瘤作用研究
★ 蒋且英 杨慧 徐希强 黄小英 梁新丽(.江西中医药大学实验动物科技中心 南昌 330004;.江西中医药大学现代中药制剂教育部重点实验室 南昌 330004)
肉桂是樟科植物肉桂CinnamomumcassiaPresl的干燥树皮。其味辛、甘,大热,归肾、脾、心、肝经,具有补火助阳、引火归元、散寒止痛、温通经脉等功效,用于阳瘘宫冷、腰膝冷痛、肾虚作喘、虚阳上浮、眩晕目赤、心腹冷痛、虚寒吐泻、寒疝腹痛、痛经闭经[1]。其主产于广西、广东等湿热地区,《神农本草经》将其列为上品,记载为“味辛,主百病,养精神,和颜色,利关节,补中益气,为诸药先聘通使,久服通神,轻身不老”,对心血管系统、消化系统等具有保护作用。其作为香料与药物的应用历史悠久,已有2 000多年的临床应用,目前在医药、化工、食品、化妆品等方面均有广泛的应用[2]。
肉桂含有挥发油、萜类、多酚类、糖苷类等成分,其中挥发性为主要活性成分。肉桂油(CEO)药理作用广泛,主要表现为扩张血管、抗胃溃疡、抑菌、抗氧化等方面[3]。近年,文献报道了挥发油中的桂皮醛具有抗肿瘤作用[4],但因肉桂油是多种成分的混合物,其余成分或整体挥发油的抗肿瘤作用尚不清楚。鉴于网络药理学能够通过对“药物-疾病-靶点-通路”等复杂生物信息网络关系的分析从理论上揭示药物分子的药理作用和作用机制。因此,本文利用网络药理学挖掘肉桂油抗肿瘤的主要活性成分及其作用靶点,并通过细胞实验验证肉桂挥发油的抗肿瘤作用。
1 材料和方法
1.1 数据库与分析软件
PubChem数据库(有机小分子生物活性数据库,https://pubchem.ncbi.nlm.nih.gov/);SwissADME数据库(小分子药代动力学数据库,http://www.swissadme.ch/);Swiss TargetPrediction(小分子靶点预测数据库,http://www.swisstargetprediction.ch/);Uniprot数据库(蛋白质数据库,https://www.uniprot.org);Genencards数据库(人类基因数据库,https://www.genecards.org/);STRING数据库(功能性蛋白质关联网络数据库,https://ctdbase.org/);DAVID Bioinformatics Resources 6.8数据库(生物学信息注释数据库,http://david.ncifcrf.gov/);Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html);Cytoscape 3.8软件等。
1.2 细胞株
MDA-MB-231、MCF-7、A549、Hep G2细 胞均购自中国科学院细胞库。
1.3 仪器与试药
VS-840-1超净工作台(上海博讯实业有限公 司);C170 CO2培养箱(德国Binder公 司);Varioskan Flash 3001全波长多功能酶标仪(赛默飞世尔科技有限公司);流式细胞仪(型号MoFlo XDP,贝克曼库尔特商贸有限公司);DMEM高糖培养基(批号20211014,索莱宝生物科技有限公司);噻唑蓝(MTT,北京索莱宝科技有限公司,20200720);DMSO(批号1209M032,索莱宝生物科技有限公司);胎牛血清(赛默飞世尔科技有限公司,批号2152050CP);LDH 细胞毒性检测试剂盒(批号042821211012,上海碧云天生物技术有限公司);Annexin-FITC 细胞凋亡检测试剂盒(批号021921210512,上海碧云天生物技术有限公司);肉桂油(自制)。
2 方法
2.1 肉桂挥发油化学成分收集与活性成分筛选
从近十年的主要国内外期刊查找与肉桂油成分相关的文章,归纳出肉桂油中大于0.5%的成分,并通过Pubchem数据库获得相关化合物的2D.sdf结构图,利用Swiss ADME数据库对收集的肉桂油的化学成分进行预测,筛选出胃肠道吸收度高,与类药性好的活性成分。
2.2 肉桂油成分-靶点网络构建
使用Swiss Target Prediction数据库对肉桂油中的活性成分进行靶点预测[5],得到靶蛋白对应靶基因的规范名称,并从得到的靶基因进行筛选,筛选条件为Probability*>0.1,通过Genecards数据库查找肿瘤疾病的靶点基因规范名称[6],利用Venny 2.1得到肉桂油和肿瘤靶点的交集,将肉桂油成分-抗肿瘤靶点关联信息上传到Cytoscape 3.8.1软件,构建肉桂油成分-潜在抗肿瘤靶点网络[7]。
2.3 GO富集和KEGG通路注释分析
采用 DAVID v6.8 数据库对上述筛选出的抗肿瘤靶点进行GO(gene ontology)富集分析和KEGG通路注释分析,将所得结果设置P<0.05 作为显著性强的临界值进行筛选,将主要参数 count 值降序、次要参数P值升序排列得到结果[8-9]。并通过 Cytoscape 3.8.1 软件的Merge功能构建肉桂油抗肿瘤的“核心成分-核心靶点-核心通路”网络图,研究肉桂油抗肿瘤多成分、多靶点、多通路的作用[10]。
2.4 肉桂油对MDA-MB-231、MCF-7、A549、Hep G2细胞增殖的影响
2.4.1 MTT法检测CEO对肿瘤细胞活力影响 将对数生长期细胞,以5×104/孔细胞密度接种于96孔板,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h后,弃去培养上清液,分别加入系列浓度的肉桂油,每个浓度设置5个复孔。另设不加药物的细胞正常对照组以及5‰的DMSO溶剂组。药物24 h后,弃去培养上清液,Hank's液洗细胞3次,按照MTT细胞增殖及细胞毒性检测试剂盒说明书加入MTT溶液50 μL,37 ℃、5% CO2继续培养4 h,弃去MTT溶液,加入150 μL的DMSO,在平板摇床避光摇匀,在酶标仪上测定波长490 nm处的吸光值(A),根据吸光度计算细胞增殖抑制率(%)。
2.4.2 LDH释放实验吸取对数生长期的MDAMB-231,分别设置系列浓度梯度的CEO,每个浓度设置5个复孔。于37 ℃、5%CO2的培养箱中培养24 h后,吸除含药物培养基,加入150 μL用PBS稀释了10倍的试剂盒提供的LDH释放试剂(10体积PBS中加入1体积 LDH释放试剂并混匀),适当摇晃混匀,然后继续在细胞培养箱中孵育1 h。离心后,分别取各孔上清液120 μL,加入到一新的96 孔板相应孔中,并在各孔分别加入60 μL LDH检测工作液,混匀,25 ℃避光孵育 30 min,以检测波长为490 nm的吸光度(OD值)为纵坐标,LDH酶活力(mU)为横坐标,绘制LDH标准曲线。
2.4.3 细胞凋亡研究吸取对数生长期的MDAMB-231,设置空白对照组、不同浓度梯度的CEO组,每组样品设置3个复孔。于37 ℃、5%CO2的培养箱中培养24 h后,吸除含药物培养基,加入适量胰酶细胞消化液,吹打细胞并收集,用PBS重悬细胞并计数,按照Annexin V-FITC细胞凋亡检测试剂盒说明书制备待测样品,随后用流式细胞仪进行检测。
3 结果
3.1 肉桂挥发油化学成分收集与活性成分筛选
从近年来的国内外文献中共查询到的肉桂油化学成分有近百种之多,而通过SwissADME数据库对收集的肉桂油的化学成分进行筛选,筛选出胃肠道吸收度高,药物相似性好的活性成分。见表1。
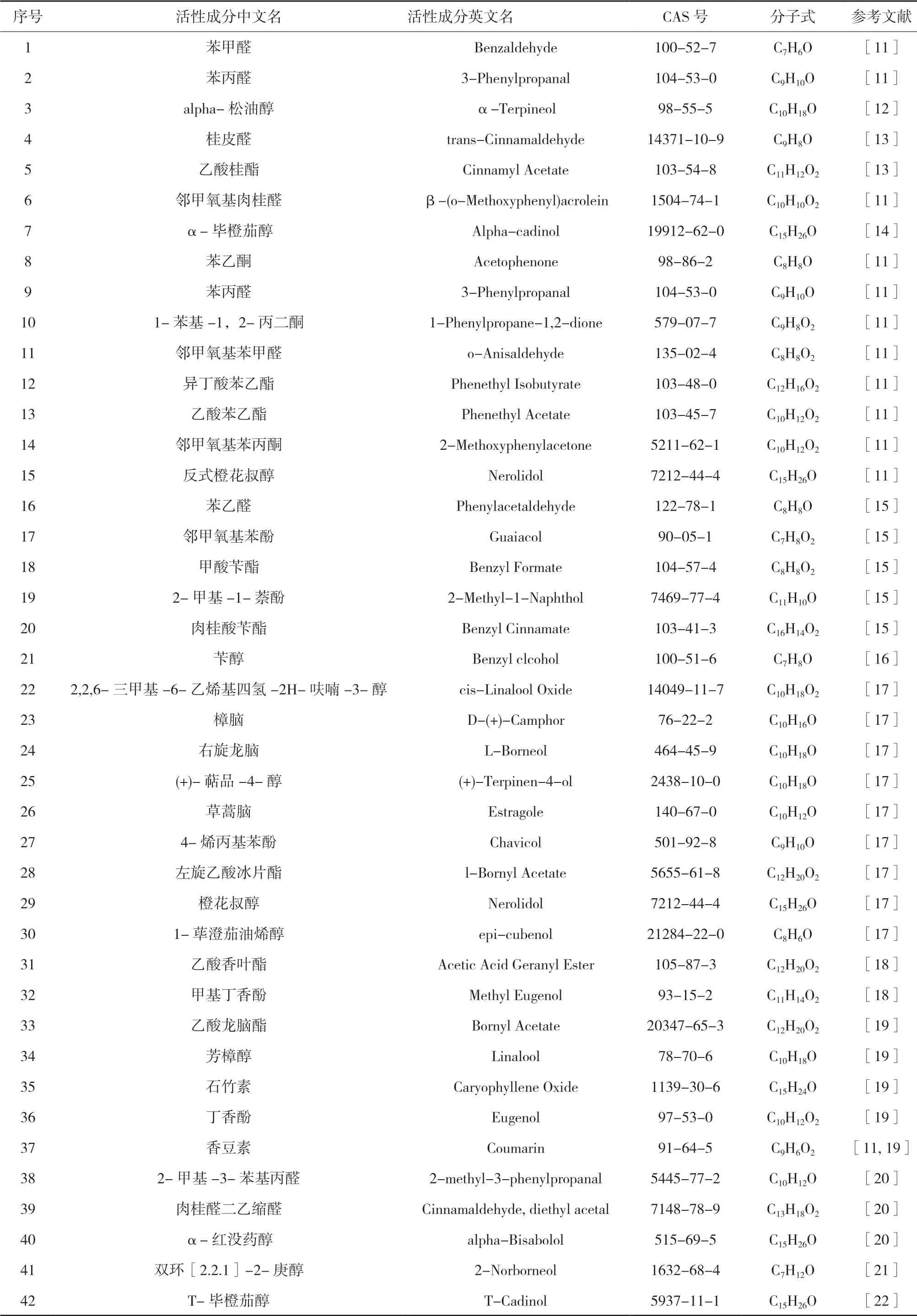
表1 肉桂油主要活性成分参数
3.2 肉桂活性成分潜在抗肿瘤作用靶点筛选与网络构建分析
将得到的肉桂油靶点信息与Genencards数据库中抗肿瘤药物的靶点对比分析,得到56个潜在作用靶点,结果见图1。其中乙酰胆碱酯酶(Acetylcholinesterase,ACHE)、雄激素受体(Androgen receptor,AR)、毒蕈碱型乙酰胆碱受体M2(Muscarinic acetylcholine receptor M2,CHRM2)、代谢型谷氨酸受体5(Metabotropic glutamate receptor 5,GRM5)、糖皮质激素受体(Glucocorticoid receptor,NR3C1)、钠依赖性血清素转运蛋白(Sodiumdependent serotonin transporter,SLC6A4)、丝 裂 原活 化 蛋 白 激 酶8(Mitogen-activated protein kinase 8, MAPK8)、聚[ADP-核糖]聚合酶1(Poly [ADPribose] polymerase 1,PARP1)、酪 氨 酸蛋 白 激 酶JAK2(Tyrosine-protein kinase JAK2,JAK2)等 频率较高,可能是肉桂油发挥抗肿瘤作用主要的活性成分潜在靶点。
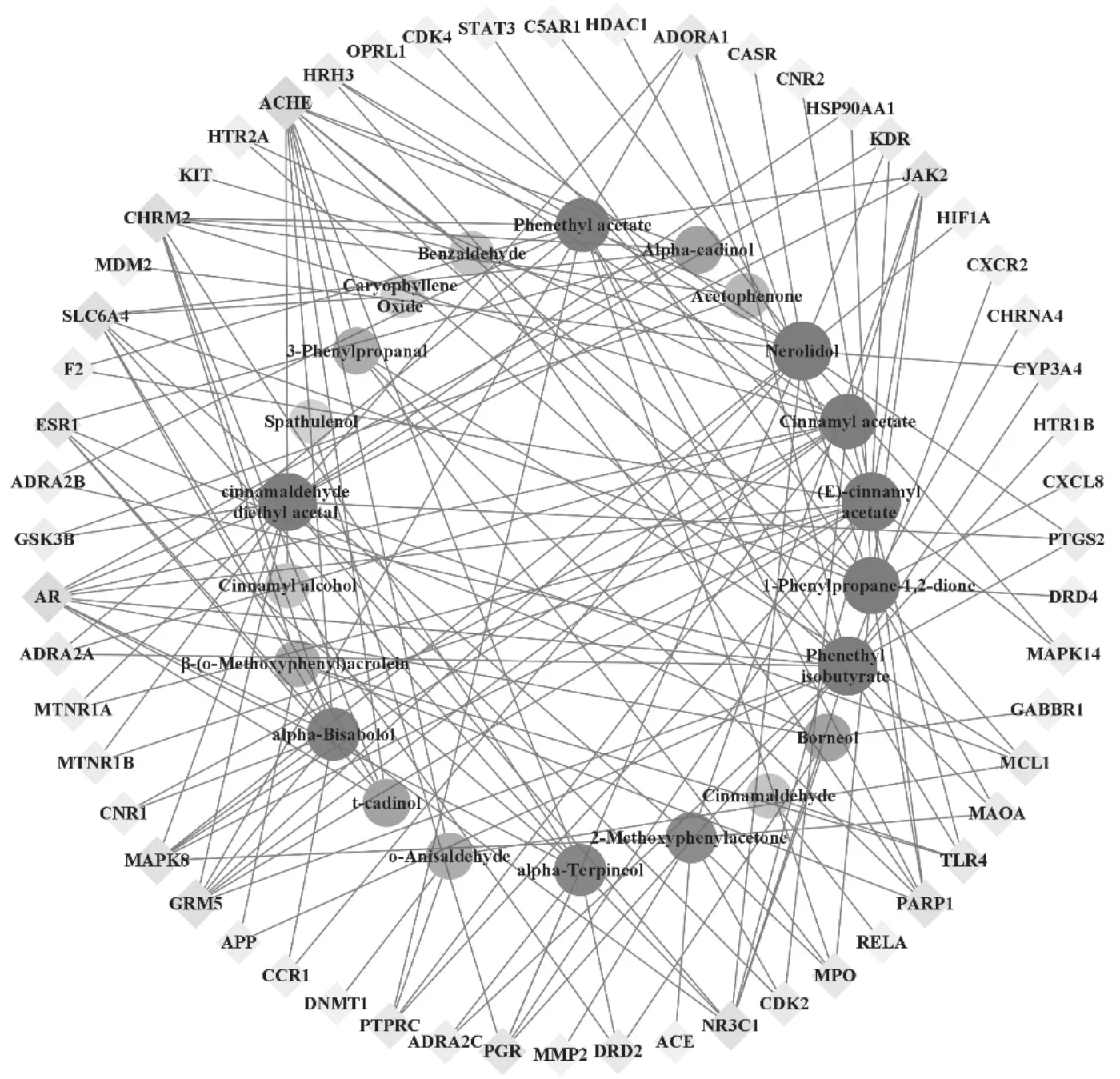
图1 肉桂油活性成分-潜在抗肿瘤靶点网络图
运用 Cytoscape 3.8.1软件将筛选出的22个活性成分和上述靶点相连构建“活性成分-靶点”网络图,共包含78个节点(22个活性成分和56个潜在靶点)和165条边。通过网络分析,多数活性成分能与多个靶点之间发生相互作用,以拓扑参数度值中位数为重要参数。以大于中位数为重要节点、大于2倍中位数为关键节点作为评价标准,结果见表2。结果显示:活性成分中以异丁酸苯乙酯、乙酸肉桂酯、反式橙花叔醇的网络度最大,能同时作用于16个靶点发挥生物学活性,其次为肉桂醛二乙缩醛、1-苯基-1,2-丙二酮、乙酸肉桂酯这些靶点较多的成分可能在肉桂油抗肿瘤中起关键作用。在预测的靶点中,ACHE的网络度最大,能同时与12种活性成分发生作用,其次是AR、CHRM2、GRM5、NR3C1、SLC6A4、MAPK8、PARP1、JAK2,这些可能是肉桂油发挥整体药效作用的关键靶点。
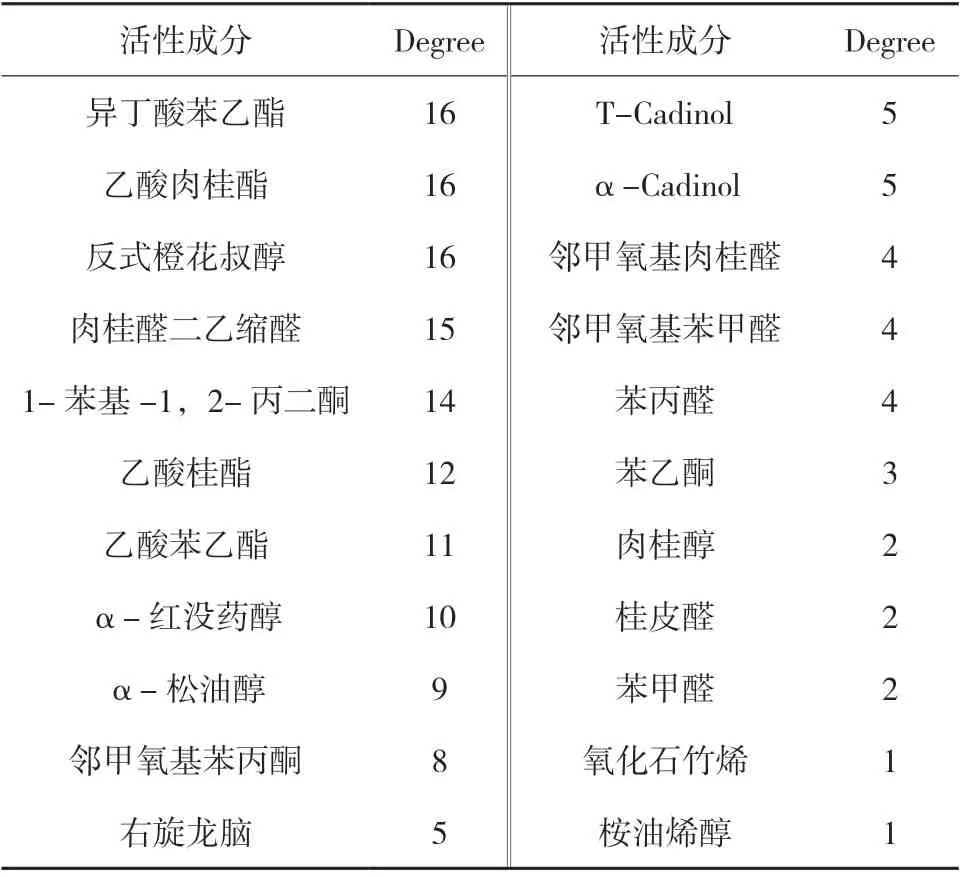
表2 肉桂油抗肿瘤主要活性成分的网络度
3.3 GO富集分析
将56个潜在靶点导入DAVID数据库进行GO富集分析,包括生物过程(Biological Process)、细胞组分(Cellular Component)和分子功能(Molecular Function)3个部分。通过GO富集分析发现,预测靶点在生物过程中,主要与细胞增殖的负调控(negative regulation of cell proliferation)、凋亡过程的负调控(negative regulation of apoptotic process)、RNA聚合酶II启动子转录的正调控(positive regulation of transcription from RNA)等有关;在细胞组分中,主要集中在细胞膜(Cell membrane)、细胞质(cytoplasm)和细胞核(nucleus)等区域;在分子功能中,主要与转录因子活性(transcription factor activity)作用、锌离子结合(zinc ion binding)作用等有关。见图2。

图2 肉桂油抗肿瘤靶点的GO富集分析
3.4 KEGG 通路注释分析
对KEGG通路分析得到的结果进行筛选分析,共获得54条重要信号通路,根据显著性程度P<0.05,筛选出前20条相关通路,主要包括神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、癌 症 通 路(pathways in cancer)、催 乳 素 信 号 通 路(Prolactin signaling pathway)、磷脂酰肌醇-3激酶-丝氨酸苏氨酸蛋白激酶信号通路(PI3K-Akt signaling pathway)等。见图3。
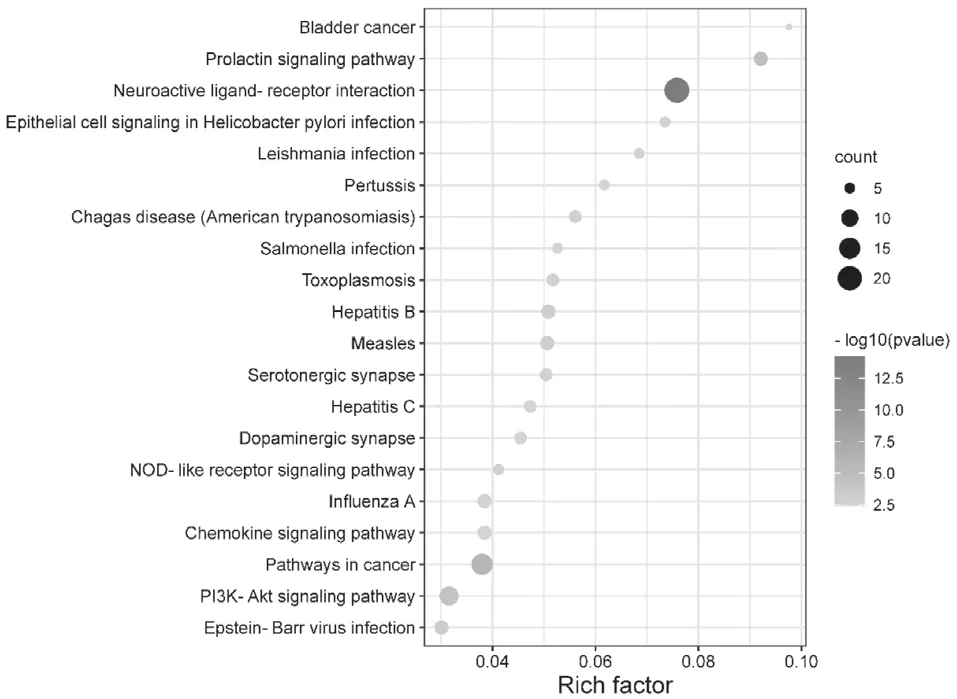
图3 肉桂油抗肿瘤作用靶点的KEGG通路富集分析
3.5 核心成分-核心靶点-核心通路网络的构建
将与靶点关联性最高的6个核心成分,-lg(P value)值较高的20条通路49个靶点,采用 Cytoscape 3.8.1软件的Merge功能构建肉桂油抗肿瘤的“核心成分-核心靶点-核心通路”网络模型,结果见图4,其中外圈代表潜在靶点,内圈代表化学成分,中间圈代表有关通路。肉桂油抗肿瘤主要活性成分的作用靶点分布于不同的代谢通路,相互协调、共同调节肉桂油抗肿瘤的作用机制。
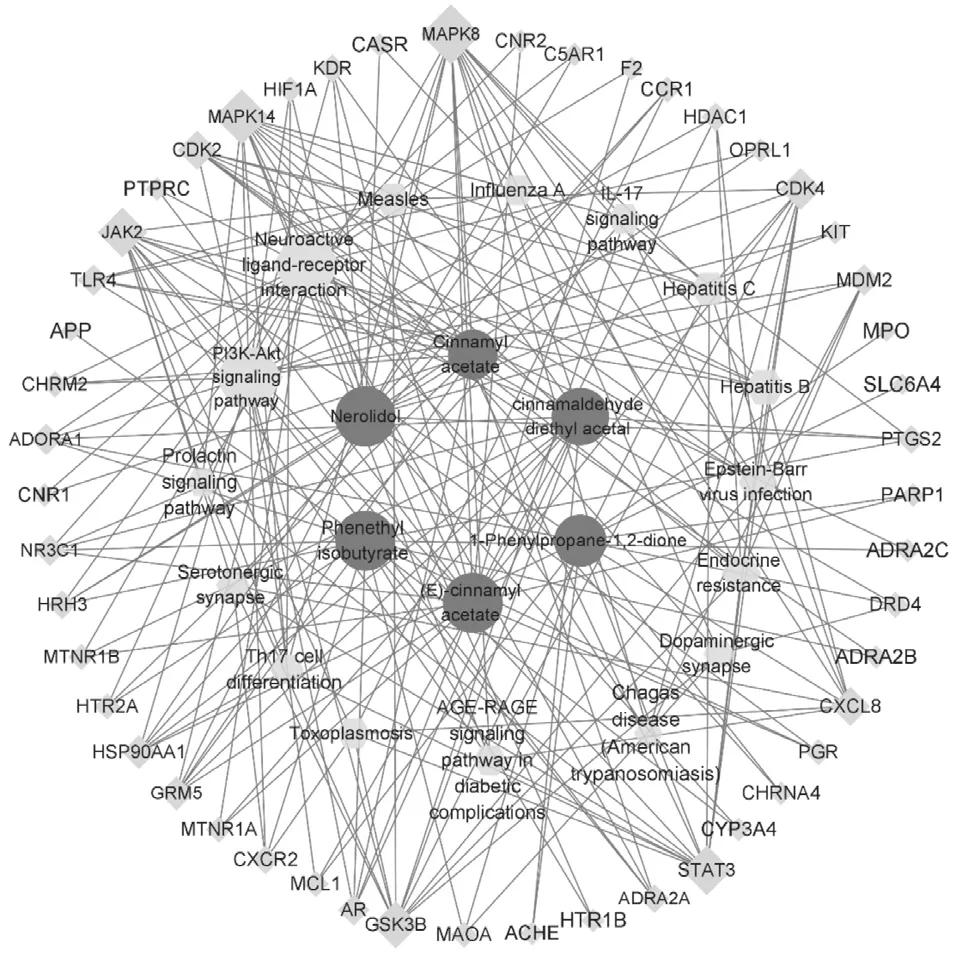
图4 肉桂油抗肿瘤靶点的核心成分-核心靶点-核心通路网络
3.6 肉桂油对肿瘤细胞抑制作用验证结果
3.6.1 MTT法检测CEO对肿瘤细胞活力影响根据吸光度计算细胞增殖抑制率及IC50值,结果见表3、图5。由表3可知,肉桂油对MDA-MB-231、MCF-7、A549、Hep G2 4种肿瘤细胞均存在抑制作用,其中对MDA-MB-231的抑制作用优于MCF-7、A549、Hep G2细胞。鉴于肉桂油对MDA-MB-231的抑制作用较好,故进一步用乳酸脱氢酶(LDH释放)和流式细胞法验证CEO对该肿瘤细胞的抑制作用。
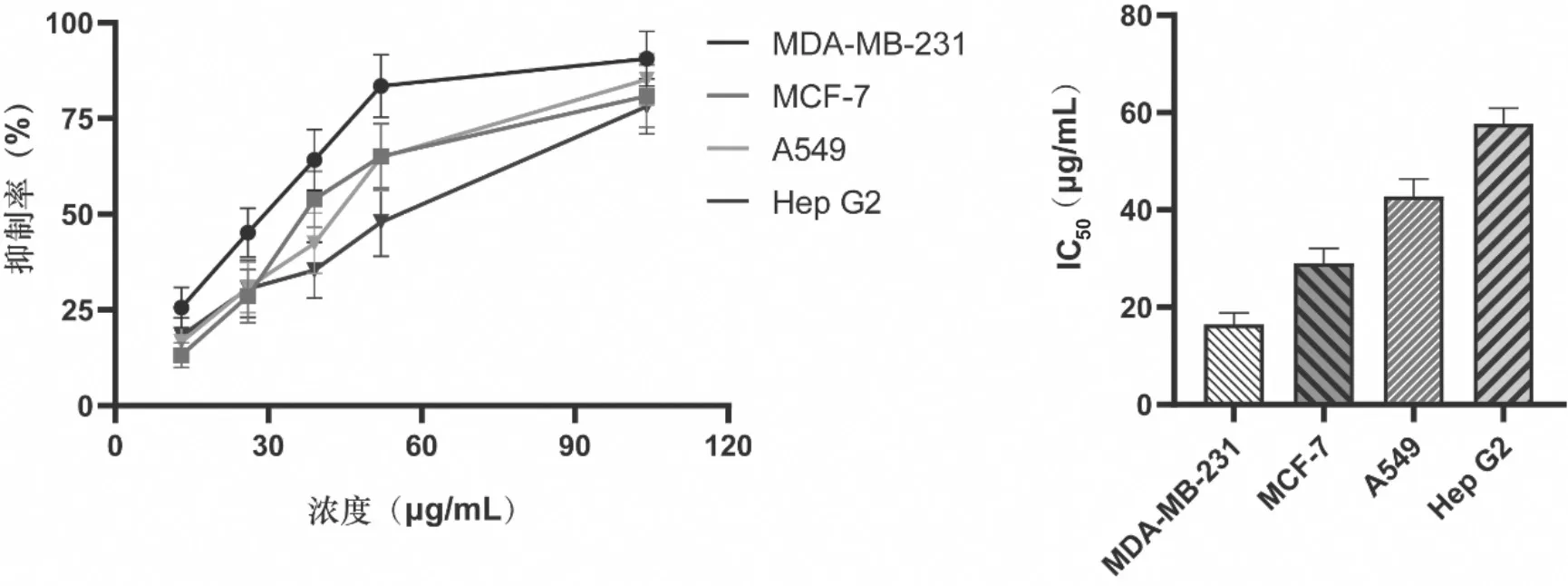
图5 肉桂挥发油对不同肿瘤细胞增殖的影响( ±s,n=5)
表3 MTT法检测CEO对不同肿瘤细胞IC50( ±s,n=5)

表3 MTT法检测CEO对不同肿瘤细胞IC50( ±s,n=5)
肿瘤细胞 IC50/(μg·mL-1)MDA-MB-231 25.24±3.31 MCF-7 37.02±3.05 A549 42.77±3.61 Hep G2 57.68±3.22
3.6.2 LDH释放法检测MDA-MB-231细胞活力绘制LDH标准曲线为Y=1 483.3X+97.861(R2=0.998 5),计算细胞体系中的LDH酶活力,结果见图6。结果显示随着CEO浓度的增加,MDA-MB-231细胞释放LDH的量也逐渐上升,不同浓度的肉桂油组别与空白对照组均有显著性差异,当CEO浓度为52.04 μg/mL时,释放LDH为(855.19±19.50)mU,分析CEO可能破环了细胞的膜结构,进而抑制细胞的增殖。
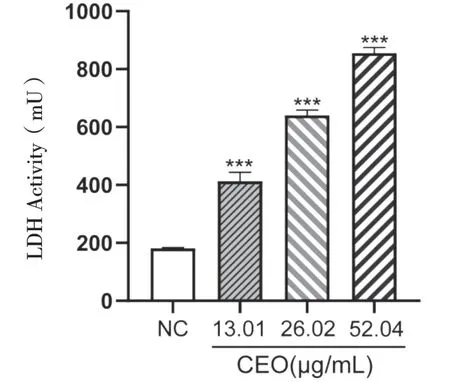
图6 LDH释放法检测MDA-MB-231细胞活力( ±s,n=5)
3.6.3 流式细胞法研究CEO对MDA-MB-231细胞凋亡的影响利用流式细胞仪和Annexin V-FITC法检测CEO对MDA-MB-231细胞凋亡率的影响,结果见图7。结果显示,不同浓度的CEO组均会引起MDA-MB-231细胞发生凋亡,且凋亡率随浓度的上升而增加,与空白对照组(1.23±0.15)%的凋亡率相比,浓度为52.04 μg/mL CEO组引起MDA-MB-231细胞凋亡达到了(29.1±1.3)%(P<0.01)。
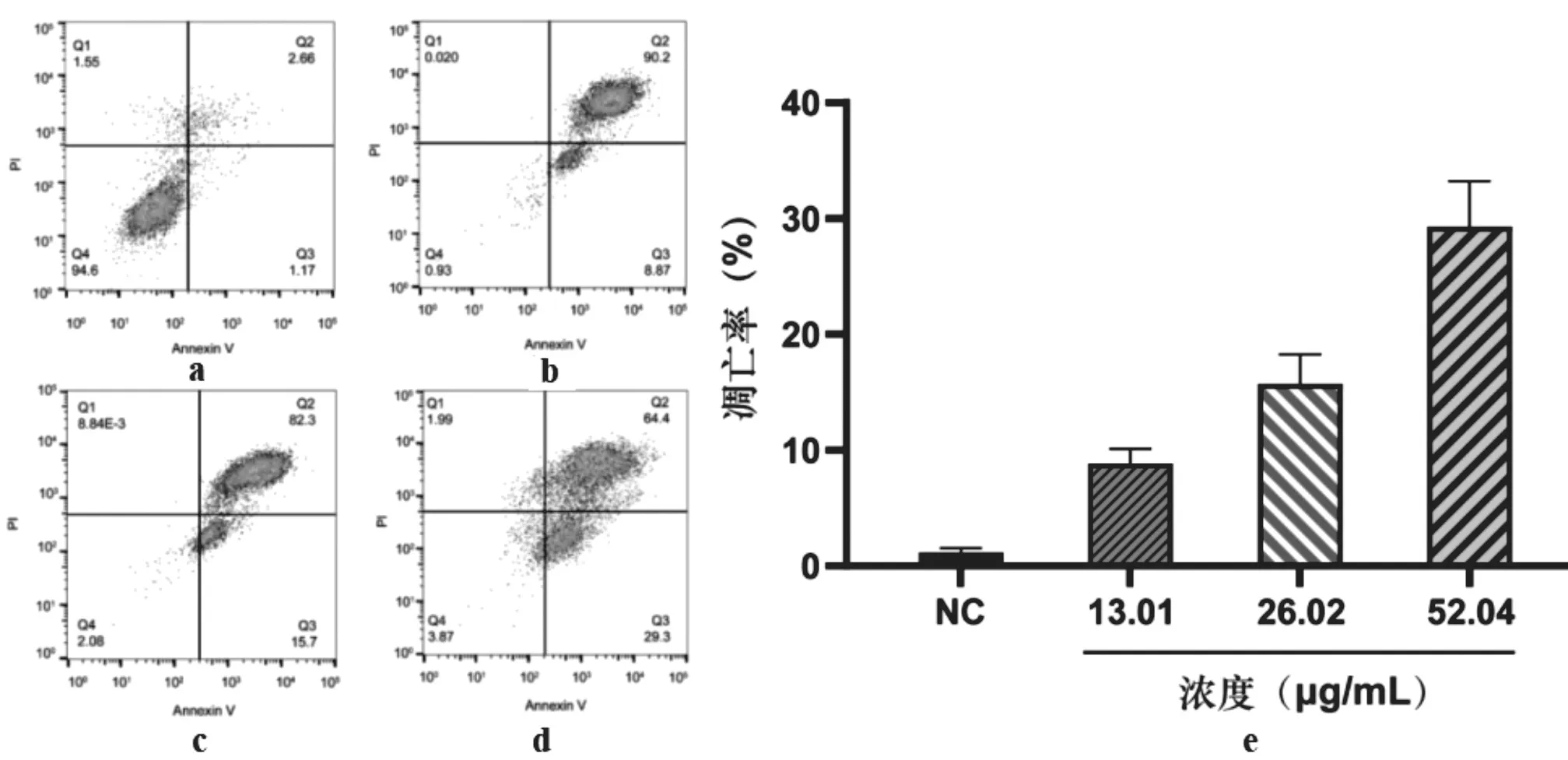
图7 CEO对MDA-MB-231细胞凋亡的影响( ±s,n=3)
4 讨论
为了明确肉桂油是否存在抗肿瘤作用及其可能的物质基础和作用机制,本文利用网络药理学可以较为系统地揭示中药的活性成分和效应机制的原理,采用网络药理学对肉桂油的主要活性成分、抗肿瘤作用靶点、相关生物信号通路进行探讨。结果从肉桂油中筛选得到22个主要活性成分,56个抗肿瘤作用靶点,其中有6个活性成分,即异丁酸苯乙酯、乙酸肉桂酯、反式橙花叔醇、肉桂醛二乙缩醛、1-苯基-1,2-丙二酮、乙酸桂酯与20条重要信号通路的49个核心靶点存在关联,提示肉桂油可能有抗肿瘤作用。细胞实验MTT法验证了肉桂油对MDAMB-231、MCF-7、A549、Hep G2 4种肿瘤细胞存在抑制作用, LDH释放法和流式细胞法进一步证实了CEO对MDA-MB-231存在抑制作用,结果初步揭示了肉桂油抗肿瘤作用的物质基础及可能的机制。

