MRI纹理分析和LI-RADS分类鉴别诊断肝硬化小肝癌与不典型增生结节的价值比较
姚纯,邓君良,杨志企,陈湘光
肝细胞癌(hepatocellular carcinoma,HCC)是常见恶性肿瘤,死亡率高,接近90%的HCC患者伴有肝硬化[1]。早期诊断HCC对改善患者的预后生存具有重要临床意义。依据美国肝病学会(American Association For The Study of Liver Diseases,AASLD)的HCC诊断标准,对于直径大于2 cm的肝硬化结节,在CT和MRI动态增强图像上表现为“快进快出”的强化特点时即可诊断为HCC。依据此征象诊断HCC的特异度接近100%,但敏感度仅约60%[2-3]。
为了使肝脏影像诊断报告术语化及标准化,2014年美国放射学协会制定了肝脏影像报告和数据系统(Liver Imaging Reporting and Data System,LI-RADS)。近年来,LI-RADS广泛应用于HCC高危患者肝结节的诊断。LI-RADS标准先基于基本征象进行判别,在增加辅助特征后,可对LI-RADS分级进行调整,以提高诊断信心及准确性[4-5]。然而,利用LI-RADS鉴别诊断肝硬化结节的良、恶性仍然具有挑战性,而且对影像特征的判别还受到观察者经验及主观因素的影响;因此,有待寻求一种无创和定量的新方法来进一步提高对肝硬化结节鉴别诊断的准确性。
纹理分析(texture analysis,TA)通过提取医学图像中大量肉眼无法识别的微观信息,表征肿瘤内部的异质性,为肿瘤的良恶性鉴别提供了新思路。目前,基于MRI的纹理分析已用于乳腺、前列腺结节的良、恶性的鉴别诊断[6-7]。TA在肝结节诊断中的应用也有一些研究报道,如有文献报道基于脂肪抑制T2WI的纹理分析鉴别肝硬化背景下小肝癌(small HCCs,sHCCs)与增生结节的效能显著优于MRI动态增强扫描[8]。目前,基于MRI的TA对LI-RADS分类鉴别肝硬化结节的附加价值尚不明确。本研究拟比较MRI纹理分析和LI-RADS 鉴别诊断肝硬化背景下sHCCs与良性结节的价值。
材料与方法
1.研究对象
回顾性分析2015年10月-2018年4月在本院经手术或穿刺活检病理证实的肝硬化结节患者的MRI和临床资料。病例纳入标准:①肝硬化患者,至少有1个肝结节且最大结节直径≤3 cm,病理证实为sHCCs或不典型增生结节(dysplastic nodules,DNs);②有术前或穿刺前MR影像资料;③术前(或穿刺前)未进行任何治疗;④图像无明显伪影。共将65例患者纳入本研究,包括sHCCss 46例和DNs 15例,4例患者同时合并sHCCs和DNs;共78个病灶,包括sHCCs 56个和DNs 22个。
2.MRI检查方法
使用Siemens Magnetom Skyra 3.0T磁共振扫描仪和体部相控阵线圈。平扫序列包括横轴面双回波T1WI和脂肪抑制T2WI。动态增强扫描采用三维高分辨各向同性容积T1WI,扫描参数:TR 3.0 ms,TE 1.8 ms,层厚5.0 mm,层间距2.0 mm,矩阵256×256,视野40 cm×38 cm。对比剂采用Gd-DTPA(33例)或Gd-EOB-DTPA(32例),注射流率2.0 mL/s,剂量0.1 mL/kg,行动脉期(延迟时间18~30 s)、静脉期(延迟时间50~60 s)、平衡期(延迟时间约3 min)及肝胆期(延迟时间约20 min;Gd-EOB-DTPA增强)扫描。DWI采用平面回波成像序列,扫描参数:b=0、800 s/mm2,TR 1600.0 ms,TE 70.0 ms,视野40 cm×36 cm,层厚5.0 mm,间隔1.0 mm,矩阵112×1112,激励次数2。扫描完成后经重建获得ADC图像。
3.LI-RADS评估
依据LI-RADS V2018的分类标准,由两位分别具有8和10年肝脏疾病诊断经验的医师采用盲法共同评判肝结节的MRI征象,通过协商达成共识。首先依据动态增强图像上的基本征象,对每个肝结节进行LI-RADS分类。基本征象包括5个,即动脉期强化、病灶大小、强化包膜、门脉或延迟期“流出”及阈值增长(≤6个月,大小增加≥50%)[4]。然后,依据辅助征象,可对评分进行修改,为保证诊断特异性,LI-RADS标准不允许LR-4向LR-5调整;LI-RADS标准允许观察者根据实际情况自行选取辅助征象,为减少观察者间的偏倚,本研究选取支持HCC诊断的辅助征象有4个,包括T2WI稍高信号、T1WI低信号、扩散受限和肝胆期低信号(Gd-EOB-DTPA增强扫描)[5]。最后,取基本征象联合辅助征象确定的LI-RADS分类进行统计分析。
4.图像纹理分析及影像组学标签构建
本研究中采用横轴面T2WI图像进行纹理分析。
在PACS工作站上将T2WI序列的图像以保存为DICOM格式,调整图像的窗宽和窗位,使所有图像保持一致。选择结节显示最大径层面的MRI图像导入MaZda 4.6软件(http://www.eletel.p.lodz.pl/mazda/)。在纹理特征提取前,先进行图像灰度的标准化处理,灰度控制在μ±3σ水平。然后,由一位具有10年诊断经验的放射科医师沿病灶边缘绘制ROI(图1),软件自动提取6类共279个纹理特征,其中包括直方图特征9个、灰度共生矩阵特征220个、游程检验特征20个、小波转换特征20个、绝对梯度特征5个及自回归模型特征5个[8]。随后,联合3种纹理选择方法共筛选出30个最具鉴别诊断价值的纹理特征子集,3种纹理选择方法分别为交互信息、Fisher系数及分类错误概率联合平均相关系数。基于筛选出的30个定量纹理特征,采用多因素logistic回归分析获得诊断sHCCs的独立危险因素,并依据其回归系数构建方程,计算每个病灶的影像组学得分。
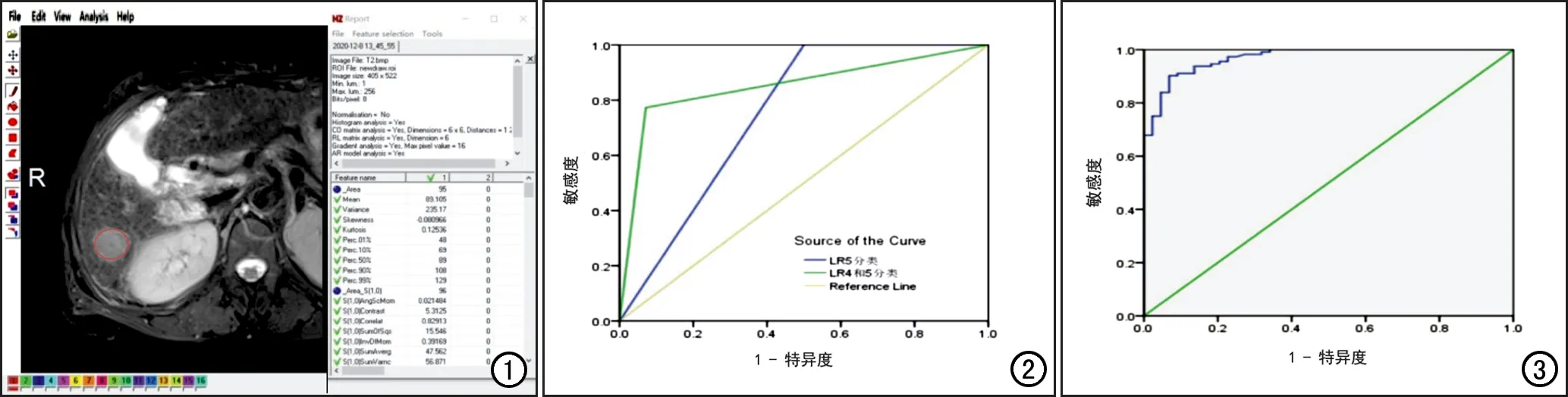
图1 纹理分析方法示意图。采用MaZda软件,在脂肪抑制T2WI图像上沿病灶边缘绘制ROI(红圈),软件即可自动提取ROI的定量纹理特征。 图2 LI-RADS分类鉴别sHCCs与DNs的ROC曲线图,LR-5类和LR-5+LR-4类的AUC分别为0.750和0.851。 图3 影像组学标签鉴别sHCCs与DNs的ROC曲线图,AUC为0.970。
5.统计学分析
使用SPSS 16.0软件对数据进行统计分析。计量资料(不符合正态分布)以中位数(M)及上、下四分位数[M(Q1~Q3)]表示,采用Mann-WhitneyU检验比较sHCCs组和DNs组各项纹理特征值的差异,采用多因素logistic回归分析筛选独立危险因素因素;计数资料以例数或率表示,组间比较采用卡方检验。采用ROC曲线分析LR分类、影像组学标签(Radscore)及两者联合的诊断效能,计算AUC、敏感度和特异度等指标。以P<0.05为差异有统计学意义。
结 果
1.基本临床资料
65例中,男58例,女7例;年龄29~85岁,中位年龄51岁(36~62岁)。依据肝功能Child-Pugh分类标准,A~C级者分别有41、15例和9例。sHCCs的直径为0.7~3.0 cm,中位数1.8 cm(1.4~2.5 cm);DNs的直径为0.8~2.7 cm,中位数2.1 cm(1.2~2.4 cm)。56个sHCCs中,高分化肝癌13个,中分化肝癌39个,低分化肝癌4个;22个DNs中,低级别DNs 17个,高级别DNs 5个。
2.sHCCs的LI-RADS分类结果
联合基本征象及辅助征象,56个sHCCs中,28个(50.0%)判别为LI-RADS(LR)5类,24个(42.9%)判别为LR-4类,4个(7.1%)判别为LR-3类;22个DNs中,5个(22.3%)判别为LR-4类,13个(59.1%)判别为LR-3类,4个(18.6%)判别为LR-2类。ROC曲线分析显示(图2),LR-5类鉴别sHCCs与DNs的AUC为0.750(95% CI:0.645~0.885),敏感度为50.0%(28/56)、特异度为100%(22/22),符合率为64.1%(50/78);LR-5+LR-4类鉴别诊断sHCCs与DNs的AUC为0.851(95% CI:0.739~0.962),敏感度为92.9%(52/56),特异度为77.3%(17/22),符合率为88.5%(69/78)。
3.影像组学标签的诊断结果
筛选的30个最优纹理特征的测量值及组间比较结果见表1。单因素分析结果显示,26个纹理特征的测量值在sHCCs与DNs组之间的差异有统计学意义(P均<0.05)。
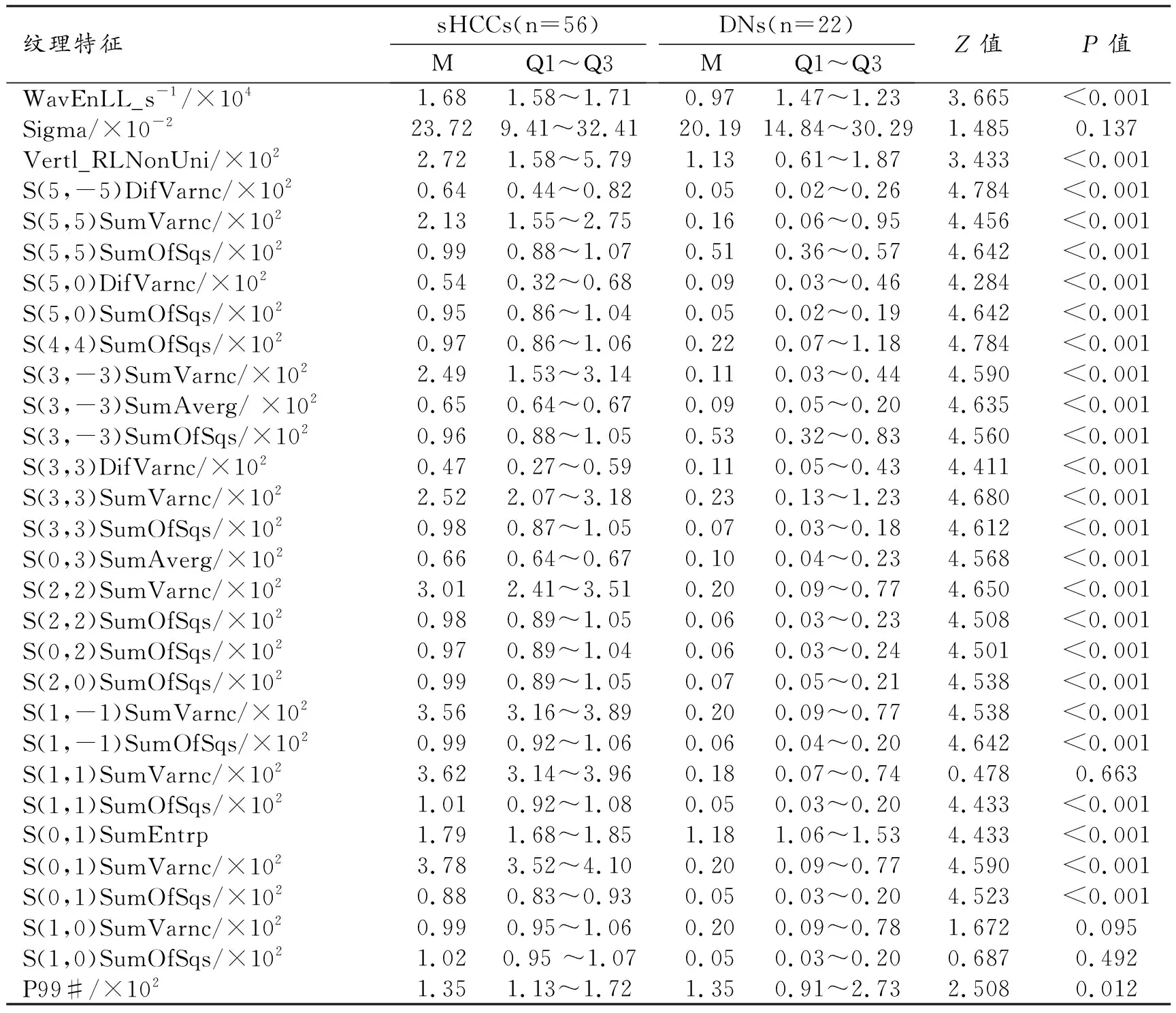
表1 筛选的纹理特征子集比较
多因素logistic回归分析结果显示,S(3,~3)SumAverg(P=0.041)和S(0,3)SumAverg(P=0.036)为HCCs与DNs鉴别的独立影响因素,优势比(odds ratios,OR)分别为0.36(95%CI:0.13~0.96)和3.02 (95%CI:1.06~8.60)。影像组学标签(Radscore)鉴别sHCCs与DNs的AUC为0.970(95%CI:0.947~0.993;图3),敏感度为96.4%(54/56),特异度为95.5%(21/22),符合率为96.2%(75/78)。
4.Radscore与LR分类的效能比较
影像组学标签与LI-RADS鉴别sHCCs与DNs的效能指标值见表2。与LR-5类比较,LR-5+LR-4类具有更高的效能。与LR-5+LR-4类相比,影像组学标签能显著提高诊断特异度(95.5% vs. 77.3%,P=0.031)和符合率(96.2% vs. 88.5%,P=0.023),而两者敏感度(96.4% vs. 92.9%)的差异无统计学意义(P=0.397)。

表2 LI-RADS分类及影像组学标签鉴别诊断sHCCs与DNs的效能比较
讨 论
本研究比较了LI-RADS分类和MRI纹理分析在鉴别肝硬化sHCCs与DNs中的价值,结果显示LR-5联合LR-4类的诊断效能优于LR-5类,尤其是诊断敏感度明显提高。此外,本研究结果显示基于T2WI纹理特征的影像组学标签鉴别sHCCs与DNs的特异度和符合率显著高于LR-5+LR-4类,两种方法的敏感度无显著差异。本研究结果提示MRI纹理分析可作为LI-RADS分类诊断sHCCs的可靠补充方法。
有研究结果表明,对肝硬化结节的定性判别中,LR-5类诊断HCC具有极高的特异度(达95%),但敏感度仅约60%[5];而将LR-5类联合LR-4类诊断HCC时,敏感度提高至85%以上,但特异度降低,约75%[5,9]。本研究支持上述研究结果。本研究中采用最新版的LI-RADS v2108标准,结果显示LR-5+LR-4类较单纯LR-5类鉴别sHCCs与DNs具有更高的诊断效能(AUC:0.851 vs. 0.750),尤其是敏感度有显著提高(92.9% vs. 50.0%),这与本组中40%的sHCCs为LR-4类有关。然而,LR-5+LR-4类的诊断特异度不及单独采用LR-5类(77.3% vs. 100%),这与本组22个DNs中有5个被判别为LR-4类,从而导致特异度下降相关。因此,LI-RADS诊断sHCCs仍面临敏感度与特异度难以兼顾的困境,有待进一步探索sHCCs与良性肝硬化结节鉴别诊断的新方法。
纹理分析是新兴的影像研究领域,是近年来研究的热点,在肿瘤的鉴别诊断、基因分型、疗效评估及预后预测等方面均展现出广阔的应用前景[10-12]。纹理分析在肝肿瘤病变的鉴别诊断中的应用也有一些研究报道。如,Li等[13]研究结果显示基于T2WI的纹理分析诊断肝癌和肝转移瘤的符合率为92%;Mayerhoefer等[14]研究发现基于T2WI的TA鉴别血管瘤与囊肿的符合率为88%。在肝硬化结节的良、恶性鉴别方面,既往的一项研究结果显示基于T2WI的TA对肝硬化小肝癌与增生结节的鉴别诊断具有潜在应用价值,符合率为87%[8]。本研究中对比分析了基于T2WI提取的纹理特征所构建的影像组学标签与LI-RADS对肝硬化sHCCs与DNs的鉴别价值,结果显示基于T2WI的影像组学标签的诊断符合率为96.2%,稍高于上述文献报道的TA在转移瘤与HCC、肝血管瘤与肝囊肿鉴别诊断中的效能。导致这种差异的部分原因可能与本研究中联合应用了3种纹理选择方法,首先筛选出sHCCs与DNs鉴别诊断潜在相关的30个特征,再通过多因素logistics回归获得关键特征组成影像组学标签;之前的研究中采用的影像组学标签构建方法仅基于一种纹理选择方法获得10个特征。
本研究的创新点为首次比较了基于MRI纹理特征的影像组学标签与LI-RADS类鉴别诊断肝硬化sHCCs与DNs的价值。本研究结果显示,与LR-5+LR-4类相比,影像组学标签能显著提高诊断的特异度(95.5% vs. 77.3%)和符合率(96.2% vs. 88.5%),同时特异度无明显下降。本研究结果支持Zhong等[15]的研究结论,他们认为基于T2WI的纹理分析较DWI及Gd-EOB增强肝胆期低信号在鉴别sHCCs与肝硬化良性结节方面具有更优的效能。可见,定性评估容易受到观察者经验等主观因素的影响,纹理分析作为一种无创性的量化分析方法,可望成为肝结节良恶性鉴别诊断的可靠辅助分析方法。
本研究存在的不足之处:一、作为单中心回顾性研究,样本量较少,研究结果尚需进一步验证;二、纳入的sHCCs病例中,以中分化sHCCs为主,不同病理分级的病灶数量差异较大,可能存在一定的选择偏倚。三、因病灶直径较小,本研究中选取病灶最大层面勾画2D ROI进行影像组学分析,未采用3D ROI来进行分析。四、既往研究中已经证实基于T2WI的纹理特征可有效鉴别肝脏病变性质[8,15],故本研究作为初步研究,仅比较了基于T2WI的影像组学标签与LI-RADS的诊断效能,基于其它序列的纹理分析与LI-RADS诊断效能的比较有待今后进一步研究。

