早期帕金森病伴抑郁患者脑网络可控性的初步研究
王晶,周治明,钟维佳,周百万,赵晓岩,李传明
抑郁是帕金森病(Parkinson′s disease,PD)最常见的非运动症状之一,发生率高达50%[1],它不仅严重降低PD患者的生活质量,而且给患者的家庭和整个社会带来严重的心理及经济负担[2]。因此,有效地早期识别帕金森病伴抑郁(Parkinson′s disease patients with depression,DPD)患者并提早实施临床干预措施可能有助于延缓疾病的进展和提高患者的生活质量。
目前,DPD的神经损伤机制仍不清楚。既往有研究结果显示DPD患者存在边缘系统及视觉系统脑白质连接的异常[3],也有研究者发现前额叶、边缘系统、运动皮层和顶枕叶脑区神经元活动的同步性存在异常[4]。然而,DPD患者在连接组拓扑和结构控制等脑功能动力学方面是否发生改变尚未可知。
网络控制理论是一种新兴的脑网络分析技术,它结合了结构连通性测量和局部动力学的线性估计,以提供脑功能网络的一部分对其它部分和不断变化的大脑状态的影响程度的度量[5],有助于揭示双相情感障碍[6]、帕金森病伴幻觉[7]和颞叶癫痫[8]等疾病进程中与脑功能动力学相关的神经影像机制,目前,尚未见使用此方法评估DPD患者脑功能动力学改变的研究。
因此,本研究基于3D-T1WI和扩散张量成像(diffusion tensor imaging,DTI)来构建脑结构网络,并运用脑网络控制理论来探索DPD患者局部脑区的可控性改变,为探究DPD患者脑网络功能动力学是否存在紊乱提供初步的科学依据。
材料与方法
1.临床资料
自Parkinson Progression Markers Initiative(PPMI)数据库(http://www.ppmi-info.org)搜集符合本研究条件的53例早期PD患者的病例资料。PPMI数据库中的每项研究在登记之前获得了人类实验伦理标准委员会的批准,并且每例受试者均签署了书面知情同意书。本研究获得了PPMI数据库资料的使用权。
PD组纳入标准:①患者有静止性震颤、运动迟缓和肌强直这3种症状中的至少两种(且必须有静止性震颤或运动迟缓),或有不对称静止性震颤,或有不对称运动迟缓;②病程在2年以内且无手术史及服用相关药物史;③Hoehn-Yahr分级为1级或2级;④脑SPECT扫描显示脑内多巴胺转运蛋白降低;⑤影像图像清晰,无明显运动伪影和失真。排除标准:①临床诊断有认知障碍或痴呆;②因药物等其它因素引起的非典型帕金森综合征;③有其它神经系统相关疾病。
参考15项老年抑郁自评量表(15 items Geriatric Depression Scale,GDS-15)评分,将53例早期PD患者分为2组:①DPD组19例患者,GDS-15评分≥5;②帕金森病不伴抑郁组(NDPD)34例患者,GDS-15评分<5。采用运动障碍学会帕金森病统一评分量表第三部分(Movement Disorder Society Unified Parkinson Disease Rating Scale III,MDS-UPDRS-III)及改良Hoehn-Yahr(HY)分级标准对PD患者进行运动功能评分,采用蒙特利尔认知评价量表(Montreal Cognitive Assessment,MoCA)评估患者的认知功能。
同期搜集18例性别、年龄及受教育年限相匹配的健康受试者(healthy controls,HC)。排除标准:①有神经精神病史;②MoCA评分<26;③GDS-15评分≥5;④特发性PD患者的一级亲属;⑤年龄小于30岁。
2.磁共振扫描参数
使用Siemens Tim Trio 3.0T磁共振仪,扫描序列和参数如下。①矢状面3D-T1WI:扫描层数176,TR 2300 ms,TE 2.98 ms,翻转角9°,体素大小1.0 mm×1.0 mm×1.0 mm,矩阵240×256;②横轴面DTI:TR 500~9000 ms,TE 88 ms,翻转角90°,体素大小2.0 mm×2.0 mm×2.0 mm,矩阵1044×1044,扩散敏感梯度方向64个,b=1000 s/mm2。
3.图像预处理
3D-T1WI图像的预处理使用Matlab SPM 12.0软件完成,主要步骤:①将3D-T1WI数据的DICOM格式转换成成NIFTI格式;②手动调整图像,使前联合-后联合连线与x轴平行,以保证节点分割的准确性;③通过非线性转换,将个体的3D-T1WI图像配准到MNI-152模板空间,由此产生的形变场用于将自动解剖标记(automated anatomical labeling,AAL)图谱逆转换到3D-T1WI图像,从而将大脑分成90个感兴趣区域(78个皮层区域,12个皮层下区域)。
DTI图像预处理使用PANDA 1.0.0软件,主要步骤:①将DTI图像转换成NIFTI格式,输出扩散b值表和扩散梯度表;②将B0图像配准到转化之后的3D-T1WI图像;③使用头动校正法去除轻微头动的影响,采用涡流校正方法去除梯度线圈涡流引起的图像变形;④剥除非脑组织以降低运算量;⑤基于DTI图像的三个本征向量值,计算各向异性分数(fractional anisotropy,FA)并生成FA图。
4.脑网络构建及分析
脑结构网络的构建使用PANDA1.0.0软件,主要步骤:①使用确定性纤维连续跟踪算法获得全脑白质纤维束的分布图;②利用预处理后的3D-T1WI图像和FA骨架进行非线性配准,结合AAL图谱得到一个90×90的无向加权脑结构网络连接矩阵[9]。
参照Gu等[5]的研究结果,计算每例受试者的脑网络控制指标。简而言之,神经状态在数学上可以描述为具有k个节点的网络在时间步长t下的模拟状态(x),计算公式为:
xt+1=Axt+But
(1)
其中,xt是所有节点k在时间t的所有模拟状态的向量,t是离散时间步长(t=1, 2, ...),A是具有节点k的一个对称的加权邻接矩阵,B是网络中控制节点的矩阵,ut是在时间t施加到控制节点B的能量。
使用Matlab软件,以每例受试者90个脑区的FA矩阵作为输入,使用简单线性动力学模型准确估计每例受试者大脑状态的波动情况,计算出网络中每个节点的平均可控性向量值和模式可控性向量值,用于评估脑网络功能动力学改变情况。脑网络控制指标使用代码来源:https://complexsystemsupenn.com/s/controllability_ code-smb8.zip。
5.统计学分析
使用SPSS 25.0统计软件。采用卡方检验对3组受试者的性别及DPD组与NDPD组的HY分级进行比较,对3组受试者的年龄、MoCA评分、受教育年限及脑网络可控性指标进行单因素方差分析及事后分析,对DPD组与NDPD组的GDS-15评分和MDS-UPDRS-III评分的比较采用两独立样本t检验。采用Spearman相关分析评价DPD组GDS-15评分与在单因素分析结果中存在显著差异的脑区的脑网络可控性指标值之间的相关性。以P<0.05为差异有统计学意义。
结 果
1.一般资料
DPD、NDPD和HC组受试者基本临床资料的比较结果见表1。三组之间性别、年龄、受教育年限和MoCA评分的差异均无统计学意义(P>0.05)。

表1 三组受试者基本临床资料的比较
DPD组与NDPD组之间主要临床表现的比较结果见表2。与NDPD组比较,DPD组的GDS-15评分和MDS-UPDRS-III评分更高,HY分级高,差异均具有统计学意义(P<0.05)。

表2 两组PD患者临床特征的比较
2.脑网络可控性
DPD、NDPD和HC组的脑网络平均可控性分析结果见表3。研究结果显示,DPD组的左侧中央前回、左侧岛盖部额下回、左侧楔叶及左侧枕上回的平均可控性较NDPD组显著降低(图1a);DPD组与HC组之间脑区平均可控性的差异无统计学意义(P>0.05);NDPD组左侧眶部额中回和左侧枕上回的平均可控性较HC组显著升高(图1b)。

表3 三组之间有显著差异脑区的平均可控性测量值及事后分析结果
DPD、NDPD和HC组的脑网络模式可控性分析结果见表4。DPD组右侧颞中回的模式可控性相比于HC组显著降低(图1c);DPD组与NDPD组之间模式可控性的差异无统计学意义(P>0.05);NDPD组左侧枕上回的模式可控性较HC组显著降低,左侧壳核的模式可控性较HC组显著升高(图1d)。
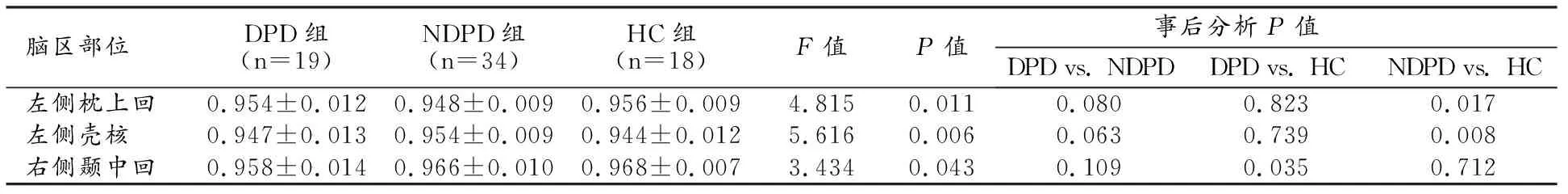
表4 三组之间有显著差异脑区的模式可控性测量值及事后分析结果

图1 脑功能伪彩图显示DPD组、NDPD组和HC组之间局部脑网络可控性有显著差异的脑区,红色为可控性升高的脑区,蓝色为可控性减低的脑区。a)与NDPD组比较,DPD组的左侧中央前回、左侧岛盖部额下回、左侧楔叶及左侧枕上回的平均可控性显著降低;b)与HC组比较,NDPD组的左侧眶部额中回、左侧枕上回的平均可控性显著升高;c)与HC组比较,DPD组的右侧颞中回的模式可控性显著降低;d)与HC组比较,NDPD组的左侧枕上回的模式可控性显著降低,左侧壳核模式可控性显著升高。
Spearman相关分析结果显示,DPD组GDS-15评分与左侧中央前回(r=0.119,P=0.628)、左侧岛盖部额下回(r=0.071,P=0.773)、左侧楔叶(r=-0.408,P=0.083)、左侧枕上回(r=-0.380,P=0.109)的平均可控性之间无显著相关性。DPD组GDS-15评分与右侧颞中回(r=-0.354,P=0.138)的模式可控性之间无显著相关性。
讨 论
脑网络控制理论为大脑结构连接对神经功能的影响提供了数学推导的预测[7,10-11]。在给定结构网络及其动力学情况下,可以使用网络控制理论来定量检查网络结构如何约束节点(脑区)。局部脑区的可控性可采用平均可控性和模式可控性来进行评估,平均可控性用于识别将大脑切换到许多容易到达(只需输入较少的能量)状态的脑区,模式可控性可用于识别将大脑切换到触及(需要输入大量能量)状态的脑区[5]。本研究采用脑网络控制理论分析方法对比分析了DPD、NDPD及HC组之间脑网络结构控制的改变情况,发现DPD患者在病程早期即存在以视觉中枢为主的多个脑区的脑功能动力学紊乱。这些脑区作为大脑信息接收和处理的初级中枢 ,与之后大脑对信息的高级处理过程(如情感处理、奖赏反馈等)密切相关,因此这些脑区的脑网络结构控制紊乱可导致抑郁的发生[12]。
楔叶和枕上回作为枕叶的组成部分,是视觉通路的重要组成,而视觉皮层与注意力、工作记忆和感知相关,其功能障碍可导致信息处理的认知控制受损,最终可导致抑郁[12]。本研究结果显示DPD组左侧楔叶和枕上回的平均可控性降低,意味着上述脑区结构的改变使得所支配的脑功能动力学效能减低。一项SPECT 研究中发现,DPD组的楔叶局部血流量较NDPD组升高,且与抑郁严重程度呈显著正相关[13]。且有研究者发现DPD患者枕叶皮质的脑波活动加速[14],另一项研究中采用局部一致性(regional homogeneity,ReHo)方法得出DPD组枕叶的神经元活动同步性异常[4]。上述研究结果均表明视觉中枢可能在DPD的发病机制方面具有重要作用,它的改变引起了网络控制系统的紊乱,从而导致抑郁的产生。
额叶在调节、控制情感和情绪方面起着重要作用[15-16]。本研究中发现DPD组左侧中央前回及岛盖部额下回的平均可控性降低,即功能动力学受限,这可能与抑郁的发生相关。以往研究结果表明DPD患者的左侧额下回的功能连接较正常组明显增强[17]。另有国内学者研究发现,抑郁症患者双侧额下回脑区的ReHo明显减小[18]。众所周知,中央前回参与了大脑运动中枢的组成[19]。一项临床研究中发现DPD组较NDPD组的HY分级和MDS-UPDRS-Ⅲ评分增高[20],本研究也采用了HY分级和MDS-UPDRS-Ⅲ来评估PD患者的运动功能,获得了类似的结果。上述研究结果均表明中央前回对PD患者抑郁症状的出现及运动功能障碍的进展具有重要作用。
颞叶在视觉信息的处理及加工中有重要作用。一项临床研究结果显示视觉受损与PD患者出现抑郁症状相关[21]。目前已有研究证明,老年抑郁症患者存在颞叶脑白质结构异常[22]。而本研究也发现DPD组右侧颞中回的模式可控性降低,表明右侧颞中回引起的网络功能动力学紊乱可能参与了抑郁的发生。
本研究结果还显示NDPD组左侧眶部额中回和左侧枕上回的平均可控性较HC组显著升高,左侧壳核的模式可控性较HC组显著升高,我们推测这可能与PD患者脑网络控制损伤后的功能代偿有关。最后,本研究中对DPD组患者的脑网络可控性与GDS-15评分进行了相关性分析,结果显示两者无显著相关性。这一结果是否具有普适性,尚需进一步证实。
需要指出,本研究存在以下不足之处:第一,样本量相对较小,本研究的初步成果有待在大样本数据中验证;第二,本研究中的DPD患者均为轻度抑郁患者,可能存在一定程度的样本选择偏倚;第三,其它可能影响大脑网络的非运动功能可能对结果存在潜在影响。
综上所述,本研究结果显示DPD患者在病程早期即出现了脑网络可控性的异常改变,其中左侧中央前回、左侧岛盖部额下回、左侧楔叶、左侧枕上回及右侧颞中回的脑网络可控性紊乱可能与DPD的神经损伤机制有关。

