不冻液冻结对白斑狗鱼冻融稳定性的影响
苏日耶姆·尼加提,魏亚博,邓小蓉,郭欣,雷用东,张建
石河子大学食品学院(石河子 832000)
白斑狗鱼(Esox lucius),在我国主要分布于新疆阿勒泰地区额尔齐斯河流域[1],具有肉厚刺少、营养价值高等特点。近年来,我国冷鲜鱼消费比例逐渐增大,白斑狗鱼由于受到地域性限制,其发展受到很大阻碍[2-3]。水产品贮藏过程中,因外界温度变化和冷藏链间断等原因,水产品在被消费前处于反复冻融状态[4],导致鱼肉组织中的冰晶重结晶,蛋白质变性,从而影响其结构和功能,对水产品市场发展造成极大阻碍[5]。有研究表明,鮰鱼、虾等水产品贮藏过程中,反复冻融导致其肌肉质地劣变、水分流失严重,降低了消费者可接受的程度[6-7]。因此,研究新型冻结方式、提高白斑狗鱼贮藏过程中冻融稳定性具有重要意义。
不冻液冻结法是水产品冻结领域中的新型冻结方法。不冻液也被称为低温载冷剂,具有冷冻速度快、能耗低、冷冻质量好等优势[8],通过与冷冻食品接触换热,从而使食品降温达到冻结效果[9]。目前有关不冻液冻结白斑狗鱼的研究较少。为适应当前白斑狗鱼市场需求、提高新疆特色冷水鱼经济效益,试验以新疆特色冷水鱼白斑狗鱼为研究对象,研究不同冻结点的不冻液(-39,-48,-57和-63 ℃)对白斑狗鱼冻融稳定性的影响,旨在提高白斑狗鱼的冻融稳定性,以期为促进白斑狗鱼市场发展提供参考依据。
1 材料与方法
1.1 试验材料与试剂
白斑狗鱼(单个体质量1 300~1 500 g,石河子市农贸市场)。
苏木素-伊红染液、牛血清蛋白标准品(北京索莱宝科技有限公司);其他所有试剂均为国产分析纯。
不冻液组成(所用原料均为食品级):1号不冻液,0.15 g/mL乙醇+0.12 g/mL低聚果糖+0.04 g/mL柠檬酸+0.03 g/mL氯化钙+0.10 g/mL丙二醇,其余为水(冻结点为-39 ℃);2号不冻液,0.20 g/mL乙醇+0.12 g/mL低聚果糖+0.04 g/mL柠檬酸+0.05 g/mL氯化钙+0.10 g/mL丙二醇,其余为水(冻结点为-48 ℃);3号不冻液,0.20 g/mL乙醇+0.10 g/mL低聚果糖+0.04 g/mL柠檬酸+0.07 g/mL氯化钙+0.10 g/mL丙二醇,其余为水(冻结点为-57 ℃);4号不冻液,0.20 g/mL乙醇+0.10 g/mL低聚果糖+0.03 g/mL柠檬酸+0.05 g/mL氯化钙+0.10 g/mL丙二醇,其余为水(冻结点为-63 ℃)。
1.2 仪器与设备
KD-3000低温恒冷切片机(浙江省金华市科迪仪器设备有限公司);DC-2015低温恒温槽(上海习仁科学仪器有限公司);K3 Plus酶标仪(上海珂淮仪器有限公司);CX21显微镜[奥林巴斯(深圳)工业有限公司];H2500R-2高速冷冻离心机(北京澎昆博远科贸发展有限责任公司);TA.XT Plus质构仪(英国Stable Micro System公司)。
1.3 试验方法
1.3.1 样品前处理
将白斑狗鱼敲晕致死,去头、尾、内脏,用流动水洗去表面的杂物,去皮、脊骨,用刀将鱼脊背肌肉分割成长宽各为4 cm、厚度为2 cm的肉块,真空包装后放置备用。
1.3.2 样品冻结冻藏处理
不冻液处理组:将配好的不冻液分别预冷至-20℃,将包装好的鱼块放置于不冻液中进行冻结。空气冻结组:另取包装好的鱼块放置于-20 ℃的冰箱中进行冻结。冻结期间测定鱼块中心温度,待鱼块中心温度达到-18 ℃时取出不冻液冻结组鱼块,放置于-20℃冰箱中冻藏,间隔5 d取1次样进行冷冻切片及显微观察,并将样品在4 ℃环境中进行解冻,待样品温度达到0~2 ℃时进行相关指标的测定。
1.3.3 冻结曲线的测定
将中心温度计探头插入鱼块几何中心位置,另一端连接电脑,将备好的鱼块放置于预冷好的不冻液中,不冻液冻结组每隔30 s记录1次温度,空气冻结组每隔5 min记录1次温度绘制冻结曲线。
1.3.4 冷冻切片
对冷冻切片机进行预冷处理,设置冷冻切片机冷冻室及冷动台温度-30 ℃。取5种不同冻结处理后的样品,尽快修成长宽各为2 cm,厚度为1 cm,将修整好的样品放置于样品托并进行冻固。设置修片厚度(15 μm)并对样品进行修片处理,待样品表面修整为平整表面后对样品进行切片,切片厚度为10 μm。用载玻片贴取切片,在固定液中进行固定并用苏木素-伊红染色液进行染色,使用光学显微镜对切片组织进行观察。
1.3.5 色泽
取5种解冻后的鱼肉样品,为防止鱼肉表面的水分对光的反射从而影响色泽,用滤纸将鱼肉表面的水分吸干。以仪器白板色泽为标准,使用CIELAB表色系统进行色泽测定。将待测样品放在探测器端面,每个样品测3次。
1.3.6 汁液流失率
汁液流失率的测定方法参考聂小宝等[10]方法并略加改动。将样品在解冻前和解冻后称其质量,分别得到解冻前的质量(M1)和解冻后质量(M2),汁液流失率按照式(1)计算。
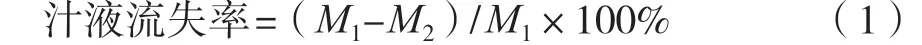
式中:M1为解冻前的质量,g;M2为解冻后的质量,g。
1.3.7 肌原纤维蛋白的提取及测定
白斑狗鱼肌原纤维的测定参考Deng等[11]的方法进行。在解冻后的白斑狗鱼中加入10倍体积的磷酸盐缓冲溶液A(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,pH 7.5),均质匀浆直至肌肉破碎,在8 000 r/min、15 min、4 ℃条件下提取2次,弃去上清液,在沉淀中加入10倍体积的磷酸盐缓冲溶液B(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,0.6 mol/L NaCl,pH 7.5),均质1 min,在8 000 r/min、15 min、4 ℃条件下提取2次,合并2次上清液,即为肌原纤维蛋白。采用双缩脲法[12]测定蛋白质的浓度,以牛血清蛋白为标准品,测定标准曲线y=0.026 3x+0.003 6,R2=0.999 3。
1.3.8 总巯基含量的测定
总巯基含量的测定参考Simplicio等[13]的方法并略加改动。取5种蛋白样品溶液,各1 mL,加入8 mL三羟甲基氨基甲烷(Tris)-甘氨酸(pH 8),涡旋混匀1 min,按4 ℃、8 000 r/min离心15 min,在溶液中加入0.5 mL 10 mmol/L Ellman 试剂(DTNB试剂),反应0.5 h后,在412 nm处测定吸光度,使用摩尔消光系数13 600 L/(mol·cm),利用式(2)计算总巯基含量(nmol/mg)。
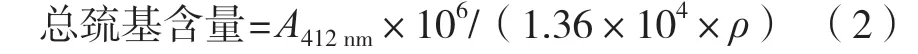
式中:1.36×104为摩尔吸光系数,L/(mol·cm);ρ为双缩脲法测得的蛋白质量浓度,mg/L。
1.3.9 表面疏水性的测定
表面疏水性的测定参考Chelh等[14]的方法并略加改动。将蛋白浓度稀释至5 mg/mL,取2 mL稀释后的蛋白溶液加入200 μL 1 mg/mL的溴酚蓝,涡旋混匀10 min,按8 000 r/min离心15 min,取上清液在595 nm下测定吸光度,记作A595nm。溴酚蓝空白样是用1 mL 20 mmol/L的磷酸盐缓冲液(pH 6.0)加200 μL溴酚蓝,磷酸盐缓冲液作空白样,在595 nm下测定吸光度,记作A0。表面疏水性(溴酚蓝,μg)按式(3)计算。

1.3.10 数据分析
数据处理和差异显著性分析分别采用Origin和SPSS软件进行,所有试验均重复3次。
2 结果与分析
2.1 不同冻结条件下白斑狗鱼块的冻结曲线
不同冻结条件下白斑狗鱼块的中心温度变化如图1所示。白斑狗鱼块的冻结过程分为3个阶段:初阶段为冷却过程,鱼块温度从原始温度降低至冻结点,该阶段具有降温快的特点;中阶段为结冰过程,此过程中鱼块中大部分水结成冰,放出大量潜热,因此降温缓慢;终阶段为继续冻结的过程,降温速率较快[15]。比较不同冻结条件下白斑狗鱼块的冻结速率可发现,不冻液冻结速率明显高于空气冻结速率,并且在同一温度下,当不冻液的冻结点越低时,其冻结速率越快。
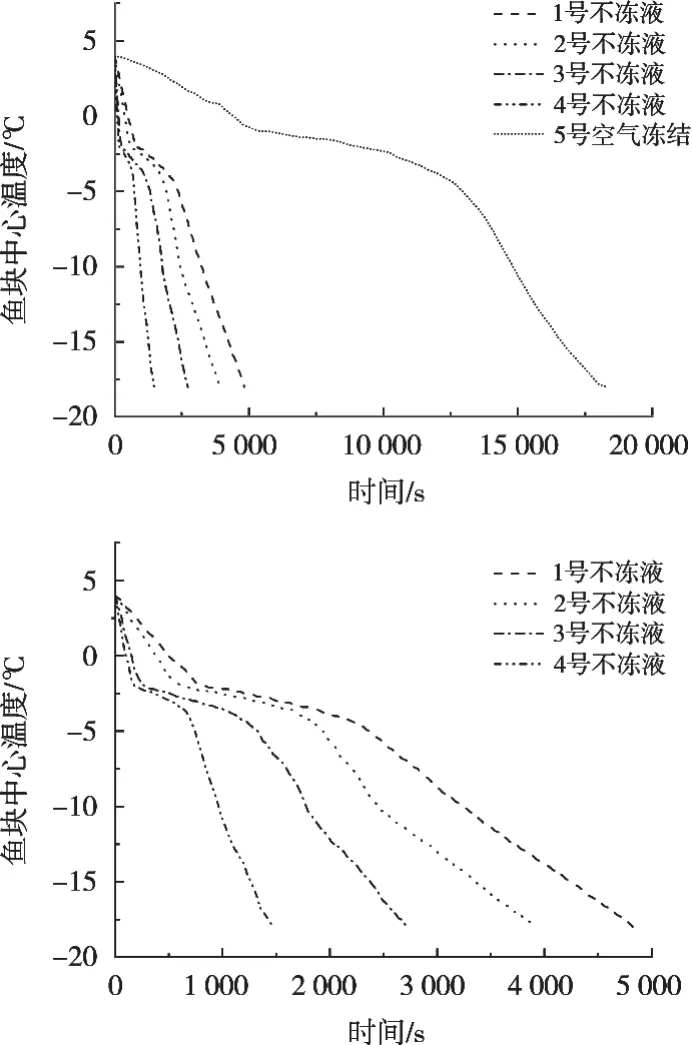
图1 不同冻结条件下白斑狗鱼块中心温度变化
2.2 不同条件冻藏过程中白斑狗鱼块的冰晶形态
水产品在冻藏过程中,随着冻藏时间的延长及冻融次数的增加,其微观结构的完整性会发生变化,并且冻结过程中形成的冰晶大小和数量在很大程度上影响水产品的品质[16]。图2为冻藏过程中不同冻结条件下白斑狗鱼块横切面,可以通过冰晶留下的间隙反映鱼块中冰晶的大小。通过对比冻融0~5次期间5组鱼块中的冰晶大小可知,随着冻融次数的增加,鱼块中的冰晶逐渐增大,且其微观结构的完整性逐渐降低。相比于不冻液冻结组,空气冻结组鱼块中的冰晶大,组织结构的破坏程度高,冻融5次后鱼肉中纤维组织严重断裂。
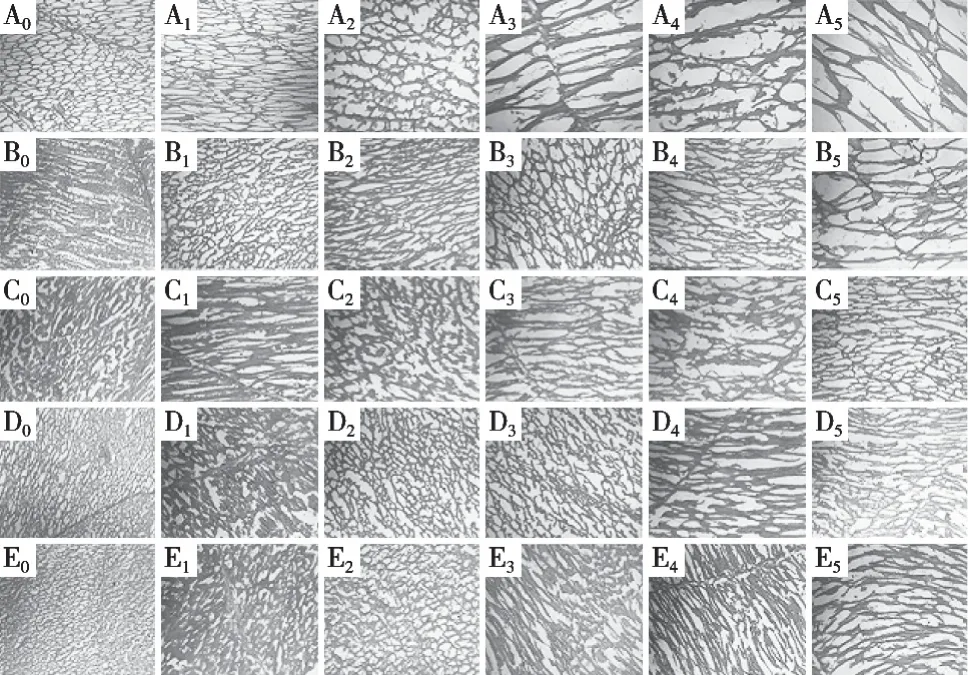
图2 不同冻结条件下白斑狗鱼块的冰晶形态变化(×80)
对比4种不冻液处理组鱼块冻融后的微观结构可知,不冻液冻结点对白斑狗鱼贮藏过程中鱼块内的冰晶大小及纤维结构完整性有显著影响。1号和2号不冻液处理组鱼块中的冰晶体积大且纤维结构破损程度严重,其中1号不冻液处理组鱼块在冻融5次后冰晶体积最大。3号和4号不冻液处理组鱼块在冻融0次时冰晶体积小且分布均匀,随着冻融次数的增加,鱼块内冰晶体积逐渐增大,冻融2次时,3号不冻液处理组鱼块内冰晶体积显著大于4号不冻液处理组鱼块。冻融5次完成后,4号不冻液处理组鱼块内冰晶体积最小且结构完整性最高。这可能是因为鱼块在冻结过程中体内液体形成的冰晶会对细胞结构造成机械性损伤,并且反复冻融过程导致鱼块内的冰晶重结晶,这对其结构造成进一步损伤。
2.3 不同条件冻藏过程中白斑狗鱼块色泽的变化
鱼肉在贮藏过程中因发生一系列生化反应,会导致色泽变化[17]。不冻液冻结对白斑狗鱼冻融循环过程中色泽的影响如图3所示。随着冻融次数的增加,不同处理组鱼肉的L值出现逐渐下降趋势,而a值和b值逐渐增加。这可能是由于贮藏过程中冻融循环促使鱼肉中脂肪氧化,其产生深色物质导致鱼肉表面逐渐暗淡。姜晴晴等[18]研究带鱼冻融循环过程中色泽变化也得到相似结果。
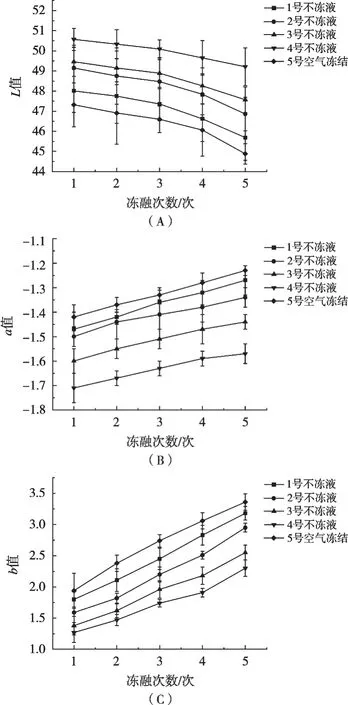
图3 不冻液冻结对白斑狗鱼冻融循环贮藏过程中色泽的影响
与空气冻结组相比,不冻液冻结组鱼块L值偏高,说明不冻液冻结处理能有效减缓白斑狗鱼在贮藏过程中因冻融循环导致的色泽暗淡。不冻液冻结点对鱼块色泽有显著影响,4号不冻液处理组鱼块L值显著高于其他处理组,1号不冻液处理组鱼块L值最低,与空气冻结组鱼块L值较为接近。a值与b值则与不冻液冻结点呈正相关趋势,4组不冻液处理组中1号和2号不冻液处理组鱼块a值显著高于其他处理组,4号不冻液处理组鱼块a值上升趋势较为缓慢。这可能是因为冻融循环过程中冻结速率越快,鱼肉脂肪氧化程度越低,鱼块在贮藏过程中色泽变化程度越低。
2.4 不冻液对白斑狗鱼冻融循环贮藏过程中汁液流失率的影响
不冻液对白斑狗鱼冻融循环贮藏过程中汁液流失率的影响如图4所示。随着冻融次数的增加,鱼块汁液流失率逐渐增加。这是因为在反复冻融过程中,鱼块中的细胞结构遭到破坏,肌原纤维脱水,导致蛋白质的变性,鱼块在解冻时水分流失逐渐增大。常海军等[19]研究冻融次数对猪肉品质的影响时也得到一致结果。
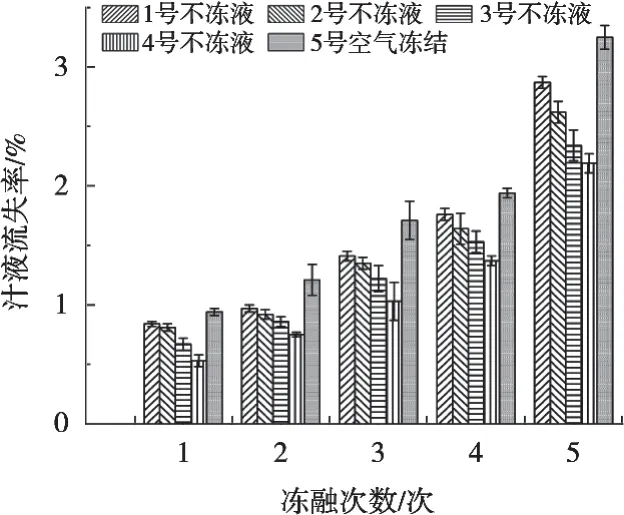
图4 不冻液冻结对白斑狗鱼冻融循环贮藏过程中汁液流失率的影响
冻融贮藏期间,空气冻结组鱼块汁液流失率显著高于不冻液处理组,说明不冻液冻结处理可在一定程度上降低白斑狗鱼解冻后的汁液流失率。不冻液冻结点对鱼块汁液流失率有显著影响,不冻液冻结点越高,鱼块汁液流失率上升趋势越明显,4号不冻液处理组鱼块汁液流失率显著低于其它处理组。
2.5 不冻液对白斑狗鱼冻融循环贮藏过程中总巯基含量的影响
鱼块冻结过程中形成的冰晶,导致肌原纤维蛋白结构的改变,从而促使内部的巯基暴露,进而氧化为二硫键,因此巯基的含量可作为衡量蛋白质变性的重要指标之一[20]。不冻液对白斑狗鱼冻融循环贮藏过程中总巯基含量的影响如图5所示。随着冻融次数的增加,鱼块内总巯基含量整体呈现逐渐下降趋势,说明随着冻融次数的增加,鱼块内蛋白质变性逐渐增强。Zhang等[21]通过试验证实冻融循环促进鳙鱼肉中总巯基含量下降。
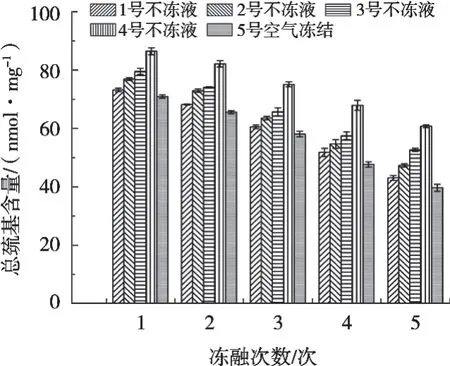
图5 不冻液冻结对白斑狗鱼冻融循环贮藏过程中总巯基含量的影响
冻融贮藏过程中,空气冻结组鱼块总巯基含量显著低于不冻液冻结组,且不冻液冻结点显著影响总巯基含量变化。冻融期间,4号不冻液冻结组鱼块总巯基含量显著高于其他处理组,其蛋白质变性程度最低。原因可能是冻结速率快,形成的冰晶小,且在细胞内与细胞间隙中均匀分布,蛋白冷冻变形程度低[22]。
2.6 不冻液对白斑狗鱼冻融循环贮藏过程中表面疏水性的影响
图6表示不冻液对白斑狗鱼冻融循环贮藏过程中表面疏水性的影响。随着冻融次数的增加,表面疏水性呈现上升趋势,且经4次冻融后鱼块表面疏水性增长迅速,说明随着冻融次数增加,蛋白质变性程度逐渐增强。Zhang等[23]和袁丽等[24]在鲢鱼和凡纳滨对虾中发现相似的研究结果。这可能是因为反复冻融过程中,蛋白质变性导致内部疏水性基团暴露,促使蛋白质二级结构肽链的卷曲或三级结构发生变化,蛋白质表面疏水性增强。
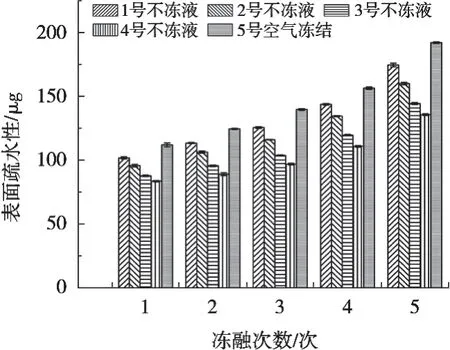
图6 不冻液冻结对白斑狗鱼冻融循环贮藏过程中表面疏水性的影响
冻融贮藏期间,空气冻结组鱼块表面疏水性显著高于其他处理组,蛋白质变性程度最高。不冻液冻结点越低,鱼块表面疏水性越低,4种不冻液处理组鱼块表面疏水性呈下降趋势。3号和4号不冻液处理组鱼块表面疏水性较低,随冻融次数的增加其表面疏水性增长趋势显著低于其他处理组,蛋白质变性程度较低。
3 结论
不冻液冻结对白斑狗鱼的冻融稳定性有显著影响。冻融贮藏期间,冻结点为-63 ℃的4号不冻液冻结组鱼块内冰晶体积显著小于其他处理组。与空气冻结组相比,不冻液冻结处理可在一定程度上抑制反复冻融导致鱼块的色泽、汁液流失率发生不同程度的劣化,其中4号不冻液冻结组鱼块色泽明亮,汁液流失率最低。不冻液冻结点对鱼块贮藏过程中蛋白质变性程度有显著影响,不冻液冻结点越低,鱼块中蛋白质变性程度越低。因此,不冻液冻结更有利于保证白斑狗鱼的冻融稳定性,4号不冻液(冻结点为-63 ℃)冻结速率快,鱼块品质最佳,可最大程度减少贮藏过程中反复冻融对白斑狗鱼品质的影响。

