燕麦耐消化肽纳米载体的制备表征及其对咖啡酸苯乙酯的包埋作用研究
靳祖珑,冯思怡,胡亚雯,宋洪东,管骁*,孙注,戴智华
1(上海理工大学 健康科学与工程学院/国家粮食产业(城市粮油保障)技术创新中心,上海,200093) 2(内蒙古燕谷坊生态农业科技(集团)股份有限公司, 内蒙古 呼和浩特,011700) 3(麦稻智慧粮食有限公司,上海,200241)
近年来,科学家们持续关注植物资源的开发利用,谷物和豆类中含有丰富的蛋白质,约占其质量的7%~15%,是蛋白质的良好来源。在谷类和豆类作物的深加工中,蛋白质因未被有效利用而产生极大的浪费。蛋白质基的纳米载体是目前的研究热点,高效、低毒、廉价、实用的新纳米材料具有广阔的应用前景[1]。白蛋白、玉米醇溶蛋白、大豆分离蛋白已被证明是实用的蛋白纳米载体。燕麦年产量高,但燕麦蛋白在纳米领域的应用研究相对较少。燕麦是一年生禾本科植物,种子中蛋白质含量约为12%~20%,为蛋白质含量最高的谷类[2],且燕麦蛋白有较高的生物活性,十分适合食品领域的应用。
蛋白质基纳米载体是一种有效的运载体系,能够提高小分子活性物质的溶解性和生物利用度,同时具有高安全性和容易制备的特点,因此在食品和医学领域有着广泛的应用。然而在实际应用中一部分蛋白具有很强的疏水性,难以在水中稳定分散且表面活性较低,使其应用价值大打折扣[3]。蛋白质水解是一种操作简便且效果显著的改良方法,能够大大增加纳米载体的水溶性[4-5]。蛋白质经过人体消化酶(胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶)水解后得到的肽具有耐消化的特点,不容易在消化道中进一步分解[6]。同时,作为壁材的肽也具有一定的生物活性,能做为营养补剂达到高效利用的效果。
咖啡酸苯乙酯(caffeic acid phenethyl ester, CAPE)来源于蜂胶,是其中的主要活性成分之一。CAPE具有多种功能活性,抗炎、抗癌、抗氧化和抗病毒效果显著。然而CAPE的苯环结构使其极难在水中分散,同时苯环上的酚羟基也容易氧化,这使得CAPE难以在人体中有效发挥功效。通过构建肽纳米颗粒可增大CAPE在水中的溶解性,同时保护其化学结构完整[7-8]。研究肽纳米颗粒的组成模式并对耐消化肽纳米载体进行评估,可为深入研究和探索耐消化肽应用价值提供一定理论依据。
1 材料与方法
1.1 实验材料
1.1.1 材料试剂
燕麦米,河北省涞水县金谷粮油食品有限公司,产地为涞水县。
正己烷、NaOH、盐酸、二硫苏糖醇、尿素、正十六烷、磷钨酸,国药集团化学试剂有限公司;葡聚糖凝胶G-75,源叶生物科技有限公司;胃蛋白酶(P-7000)、胰酶(P-1750)、胰蛋白酶(93615),Sigma-Aldrich公司;咖啡酸苯乙酯,上海阿拉丁生化科技股份有限公司。
1.1.2 仪器设备
KjeltecTM8400型全自动凯氏定氮仪,丹麦FOSS分析仪器有限公司;NanoBrook 173Plus多角度动态光散射仪,美国Brookhaven仪器公司;VCA Optima接触角测量仪,美国AST产品股份有限公司;JEM-2100透射电子显微镜,日本电子株式会社;F7000荧光分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 燕麦分离蛋白提取
采用碱溶酸沉法提取燕麦分离蛋白。取脱脂燕麦粉,以料液比1∶10(g∶mL)加入去离子水,调节pH至10.0,搅拌提取1 h。以4 000 r/min转速离心10 min,取上清液调节pH至4.5,在4 ℃下静置30 min待蛋白析出,离心以沉淀蛋白,用去离子水分散蛋白并调节pH至中性后离心,冷冻干燥即得到燕麦分离蛋白,在-20 ℃下密封保存。
1.2.2 燕麦分离蛋白组分测定
蛋白含量测定采用凯氏定氮法,蛋白含量换算系数为5.83。油脂含量测定采用甘油三酯测试盒法。多糖含量测定采用苯酚-硫酸法。
1.2.3 蛋白水解度评估
以pH-Stat法对蛋白酶解过程进行监测并计算最终水解度[9-10]。
胃蛋白酶酶解:将200 mg燕麦分离蛋白分散于20 mL水中,用盐酸调节pH至2.0,升温至37 ℃,加入1 mL 5 mg/mL的胃蛋白酶盐酸溶液(pH 2.0),并用3 mol/L的盐酸维持pH在2.0。分别在10、30、60、90、120 min统计盐酸的总消耗量,计算燕麦分离蛋白在胃消化中水解度(degree of hydrolysis,DH),如公式(1)所示:
(1)
式中:V,滴定消耗的盐酸体积,mL;c,盐酸的摩尔浓度,mmol/mL;m,蛋白质质量,g;htot,单位质量蛋白质中的肽键摩尔数,取8.33 mmol/g;αCOOH(pH),羧基的平均解离度。
胰酶/胰蛋白酶酶解:将200 mg燕麦分离蛋白分散于20 mL水中,用NaOH溶液调节pH至7.4并升温至37 ℃,将10 mg胰酶/胰蛋白酶分散在1 mL pH 7.4的Na2CO3缓冲液中并加入酶解体系,用0.5 mol/L的NaOH溶液维持pH在7.4。分别在10、30、60、90、120 min统计NaOH溶液的总消耗量,计算燕麦分离蛋白在肠消化中的DH,如公式(2)所示:
(2)
式中:V,滴定消耗的NaOH溶液体积,mL;c,NaOH溶液浓度,mmol/mL;αNH2(pH),氨基的平均解离度。
1.2.4 燕麦分离蛋白体外消化
为确保燕麦蛋白被胃蛋白酶和胰蛋白酶完全水解,参考1.2.3中酶与底物比例和酶解时间,消化时间定为2 h,此时得到耐消化肽纳米颗粒,不会被消化酶进一步水解。
模拟胃液(simulated gastric fluid, SGF):将250 mg胃蛋白酶分散在100 mmol/L的PBS中,调节pH至2.0并定容至500 mL。
模拟肠液(simulated intestinal fluid, SIF):将500 mg胰酶分散在100 mmol/L的PBS中,调节pH至7.4并定容至500 mL。
模拟体外消化:将1 g燕麦分离蛋白分散在50 mL 100 mmol/L的PBS中并调节pH至2.0,并另取50 mL SGF同时在37 ℃下温育5 min。将SGF加入蛋白分散液,在37 ℃下水浴振荡2 h。模拟胃消化结束后调节pH至7.4,并加入100 mL SIF,模拟肠消化2 h,并在消化结束后水浴煮沸5 min。离心除去不溶成分后,将上清液冻干得燕麦耐消化肽,于-20 ℃下密封保存。
1.2.5 燕麦肽纳米颗粒尺寸测定
将燕麦肽冻干粉分散在去离子水中,配成质量浓度1 mg/mL的溶液。静置0.5 h后,用动态光散射仪测定纳米颗粒的尺寸和多分散系数。
1.2.6 燕麦肽纳米颗粒形貌观测
通过透射电子显微镜观察,将燕麦肽配成质量浓度1 mg/mL的溶液,滴加10 μL纳米颗粒溶液于碳支持膜上,静置2 min后用质量分数1%的磷钨酸溶液染色,并在室温下自然干燥。在200 kV场加速电压下对纳米颗粒进行成像观察。
1.2.7 内部相互作用力分析
分别将1 mg燕麦肽溶解于十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(dithiothreitol,DTT)和尿素(Urea)的单一溶液和复合溶液中(SDS+DTT,DTT+Urea,SDS+Urea和SDS+DTT+Urea),其中SDS质量分数为0.5%、DTT浓度为30 mmol/L、Urea浓度为6 mol/L[11-12]。以去离子水为溶剂作为对照。
1.2.8 燕麦肽纳米颗粒表面活性评估
通过接触角测量仪测定水表面张力并对纳米颗粒的表面活性进行评估,测定方法为悬滴法。
1.2.9 燕麦肽-CAPE纳米颗粒制备及包封效果评估
制备:称取20 mg CAPE溶于1 mL乙醇中制成母液。配制10 mL燕麦肽溶液,加入100 μL CAPE乙醇溶液后,在超声细胞破碎仪中以240 W功率超声波处理5 min[12-13]。在1 000×g下离心2 min并重复5次,除去未被包封的CAPE。过饱和CAPE水溶液通过离心法制备。
包封率及载药量计算:取制备的燕麦肽-CAPE纳米颗粒溶液100 μL,用乙醇定容至1 mL。以CAPE乙醇母液配制1、5、10、15、20 μg/mL的CAPE乙醇溶液制作标准曲线。使用酶标仪测定载药纳米颗粒在323 nm波长下的吸光度值,根据标准曲线计算CAPE的包封率及载药量。同时测定并计算饱和CAPE水溶液中CAPE浓度。空载体溶液吸光度作为空白对照。包封率及载药量的计算如公式(3)、(4)所示:

(3)

(4)
1.2.10 燕麦肽-CAPE纳米颗粒胃肠消化特性
按1.2.9中的方法制备新鲜的燕麦肽-CAPE纳米颗粒,以体积比1∶1分别与SGF和SIF混合,取1 mL混合液置于10 kDa的透析袋,在9 mL不含酶的SGF和SIF中连续透析2 h,每隔30 min从外侧透析液中取1 mL并补充1 mL新透析液,测定释放出的CAPE质量。整个体外模拟消化在37 ℃振荡水浴中进行。胃肠消化各做3组平行,CAPE累计释放率计算如公式(5)所示:
(5)
1.2.11 燕麦肽-CAPE纳米颗粒稳态荧光光谱
配制多份10 mL质量浓度为2 mg/mL的燕麦肽纳米颗粒溶液,将浓度10 mmol/L的CAPE乙醇母液加入肽纳米颗粒溶液中,配制成CAPE浓度为0、5、10、20、40、60、80、100 mmol/L的燕麦肽-CAPE纳米颗粒溶液,并用超声法辅助包埋。设置激发波长为280 nm,激发光狭缝5 nm,发射光狭缝10 nm,扫描速度2 000 nm/min,扫描范围为300~450 nm,对各个浓度的燕麦肽-CAPE纳米颗粒溶液进行荧光光谱扫描,分别在25和37 ℃下以同样参数扫描。
1.2.12 统计分析
每次实验做3个平行,图表中的数据均以平均值±标准差的形式表示。显著性分析(P<0.05)由 SPSS 20.0软件分析后得到,不同的字母代表差异显著。用GraphPad Prism软件进行拟合分析并绘制成图。
2 结果与分析
2.1 燕麦分离蛋白组成成分分析
经测定,燕麦分离蛋白纯度为(75.69±0.14)%,残存油脂含量约为(10.57±0.00)%,多糖含量为(10.04±0.16)%。
2.2 燕麦分离蛋白水解度评估
用胃蛋白酶、胰酶和胰蛋白酶对燕麦分离蛋白进行水解并测定水解度,结果见图1。由于pH值在1.5 h后趋于稳定,选择2 h为体外模拟消化时间。胃蛋白酶酶解最终水解度为3.1%,胰酶为16.9%,胰蛋白酶为10.7%。由于胰脂肪酶水解油脂也会导致pH降低,这会导致蛋白在小肠的水解度计算值偏高。因此认为10.7%为燕麦分离蛋白肠消化的水解度。
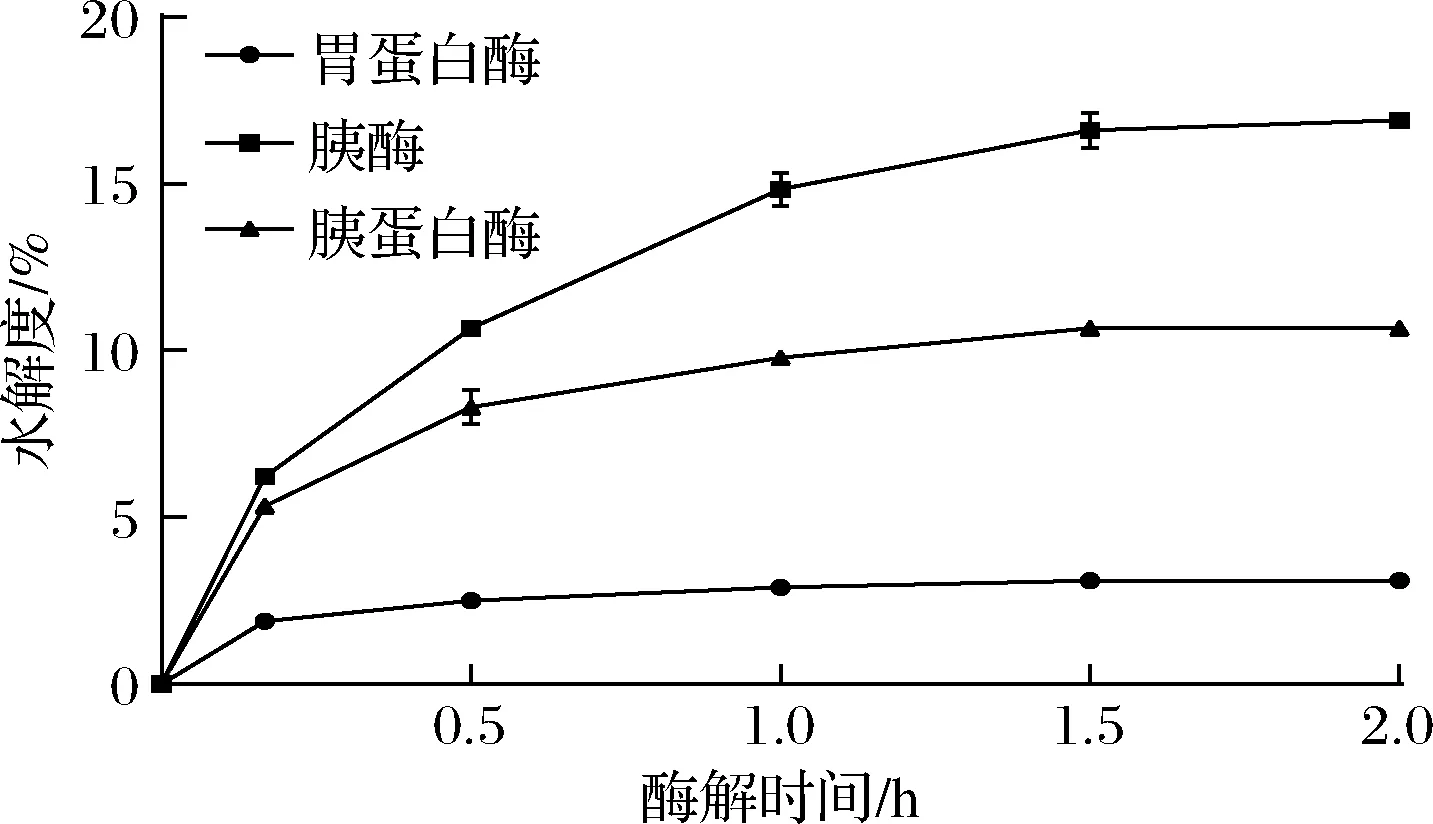
图1 燕麦分离蛋白水解曲线Fig.1 Hydrolysis curve of oat protein isolate
2.3 燕麦肽纳米颗粒的尺寸分析
大豆分离蛋白、玉米醇溶蛋白和乳清蛋白已被广泛研究证明通过酶解法制备纳米载体是合理且可靠的手段。DONG等[14]使用碱性蛋白酶水解大豆分离蛋白并通过超声辅助法制备了大豆聚集肽-EGCG纳米颗粒,尺寸约为87 nm。JIANG等[15]酶解α-乳清蛋白并用水解肽构建了具有pH响应性的纳米载体。本研究中燕麦耐消化肽被证明具有自组装能力,能够形成具有一定尺寸和结构的纳米颗粒。如图2所示,动态光散射结果显示燕麦蛋白消化后,自发形成尺寸为(51.80±1.62) nm的纳米结构。CHITHRANI等[16]的研究表明,纳米颗粒直径在50 nm左右被肠细胞摄取量最高。
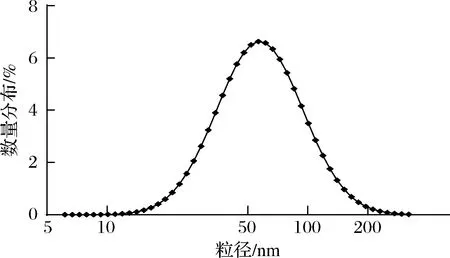
图2 燕麦肽纳米颗粒粒径分布Fig.2 Particle size distribution of oat peptide nanoparticles
图3中透射电子显微镜(1 μm尺度)可以观察到主要含有2种微粒结构。其中10~100 nm的纳米颗粒数量较多,可归类为胶束。小尺寸的纳米颗粒具有极高的比表面积,易吸附于大尺寸的纳米颗粒表面或者聚集成簇。同时可以观察到另一种囊泡结构,数量较少,但形状均匀,直径在500 nm以上。一般认为,小尺寸的胶束能够较顺利地穿过小肠黏液屏障,而大尺寸的囊泡难以进入黏液网络结构因而吸附在黏液表面。
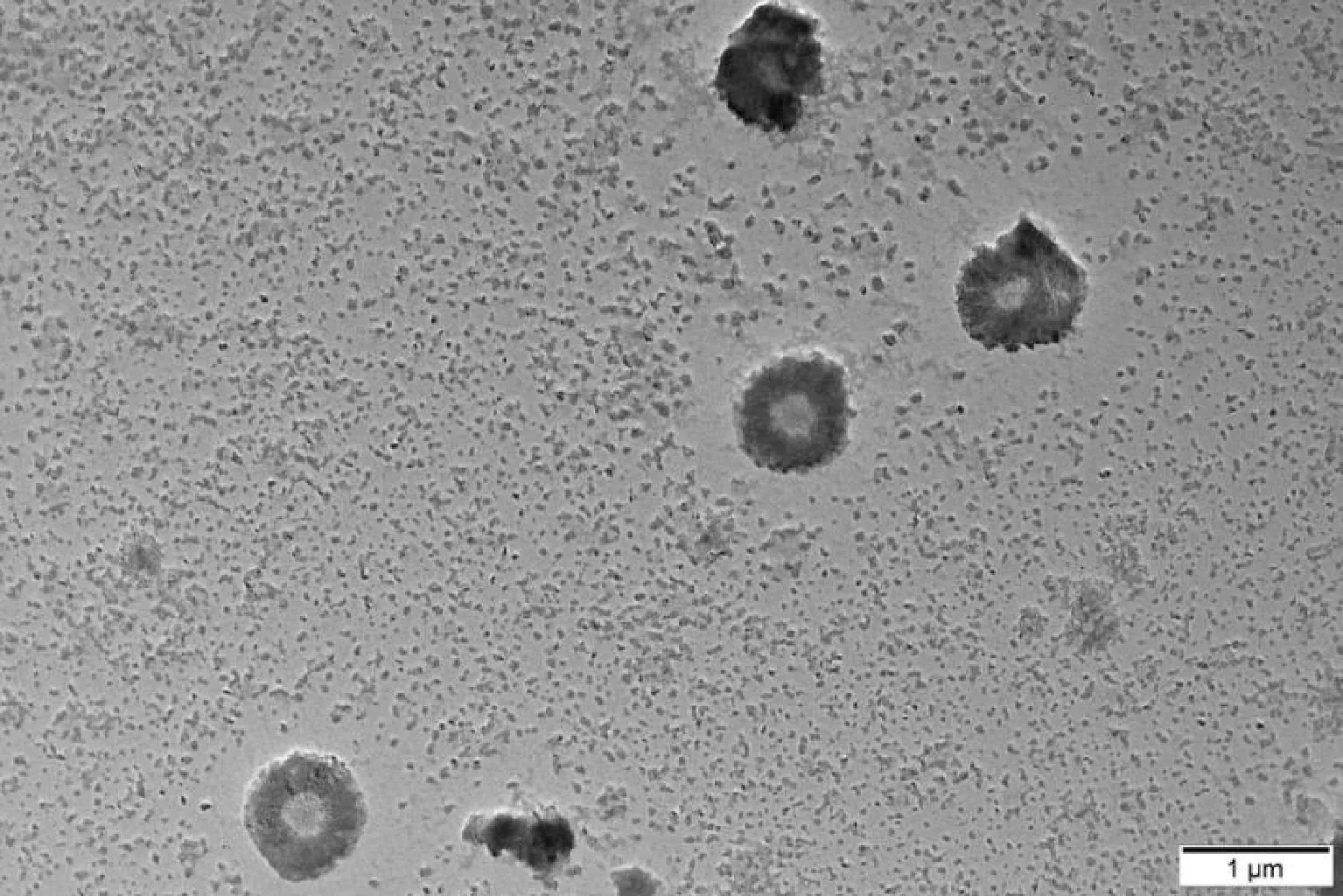
图3 燕麦肽纳米颗粒的TEM照片Fig.3 TEM photographs of oat peptide nanoparticles
2.4 燕麦肽纳米颗粒内部相互作用
氢键、疏水相互作用、静电作用、范德华力是肽自发聚集形成纳米结构的主要驱动力[17],二硫键在蛋白/肽结构中也有着重要作用。如图4所示,单独或复合使用3种蛋白变性剂得到的结果显示,疏水作用是燕麦肽纳米颗粒形成的主要驱动力[18-20]。变性剂诱导的纳米颗粒尺寸变化可分析颗粒内部相互作用(P<0.05),单独使用SDS变性剂使得纳米颗粒尺寸略微变大但并不显著,而单独使用尿素变性剂纳米颗粒尺寸没有变化。SDS和尿素复配使用时纳米颗粒尺寸显著变大,这是因为2种变性剂对疏水作用的破坏效果叠加,原本纳米颗粒内部较为致密紧凑的结构变得松散。当SDS、DTT和尿素共同作用时,相比于SDS和尿素复配使用纳米颗粒的尺寸显著变小。这可能是因为当SDS和尿素破坏疏水作用后,二硫键依然存在并阻止整个纳米颗粒分裂成较小的颗粒。进一步添加DTT破坏二硫键后,得到的纳米颗粒碎片虽然和原始纳米颗粒尺寸相当,但这些碎片结构更加松散。因此可以初步判断,整个纳米颗粒形成的主要驱动力为疏水相互作用,而二硫键对结构稳定也起一定作用。
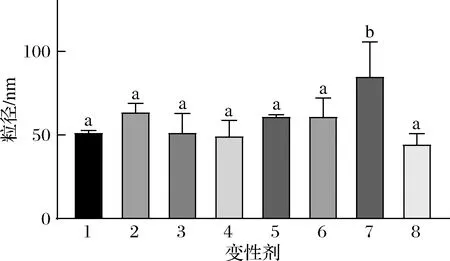
1-水;2-十二烷基硫酸钠;3-二硫苏糖醇;4-尿素;5-十二烷基硫酸钠+二硫苏糖醇;6-二硫苏糖醇+尿素;7-尿素+十二烷基硫酸钠;8-十二烷基硫酸钠+二硫苏糖醇+尿素图4 不同变性剂处理后燕麦肽纳米颗粒尺寸Fig.4 Size of oat peptide nanoparticles treated with different denaturants
2.5 燕麦肽纳米颗粒表面性质
纳米颗粒的表面性质对其应用具有重要的参考价值[21]。燕麦肽溶液中一部分表面疏水的纳米颗粒和一些具有疏水性的多肽在液滴中难以相对稳定地做布朗运动,这些溶质趋向于逃逸,因此会在短时间内吸附在气-液表面。这种逃逸行为产生的力与表面张力相反,因此可以认为疏水性越强,其降低表面张力的能力越强。图5-a表明,燕麦肽溶液随着肽浓度的增大,其空气-水表面张力逐渐减小,在肽质量浓度1 mg/mL时表面张力约为53 mN/m。燕麦蛋白溶液在蛋白质量浓度1 mg/mL时表面张力为41 mN/m,显然酶解后燕麦肽纳米颗粒的亲水性大大增强。水解增强了肽的柔性,使纳米颗粒表面的亲水氨基酸增多。燕麦肽纳米颗粒表面具有一定疏水性,能够降低水的表面张力,这可能是由于纳米颗粒在界面吸附时诱发表层肽的去折叠[22-24]。而图5-b中,随着燕麦肽浓度的逐渐增大十六烷-水界面张力逐渐减小,显然燕麦肽纳米颗粒对油脂类有一定亲和性。总体来说,燕麦肽纳米颗粒具有优良的表面活性,其亲疏水性适中,作为天然无毒的材料有着较广泛的使用前景。
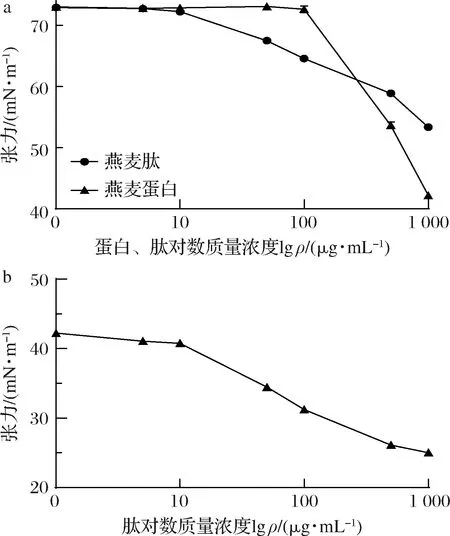
a-燕麦蛋白、燕麦肽纳米颗粒空气-水表面张力;b-燕麦肽纳米颗粒十六烷-水界面张力图5 燕麦肽纳米颗粒的界面吸附Fig.5 Interfacial adsorption of oat peptide nanoparticles
2.6 燕麦肽-CAPE纳米颗粒包载力评估
CAPE中的酯键在一定条件下会自发水解,而酚羟基则容易诱导氧化反应。作为壁材的燕麦肽具有一定抗氧化性,能够保护内部的CAPE。经计算得燕麦肽-CAPE纳米颗粒的包封率为(71.71±3.21)%,载药量为(3.59±0.16)%。包封后CAPE在水中分散质量浓度能达到140 μg/mL,而测定CAPE在水中的溶解度为(1.80±0.11)μg/mL,因此燕麦肽纳米颗粒可以有效提升CAPE在水中的分散性。这可能与CAPE中苯环的结构有关,一般认为苯丙氨酸、色氨酸和酪氨酸3种芳香族氨基酸具有最强的疏水性,CAPE中的苯环和燕麦肽中的苯环能够在相互接近时形成π-π共轭结构,增强燕麦肽-CAPE纳米颗粒的结构稳定性[25]。
2.7 燕麦肽-CAPE纳米颗粒耐消化性评估
消化酶水解制备的燕麦耐消化肽纳米载体具有耐消化性。如图6所示,燕麦肽-CAPE纳米颗粒在模拟胃肠液中连续消化2 h,CAPE的累计释放率较小,其中在模拟胃液中释放23%,在模拟肠液中释放7%。由于绝大部分可被胰蛋白酶和胃蛋白酶水解的肽键已被水解,燕麦肽-CAPE纳米颗粒在模拟消化液中受消化酶影响较小。在模拟胃液中累计释放率比模拟肠液中的累计释放率高,主要原因可能是pH较低引起纳米颗粒内部静电相互作用的改变,整体结构变得更疏松。通常胃排空所需时间为15 min~4 h,燕麦耐消化肽纳米颗粒将消化酶对蛋白质基纳米载体的结构破坏作用最小化。
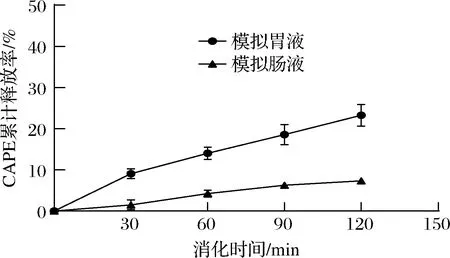
图6 燕麦肽-CAPE纳米颗粒体外模拟消化Fig.6 Simulated digestion of oat peptide nanoparticles loading CAPE in vitro
2.8 燕麦肽-CAPE纳米颗粒荧光光谱分析
蛋白质/多肽的内源性荧光主要来自苯丙氨酸、色氨酸、酪氨酸3种含有苯环的芳香族氨基酸残基。如图7所示,随着猝灭剂CAPE含量的增大,燕麦肽纳米颗粒的最大荧光值减小且最大吸收波长红移,这是由于氨基酸残基微构像发生了变化,芳香族氨基酸残基转向纳米颗粒内部。

图7 激发波长280 nm条件下不同浓度CAPE对燕麦肽纳米颗粒荧光发射光谱的影响Fig.7 Effects of different concentrations of CAPE on fluorescence emission spectra of oat peptide nanoparticles
CAPE猝灭荧光的方式可分为静态猝灭和动态猝灭2种,具体猝灭类型可通过Stern-Volmer方程拟合分析[8],如图8所示。
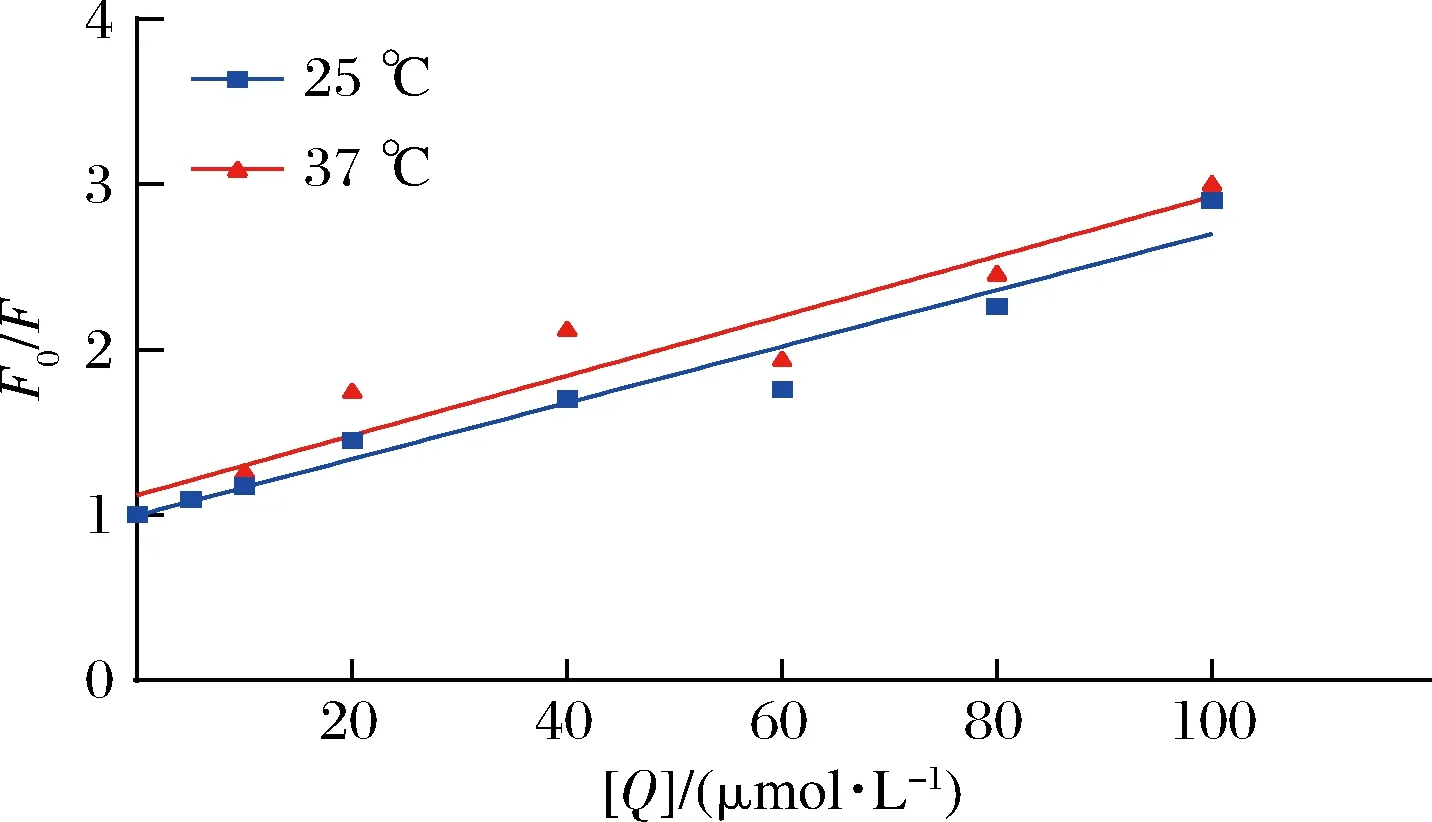
图8 不同温度下CAPE与燕麦肽纳米颗粒相互作用的Stern-Volmer拟合曲线Fig.8 Stern-Volmer fitting curve of interaction between CAPE and oat peptide nanoparticles at different temperatures
由表1看出,Kq高出最大值2×1010L/(mol·s)两个数量级,据此判读猝灭类型为静态猝灭,燕麦肽和CAPE形成了不发荧光的复合物。使用双对数Stern-Volmer模型分析小分子与蛋白质的结合常数KA和结合位点数n,如表2所示,经计算n值均接近1,这表明CAPE分子与肽有一个结合位点。表3结果显示,ΔS和ΔH均大于0,表明疏水作用是分子结合的主要驱动力,并且ΔG的值越大,相互作用越强[26]。
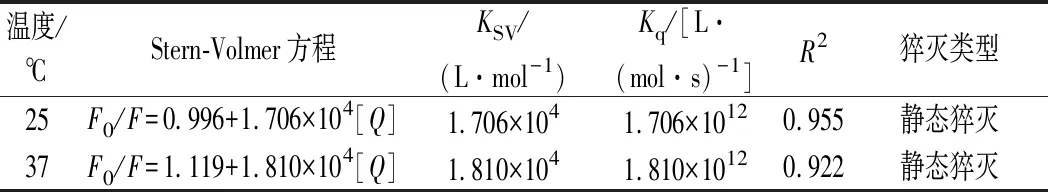
表1 不同温度条件下CAPE与燕麦肽结合的Stern-Volmer的KSV和KqTable 1 Stern-Volmer constant KSVand biomolecular quenching constant Kqfor the interaction between CAPE and oat peptide nanoparticles at different temperatures

表2 不同温度下CAPE与燕麦肽结合的KA和nTable 2 Binding constant KA and numbers of binding sites n for interaction between CAPE and oat peptides at different temperatures

表3 不同温度下CAPE与燕麦肽结合的热力学参数Table 3 Thermodynamic parameters of interaction between CAPE and oat peptides at different temperatures
3 结论
本研究以燕麦蛋白为研究对象,通过酶水解法改性燕麦蛋白增强水溶性,透射电子显微镜照片和动态光散射结果表明制备的燕麦肽纳米颗粒主要为尺寸50 nm的球形胶束。燕麦蛋白经过胃蛋白酶消化水解度为3.1%,胰蛋白酶消化水解度为10.7%。进一步研究其结构特征,接触角测试结果表明燕麦肽纳米颗粒表面具有一定的疏水性和亲油性,具有较好的乳化特性。通过分析变性剂破坏纳米颗粒后的尺寸变化,结果显示燕麦肽自组装形成纳米颗粒的主要驱动力为疏水相互作用。以咖啡酸苯乙酯为模型药物评估燕麦肽纳米颗粒的包封效果,包封率为71%,载药量为3.5%,体外模拟消化表明该纳米颗粒具有良好的耐消化特性。燕麦肽-CAPE纳米颗粒的稳态荧光光谱分析表明疏水相互作用是CAPE与肽分子结合主要作用力。本研究为探索肽自组装的机制问题提供了一定理论依据,且验证了燕麦肽作为一种新型纳米载体的潜力。

