产β-葡萄糖苷酶乳酸菌益生特性研究
冯程程,蔡子哲,陈琼,欧仕益,谢小冬,汪勇,MARTIN J T REANEY,张宁*
1(暨南大学 食品科学与工程系,广东 广州,510632)2(广东省油料生物炼制与营养安全国际联合研究中心,广东 广州,510632)3(暨南大学-萨斯喀彻温大学“油料生物炼制与营养”联合实验室,广东 广州,510632) 4(广州市微生物研究所有限公司,广东 广州,510663)5(加拿大萨斯喀彻温大学 农业与生物资源学院,加拿大 萨斯卡通,S7N5A8)
β-葡萄糖苷酶能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[1]。β-葡萄糖苷酶的应用非常广泛,包括使木酚素、大豆异黄酮、人参皂苷和虎杖苷等糖苷类物质脱去糖基转化为具有更高生物利用度的苷元[2];将水果、果汁中的糖苷键合态物质水解为具有香气的萜烯醇类化合物以及芳香醇氧化物,从而起到酶解增香作用[3];和α-L-鼠李糖苷酶组成柚苷酶,可用于水解柑橘类果实中重要的苦味物质柚皮苷,有效减少食品的苦涩味[4];应用于水解β-糖苷键,生产具有防龋齿、提神、抗疲劳等功效的低聚糖(如龙胆糖)[5];以及催化葡萄糖和脂肪醇生成易生物降解、环境友好的非离子表面活性剂烷基糖苷[6],具有巨大的生物技术应用前景。
β-葡萄糖苷酶广泛存在于自然界中,利用微生物产β-葡萄糖苷酶繁殖周期短,成本低,利于工业化生产,其中黑曲霉产β-葡萄糖苷酶效率较高[7]。然而,霉菌的使用会影响产品的风味,且一般需要制成酶制剂再添加到食品中。与霉菌相比,乳酸菌作为益生菌具有益生功效,而且可以直接加入食品体系[8]。
益生菌必须耐受胃液的强酸性环境,以保证顺利抵达人体肠道,黏附并定植在肠道内,才能发挥益生作用[9]。本研究以3株乳酸菌为对象,研究其不同碳源诱导下的β-葡萄糖苷酶活力,通过耐受模拟人工胃肠液、耐胆盐、自聚集及疏水性、溶血性、抗生素药敏性等试验进行益生特性研究,以期为开发优良的高产β-葡萄糖苷酶的益生菌菌株提供理论支持。
1 材料与方法
1.1 菌株
植物乳植杆菌(Lactiplantibacillusplantarum)C1和C5,课题组自有菌株;坚强肠球菌(Enterococcusdurans)GW18275,广州市微生物研究所。
1.2 材料与试剂
胃蛋白酶、胰蛋白酶、MRS肉汤、哥伦比亚血琼脂平板,广东环凯生物科技有限公司;Na2CO3、二甲苯、纤维二糖、对硝基苯酚-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG)、对硝基苯酚(p-nitrophenol,p-NP),上海麦克林生化科技有限公司;胆盐,上海源叶生物科技有限公司;MRS琼脂培养基、无糖MRS肉汤,青岛海博生物技术有限公司;抗生素药敏纸片,广州科原仪器设备有限公司;正己烷、乙酸乙酯,广东光华科技股份有限公司。
1.3 仪器与设备
Alpha-1506紫外可见分光光度计,上海谱元仪器有限公司;DSX-24L-1手提式高压蒸汽灭菌锅,上海申安医疗器械厂;CJ-1D超净工作台,泰斯特仪器有限公司;KDC-220HR高速冷冻离心机,安徽中科中佳科学仪器有限公司;HCS-165A-A BOD生化培养箱,广州恒创实验仪器有限公司。
1.4 试验方法
1.4.1 乳酸菌在MRS-纤维二糖平板生长状况
无糖MRS琼脂培养基中加入20 g/L纤维二糖制成MRS-纤维二糖平板,将3株乳酸菌于MRS-纤维二糖平板划线,37 ℃培养24~48 h,观察菌株是否生长。
1.4.2 乳酸菌β-葡萄糖苷酶活力测定
将菌株以2%(体积分数)的接种量接种于5 mL碳源分别为葡萄糖和纤维二糖的MRS肉汤培养基中活化18 h,将菌液在4 ℃下6 000 r/min离心10 min,取离心沉淀用生理盐水溶液洗涤2次后,加入1 mL生理盐水混匀作为粗酶液。取100 μL粗酶液加入1.8 mL乙酸-乙酸钠缓冲液在37 ℃下水浴5 min,然后加入100 μL底物p-NPG(20 mmol/L),空白组改用100 μL缓冲液替代粗酶液。反应30 min之后加入1 mL 1 mol/L的Na2CO3溶液终止反应。离心除去菌体,400 nm下测量其紫外吸收,参考钱超[1]的方法绘制标准曲线。酶活力单位(U)定义为上述条件下,每分钟催化生成1 μmol对硝基苯酚所需的酶量。酶活力的计算如公式(1)所示:
(1)
式中:U,酶活力,U/mL;c,p-NP的浓度,μmol/L;V,反应体系的体积,L;N,原酶液稀释倍数;t,反应时间,min;0.1,所取上清液或细胞液的体积。
1.4.3 溶血性
将乳酸菌菌株于体积分数5%的羊血哥伦比亚血琼脂平板划线,37 ℃培养24 h,观察菌株在平板上的溶血情况[10]。
1.4.4 抗生素敏感性
根据PISANO等[11]的方法,采用纸片扩散法评估乳酸菌的抗生素敏感性。选择了5类共10种抗生素:头孢菌素类(头孢拉定、头孢噻肟、头孢他啶)、四环素类(四环素)、氨基糖苷类(新霉素、卡那霉素、庆大霉素、阿米卡星)、β-酰胺类(青霉素)、大环内酯类(阿奇霉素)。将每种乳酸菌菌株100 μL涂抹在MRS琼脂平板上,并将含有相应抗生素的纸片放在平板上。37 ℃培养48 h后,测量抑菌区的直径。
1.4.5 模拟胃肠液耐受性
根据SON等[12]的研究对乳酸菌菌株对模拟胃肠道液体耐受性进行评估。培养过夜的乳酸菌菌株4 ℃下6 000 r/min离心10 min,PBS洗涤2次,用缓冲液调整菌体浓度,制成在600 nm下吸光值约为1.000的菌悬液。参考《中国药典》2010版配制模拟胃肠液,量取1 mol/L HCl溶液20 mL,用NaOH溶液将其pH调至3,加入胃蛋白酶使其终浓度为10 g/L,0.22 μm微孔滤膜除菌制成模拟胃液。将1 mL待测菌悬液接种于9 mL pH=3.0的人工胃液中,37 ℃孵育3 h。测定活菌数,计算存活率。取KH2PO46.8 g,加水500 mL使之溶解,用NaOH溶液将其pH调至6.8;另取胰蛋白酶10 g,加水适量溶解,将两液混合后,加水稀释至1 000 mL,0.22 μm微孔滤膜除菌制成模拟肠液。将1 mL人工胃液消化的悬液接种于9 mL pH=6.8的人工模拟肠液中,在37 ℃下培养4 h,测定活菌数,存活率按公式(2)计算:
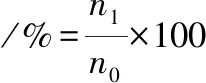
(2)
式中:n1,菌株处理后的活菌数,CFU/mL;n0,菌株初始活菌数,CFU/mL。
1.4.6 胆盐耐受性
将培养过夜的乳酸菌菌株接种于含3 g/L胆盐的MRS肉汤中,37 ℃孵育4 h。用MRS琼脂平板计数法测定菌株的存活率[12]。存活率按公式(3)计算:
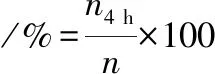
(3)
式中:n4 h,菌株处理后的活菌数,CFU/mL;n,初始活菌数,CFU/mL。
1.4.7 自聚集率
将调整浓度后的乳酸菌菌悬液于37 ℃分别放置4和24 h,分别在0、4、24 h时,在600 nm处测定上清液吸光度[13]。自聚集率按公式(4)计算:
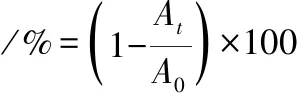
(4)
式中:At,处理4或24 h的吸光度;A0,乳酸菌菌悬液初始吸光度。
1.4.8 疏水性
参照KLAYARAUNG[14]的方法,选择二甲苯、正己烷、乙酸乙酯3种有机溶剂测试菌株疏水性。将3 mL调整浓度后的乳酸菌菌悬液与1 mL有机溶剂混合涡旋振荡2 min,37 ℃静置3 h分离水相与有机相,取水相测其吸光度。疏水性的计算如公式(5)所示:
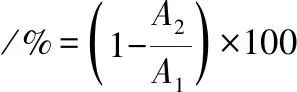
(5)
式中:A1,乳酸菌菌悬液初始吸光度;A2,水相吸光度。
1.4.9 活菌数的测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》的方法,取1.0 mL待测菌液与9.0 mL的0.85%(质量分数)的生理盐水混匀,梯度稀释至10-5、10-6、10-7,取稀释液100 μL,涂布于MRS琼脂平板,37 ℃培养24~48 h,计算乳酸菌活菌数。
1.4.10 数据分析与处理
试验均重复进行3次,以平均值±标准差表示。数据采用Excel 2010进行处理,使用SPSS 26进行方差分析,使用Origin 2018进行图形绘制。
2 结果与讨论
2.1 乳酸菌在MRS-纤维二糖平板生长状况
3株乳酸菌均可在以纤维二糖为碳源的MRS平板生长(图1),说明3株乳酸菌产生的β-葡萄糖苷酶均具有水解纤维二糖的能力。
a-L.plantarum C1;b-L.plantarum C5;c-E.durans GW18275图1 乳酸菌于MRS-纤维二糖平板划线生长状况Fig.1 Growth of lactic acid bacteria on MRS-cellobiose plate
2.2 不同碳源诱导β-葡萄糖苷酶活力
分别研究了以葡萄糖、纤维二糖为碳源对乳酸菌产酶的影响。如图2所示,纤维二糖为碳源诱导菌株产β-葡萄糖苷酶活力显著高于葡萄糖为碳源时的β-葡萄糖苷酶活力(P<0.05)。葡萄糖为碳源时L.plantarumC5有最大β-葡萄糖苷酶活力3.74 U/mL,E.duransGW18275酶活力为2.49 U/mL,L.plantarumC1酶活力最小为2.37 U/mL。纤维二糖为碳源时,E.duransGW18275酶活力最大,为16.02 U/mL,L.plantarumC5酶活力为5.55 U/mL,L.plantarumC1酶活力为5.26 U/mL。纤维二糖诱导使乳酸菌产生的β-葡萄糖苷酶活力显著升高,说明产生的β-葡萄糖苷酶为诱导酶。根据其底物特异性β-葡萄糖苷酶可分为3类:一类可以水解烃基β-葡萄糖苷和芳香基β-葡萄糖苷,一类只能水解烃基β-葡萄糖苷,还有一类只能水解芳香基团糖苷[15]。本研究的3株乳酸菌产的β-葡萄糖苷酶同时具有能水解烃基糖苷(纤维二糖)和芳香基糖苷(p-NPG)的能力,具有广泛的底物特异性。
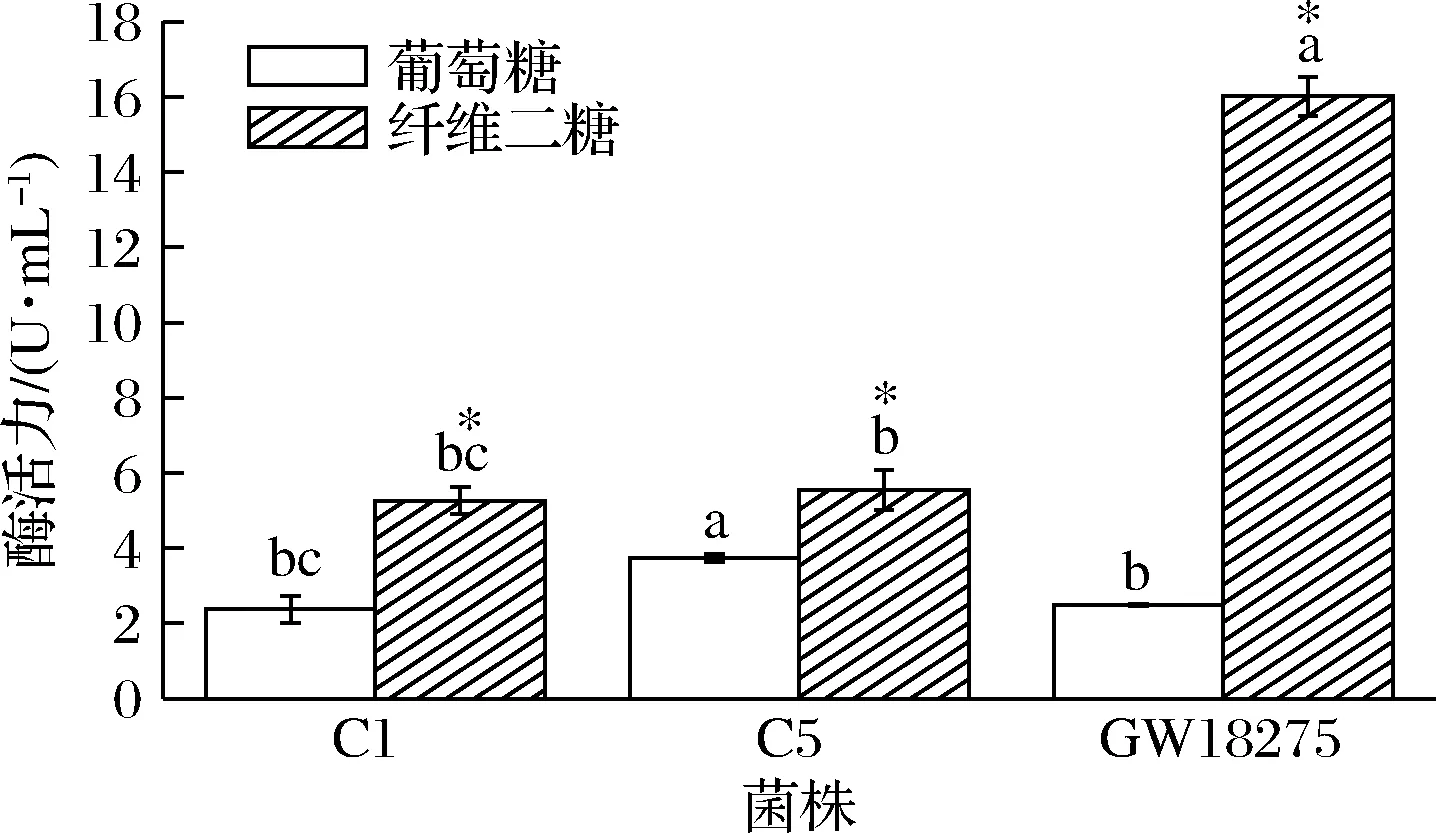
图2 乳酸菌分别由葡萄糖和纤维二糖诱导的β-葡萄糖苷酶活力Fig.2 β-glucosidase activity induced by glucose or cellobiose of lactic acid bacteria注:*表示不同碳源之间的显著性差异(P<0.05),不同小写字母表示不同菌种同一碳源间差异性显著(P<0.05)
2.3 益生特性研究
2.3.1 溶血性
溶血性分3类:α-溶血特点是菌落周围有草绿色溶血圈,对人致病力差;β-溶血特点是菌落周围出现透明溶血圈,对人致病力强;γ-溶血即不溶血,菌落周围培养基没有变化[16]。ARGYRI等[16]发现大部分乳酸菌均不具有溶血性,只有少量乳酸菌具有对人体致病能力较低的α-溶血。本研究中3株乳酸菌于哥伦比亚血琼脂平板上没有溶血现象(图3),因此,菌株是非溶血性的。
a-L.plantarum C1;b-L.plantarum C5;c-E.durans GW18275图3 菌株在哥伦比亚血琼脂平板上的溶血性Fig.3 Hemolysis of strains on Columbia blood agar plates
2.3.2 抗生素敏感性
对抗生素的敏感性是评价益生菌安全性的标准之一。如表1所示,3株菌均对阿米卡星、阿奇霉素、头孢拉定、四环素敏感。L.plantarumC1对头孢他啶、卡那霉素、青霉素不敏感。L.plantarumC5对头孢噻肟、头孢他啶不敏感。而E.duransGW18275对头孢噻肟、庆大霉素、卡那霉素、新霉素和青霉素均不敏感。
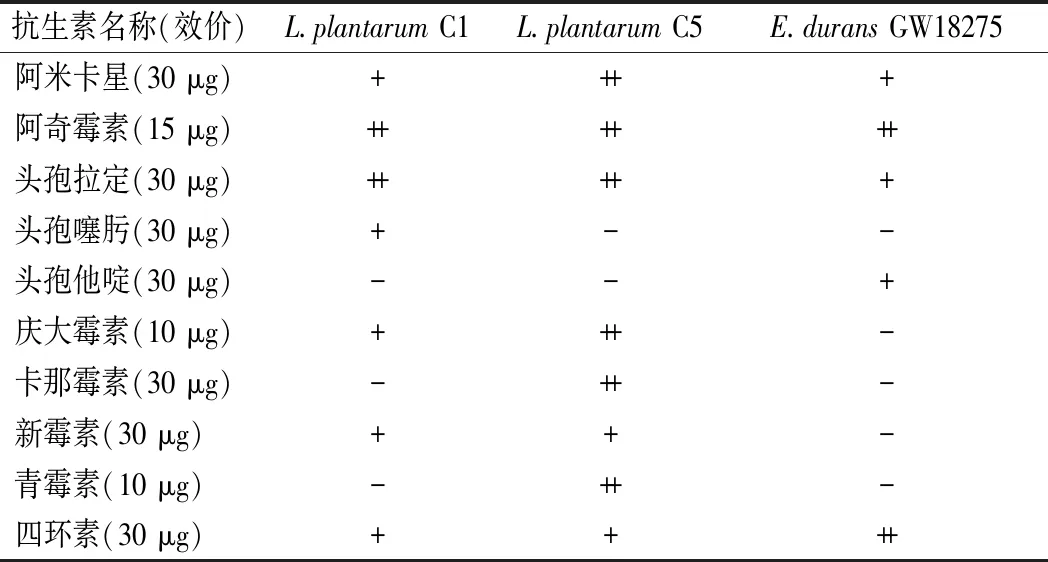
表1 乳酸菌对不同抗生素的敏感性Table 1 Sensitivity of strains of lactic acid bacteria to different antibiotics
益生菌菌株对抗生素的敏感性有重要要求,因为益生菌菌株中存在的抗生素耐药基因可能转移到致病菌菌株中[17]。但也有研究认为抗生素耐药性转移的发生率非常低[18]。有研究表明乳酸菌菌株对β-内酰胺类、四环素类和大环内酯类抗生素敏感,但对氨基糖苷类抗生素耐药[19]。本研究中3株乳酸菌对头孢菌素类、β-酰胺类及氨基糖苷类抗生素有不同的药敏性,对四环素敏感。许女等[20]对传统发酵食品中分离的97株乳酸菌的抗生素耐药性进行评估,发现乳酸菌对庆大霉素、卡那霉素和四环素的耐药性较强,耐药率达50%以上。L.plantarumC1和L.plantarumC5在抗生素药敏性方面具有较好的安全性,而E.duransGW18274的耐药性应引起重视,建议加强抗菌药物的规范使用,减少耐药菌株的使用和传播[21]。
2.3.3 模拟胃肠液耐受性
益生菌必须通过胃的应激条件(低pH值1.5~3,持续3 h)才能达到肠道发挥益生作用[22],3株乳酸菌在模拟胃肠液中的存活率如表2所示。3株乳酸菌在模拟胃液中的存活率均高于60%以上,其中,L.plantarumC1有最佳耐受模拟胃肠液能力,经模拟胃液处理3 h后活菌数为3.00×108CFU/mL,存活率为(88.24±7.20)%,且其在模拟肠液中存活率为(101.11±5.67)%,几乎不影响其存活。L.plantarumC5经模拟胃液和肠液处理存活率分别为(79.25±13.19)%和(53.10±12.52)%,但活菌数均在108CFU/mL左右,在肠道内还能发挥益生菌的有益作用。E.duransGW18275在胃液中存活率为(62.96±13.86)%,在肠液处理中存活率(29.50±4.17)%。益生菌经胃肠道处理后活菌数至少达106CFU/mL才能产生有益作用[23]。而本研究中3株乳酸菌经过模拟胃肠液消化后活菌数均在106CFU/mL以上,具有较强的肠胃道耐受能力。

表2 乳酸菌在模拟胃肠液中的存活率Table 2 Survival rate of lactic acid bacteria in simulated gastroenteric fluid
2.3.4 胆盐耐受性
对胆盐的耐受性是细菌在宿主小肠中定植和代谢活动的先决条件,这有助于乳酸菌到达小肠和结肠,促进肠道菌群的平衡[24]。MULAW等[25]从发酵的埃塞俄比亚食品中分离的乳酸菌耐受3 g/L胆盐的存活率为24.30%~97.22%。本研究中L.plantarumC1、L.plantarumC5、E.duransGW18275均有良好的生存能力,存活率分别为(71.53±8.73)%、(83.70±6.21)%和(70.59±8.66)%,说明其具有良好的耐受胆盐的能力。
2.3.5 自聚集率
自聚集是生物膜形成的一个重要特性, 乳酸菌生物膜通过保护胃肠道转运中的菌株,产生抗菌化合物和刺激免疫应答从而进行肠道定植[13]。3株乳酸菌的自聚集率如表3所示。所有乳酸菌菌悬液在37 ℃下放置4 h,自聚集率在18%~25%,在37 ℃放置24 h,自聚集率在50%~81%。L.plantarumC1在24 h时具有最高的自聚集率(80.72±1.58)%,其次为L.plantarumC5 (63.92±0.66)%,E.duransGW18275自聚集率最低。SHEKH等[13]测定的10株菌中,2株鼠李糖乳杆菌孵育2 h的自聚集率分别为14%和30%,其余8株植物乳杆菌孵育2 h的自聚集率在3%~20%,并且随着孵育时间的增加,自聚集率会明显增加,与本文研究结果一致,本试验中3株乳酸菌有较强的自聚集率,具有可促进形成胃肠道防御屏障的潜能。
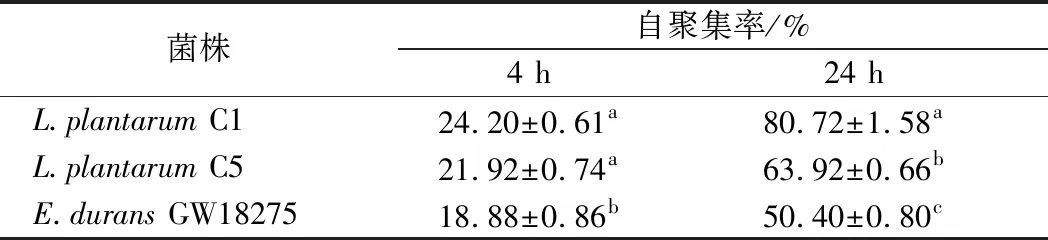
表3 乳酸菌的自聚集率Table 3 Auto-aggregation rate of lactic acid bacteria
2.3.6 疏水性
细菌表面疏水性是指细菌在极性水中所呈现的不稳定状态,从而引起一系列菌体的重新分布及排列的变化,疏水性被认为与多种黏附现象有关,益生菌发挥益生功效的关键在于其能够黏附于宿主肠道黏膜细胞表面[26-27]。不同细菌、同种细菌不同菌株与有机相吸附的能力并不相同,菌株表面结构不同会导致表面疏水性的差异[28]。菌株疏水性结果如表5所示。L.plantarumC1和L.plantarumC5对乙酸乙酯有最佳疏水性[(56.50±1.30)%和(56.50±1.30)%],何杉杉等[29]对8株乳酸菌疏水性进行评价发现菌株对乙酸乙酯的疏水性均较高,对正己烷的疏水性处于较低水平。在本研究中,E.duransGW18275对正己烷的疏水率较弱为(8.81±1.24)%,而对二甲苯和乙酸乙酯的疏水性略高,这与文献报道的肠球菌一般不具有较高的疏水性结果一致[30],说明该坚强肠球菌的非特异性黏附能力不强。
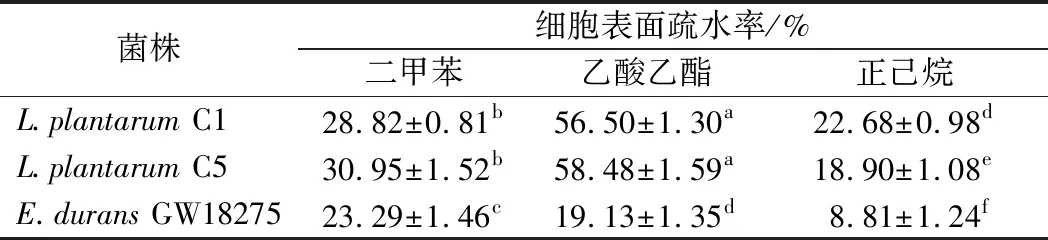
表4 乳酸菌细胞表面疏水性Table 4 Cell surface hydrophobicity of lactic acid bacteria
3 结果与讨论
本研究使用的3株乳酸菌均能产生水解烃基β-葡萄糖苷和芳香基β-葡萄糖苷的β-葡萄糖苷酶,具有广泛的底物特异性。通过纤维二糖对3株乳酸菌进行诱导可显著提高其产生的β-葡萄糖苷酶活力,E.duransGW18275在纤维二糖诱导时具有最大酶活力(16.02 U/mL)。3株乳酸菌可用于糖苷类生物活性物质的脱糖基转化以提高生物利用度,以及用于酶解增香等食品领域。此外,3株乳酸菌显示出主要的益生菌特性,包括对胃肠道消化及胆盐的耐受能力,较好的自聚集及疏水性,可为日后开发同时具有生物活性物质和益生功效的混合益生制剂提供理论依据,在功能食品等领域具有潜在的应用价值。

