混菌发酵、酒泥陈酿结合β-葡聚糖酶对赤霞珠干红葡萄酒有机酸含量的影响
刘晓燕,张小月,阿卜杜喀依尔·阿卜杜艾尼,曲一鸣,闵海东,李学文*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052)2(圣元国际北京营养研究院,北京,101125)
新疆地区属于干旱和半干旱型气候区域,具有光照充足、昼夜温差大的自然特点,因此酿酒葡萄长势强、产量高、品质好、含糖量高,但酸度较低[1],而酸度作为葡萄酒感官品质的重要组成部分,会对葡萄酒的风味、味道、颜色和香气等产生影响,葡萄酒中常见酸有酒石酸、苹果酸、柠檬酸,以及发酵过程中产生的乳酸、乙酸、琥珀酸[2]。增加葡萄酒酸度通常有化学增酸、离子交换法增酸和生物法增酸,其中生物增酸主要是利用产酸型非酿酒酵母与酿酒酵母混合发酵增加酸度[3-4],混合发酵还对葡萄酒香气的提升具有贡献作用[5-6],随着非酿酒酵母逐渐被人们所接受,可将其应用于葡萄酒的初期发酵和其他果酒的发酵来改善酒的风味物质组成,如增加甘油、总酸、挥发性酯类含量,降低乙酸含量,形成稳定的吡喃花青素等,进而改善酒的整体品质[7-9]。
根据国际葡萄与葡萄酒组织(Organisation Internationale de la vigne et du Vin, OIV)统计,2019年中国葡萄酒产量83万t,产生废弃酒泥约1.7~2.6万t,酒泥富含酒石酸盐、蛋白质、多糖、多酚等物质,化学需氧量非常高且具有很高的生物降解性,直接排放污染环境,也浪费生物资源[10]。酒泥陈酿是葡萄酒酿造工艺中一种新兴技术,葡萄酒在发酵结束后与酒泥接触一定时间,在酶作用下生成酵母自溶物[11],其主要是由微生物(主要是酵母菌)以及少量的酒石酸和无机盐组成的[12],通过酒泥中的酵母细胞吸附毒枝菌素,减少了氧化的可能和香气的损失[13],同时改善葡萄酒的稳定性[14]。适当的酒泥陈酿可以增加葡萄酒的圆润度和结构感[15-16]。酵母自溶是一个非常缓慢的过程,添加某些富含β-葡聚糖酶的专业酶制剂可以在一定程度上加速酵母的自溶,促进有益酵母多糖的释放以缩短上市周期[17],不同酵母菌发酵后获得的酒泥所含有益物质存在明显差异,因此将混菌发酵与酒泥陈酿结合改善葡萄酒品质与合理利用“废弃物”具有一定的研究意义。
关于葡萄酒混菌发酵后酒泥陈酿中有机酸含量的研究相对较少,本试验以实验室自酿葡萄酒为原料,将其在混菌发酵后的酒泥上陈酿60 d,通过高效液相色谱法检测葡萄酒中7种有机酸含量,分析添加非酿酒酵母混菌发酵后酒泥陈酿对干红葡萄酒有机酸含量的影响,进而分析葡萄酒品质差异,以期为葡萄酒品质提升以及酵母、酒泥的选择利用提供理论依据。
1 材料与方法
1.1 材料与试剂
葡萄原料:赤霞珠葡萄含糖量(以还原糖计) 251.00 g/L,可滴定酸含量(以酒石酸计)5.25 g/L,2020年9月采自新疆天山北麓产区冰湖酒庄。
酿酒酵母(Saccharomycescerevisiae)MST、耐热克鲁维酵母(Kluyveromycesthermotolerans)CT10、布鲁塞尔德克酵母(Dekkerabruxellensis)PL09、β-葡聚糖酶,上海鼎唐国际贸易有限公司;酿酒酵母(Saccharomycescerevisiae)F33、酒酒球菌(Oenococcusoeni),法国 Laffort公司。
酒石酸、丙酮酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸(色谱纯,纯度≥98%),新疆宝信源柏生物技术有限公司;超纯水实验室自制;KH2PO4、磷酸(分析纯),天津市致远化学试剂有限公司;甲醇(色谱纯),天津市北联精细化学品开发有限公司。
1.2 仪器与设备
LE204E/02电子天平,梅特勒-托利多仪器上海有限公司;UPHW-III-90T超纯水机,四川优普超纯科技有限公司;SK8200B超声波清洗器,上海科导超声仪器有限公司;LC-20AB高效液相色谱仪、SPD-M20A紫外检测器、色谱数据处理系统、自动进样器、柱温箱,日本岛津;3H16RI智能高速冷冻离心机,湖南赫西仪器装备有限公司。
1.3 色谱条件
参照王燕等[18]的方法,略做修改。色谱柱:Athena C18-WP(120 A,4.6 mm×250 mm,5 μm);流动相:含1%甲醇(体积分数)和0.02 mol/L KH2PO4溶液,磷酸调pH 2.8;等度洗脱;流速0.8 mL/min;柱温30 ℃;进样体积10 μL;λ=210 nm。
1.4 标准溶液的配制
分别称取标准品L-酒石酸、丙酮酸、L-苹果酸、L-乳酸、乙酸、柠檬酸、琥珀酸10 mg,用流动相溶解定容至10 mL,得到各标准品含量为1 mg/mL的混合标准溶液,按梯度稀释为所需浓度,于4 ℃下保存备用。
1.5 葡萄酒的酿造与处理
1.5.1 赤霞珠干红葡萄酒的酿造与酒泥陈酿处理
赤霞珠酿酒葡萄去除杂质,除梗破碎后入60 L不锈钢桶(装罐量约80%),添加SO2(30 mg/L),分别接入活化好的非酿酒酵母CT10、PL09,每隔5 h进行1次循环操作,48 h后分别接入活化好的酿酒酵母MST、F33,即CT10与MST(CM)顺序接种,PL09与F33(PF)顺序接种进行常温(22~24 ℃)发酵,酒精发酵结束后接入乳酸菌启动苹果酸-乳酸发酵(malolactic fermentation, MLF)(18~20 ℃),发酵结束后添加SO2(60 mg/L)终止发酵,去除皮渣,分别对葡萄酒进行体积比4∶1的酒泥陈酿,另设添加富含β-葡聚糖酶液(酶活力30 000 U/mL,添加量50 mL/t)处理组促进酒泥自溶,不添加酒泥为对照组,60 d后分离酒泥取样分析。具体分组见表1。
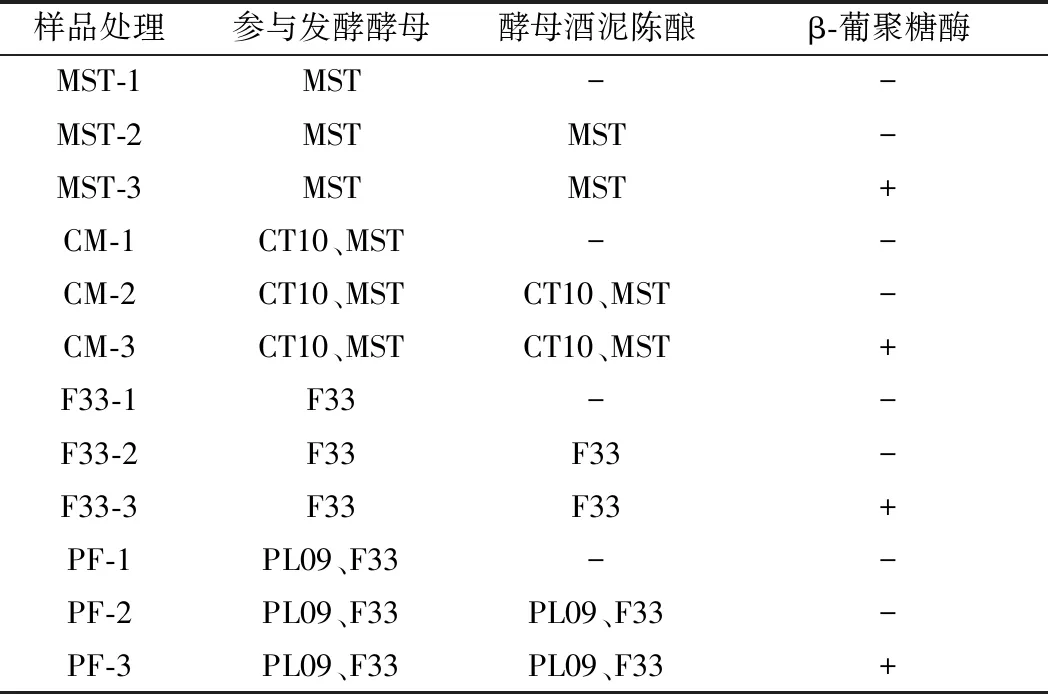
表1 试验处理Table 1 Test treatments
1.5.2 待测样品处理
参照马旭艺等[19]的方法,12 000 r/min、4 ℃冷冻离心15 min后超声,经0.45 μm滤膜过滤,用流动相稀释后进样分析。
1.6 数据处理
通过Excel 2010进行数据统计,利用SPSS 20.0对数据进行显著性分析,应用Origin 9.0软件绘图。
2 结果与分析
2.1 有机酸标准曲线制作
以7种有机酸的混合标准液的6种不同浓度为x,在上述试验条件下检测分析得到相应的峰面积y,做线性回归处理后得到表2所示的线性方程,7种有机酸的相关系数为0.999 1~1.000 0,线性关系良好,以3倍性噪比计算样品的检出限为 0.171 6~2.835 5 mg/L。7种有机酸标准品及葡萄酒样品中相应酸的高效液相色谱图见图1。
2.2 方法回收率与精密度
由表3可知7种有机酸的平均回收率为95.82%~100.79%,相对标准偏差小于1.31%,准确度与精密度满足本试验所需要求。
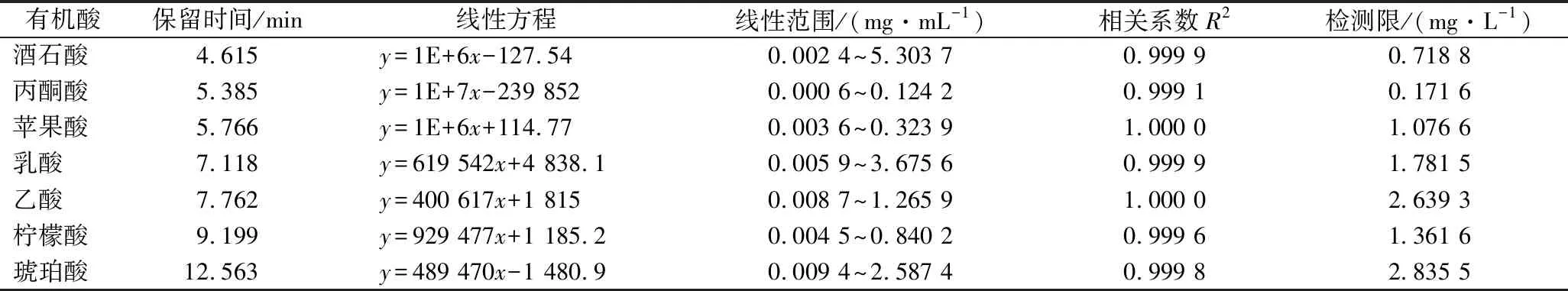
表2 七种有机酸标准品回归方程与检出限Table 2 Regression equation and detection limit of 7 kinds of organic acid standard products
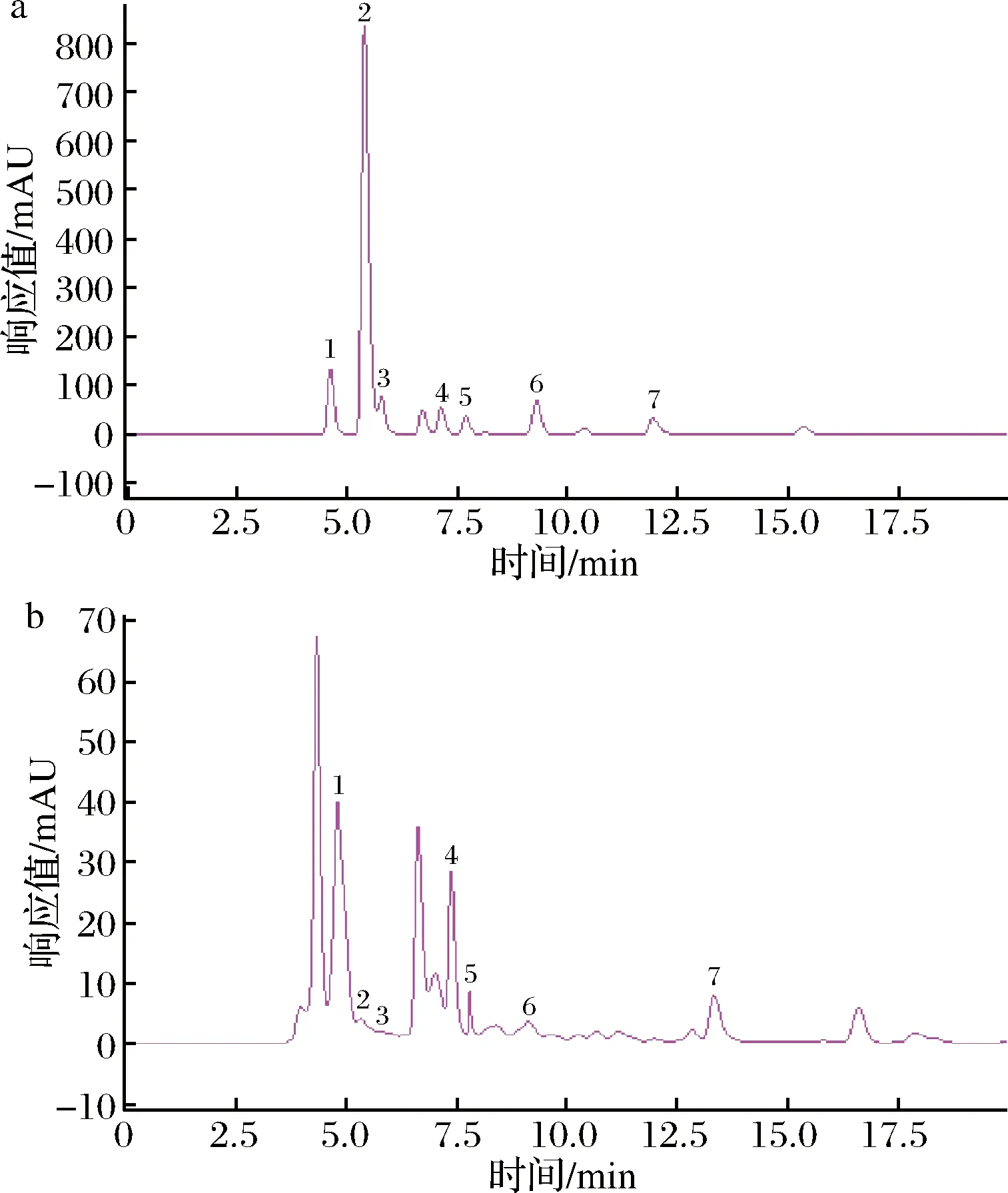
a-有机酸标准品;b-葡萄酒样品1-酒石酸;2-丙酮酸;3-苹果酸;4-乳酸;5-乙酸;6-柠檬酸;7-琥珀酸图1 有机酸标准品和葡萄酒样品有机酸高效液相色谱图Fig.1 High performance liquid chromatography of standards and organic acids in wine samples
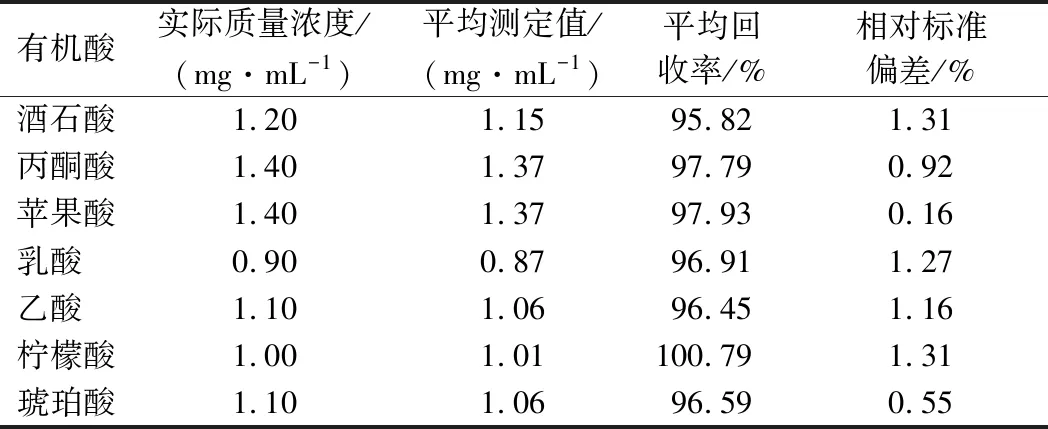
表3 添加质量浓度、回收率与精密度Table 3 Concentration, recovery rate and precision of the method
2.3 不同处理对赤霞珠干红葡萄酒中有机酸含量的影响
2.3.1 混菌发酵对赤霞珠干红葡萄酒有机酸含量的影响
如图2所示,混菌发酵对酒样中丙酮酸含量有积极作用,其中PF-1显著高于MST-1,且PF-1即混菌发酵消耗了更多的苹果酸,而产生了更多的乳酸,CM-1比MST-1增加12.66%,PF-1比F33-1增加16.07%(P<0.05),混菌发酵比单一酿酒酵母发酵产生了更多的乙酸(P<0.05),其中CM-1酒石酸含量比MST-1增加11.17%(P<0.05),整体而言,混菌发酵对赤霞珠干红葡萄酒中有机酸总量有积极影响,CM-1比MST-1增加13.02%,PF-1比F33-1增加5.37%,由此也体现出增酸非酿酒酵母CT10增酸作用明显,显著高于其他处理组(P<0.05)。
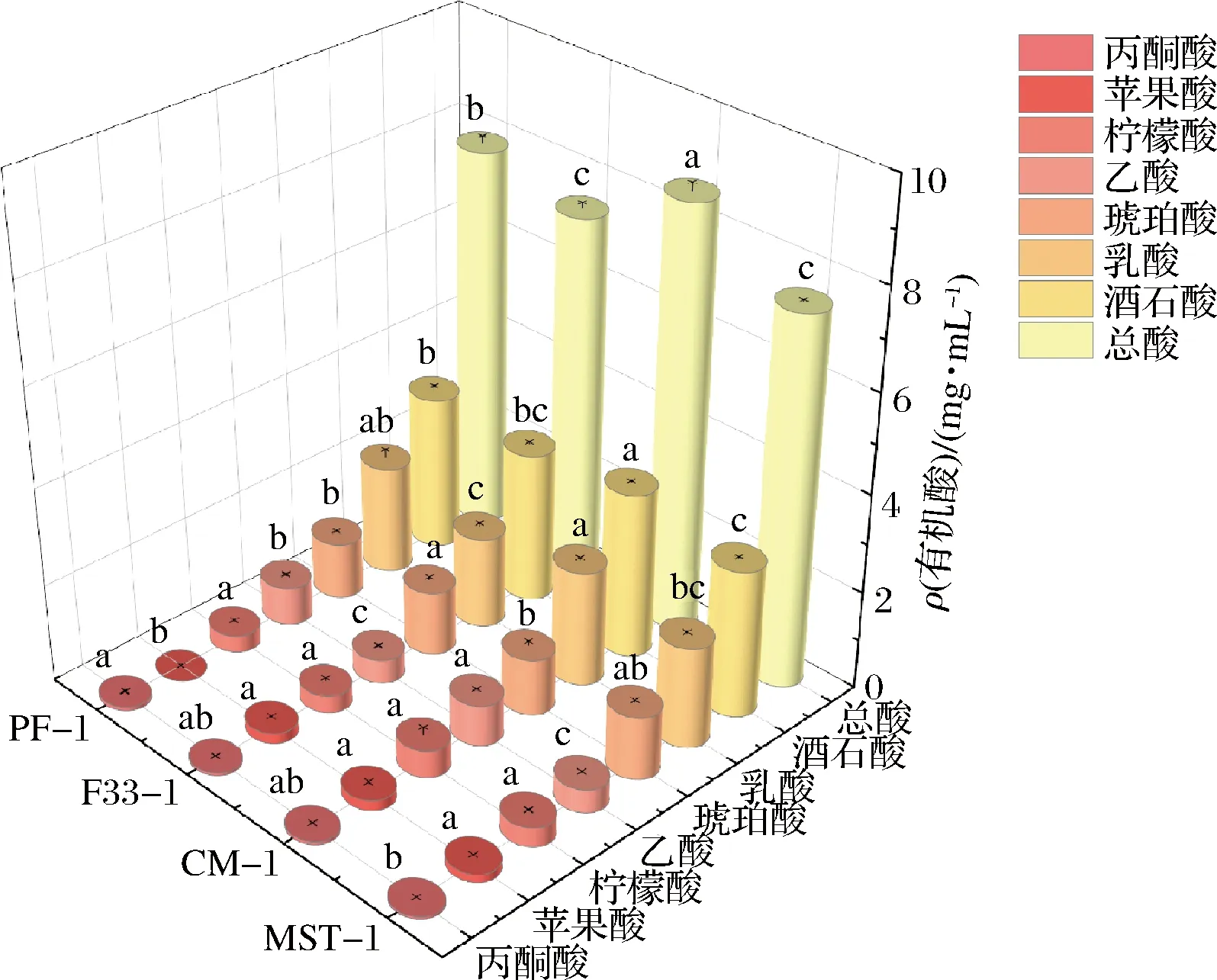
图2 混菌发酵赤霞珠干红葡萄酒有机酸含量Fig.2 Organic acid content of mixed fermentation Cabernet Sauvignon dry red wines注:不同小写字母表示各处理间差异显著(P<0.05)(下同)
2.3.2 混菌发酵后酒泥陈酿对赤霞珠干红葡萄酒有机酸含量的影响
如图3所示,经酒泥陈酿后丙酮酸、柠檬酸、琥珀酸含量出现下降现象,其中PF-2琥珀酸含量比F33-2降低14.18%(P<0.05),PF-2比F33-2乙酸含量高出32.43%,在酒泥陈酿过程中保持上升的有相对含量较高的乳酸和酒石酸,其中CM-2比MST-2的乳酸含量增加5.58%,PF-2比F33-2的乳酸含量增加19.18%,酒石酸含量增加7.06%(P<0.05),酒泥陈酿后葡萄酒中7种有机酸总量有显著性差异,其中PF-2总含量最高,比F33-2高出10.52%(P<0.05),而CM-2与MST-2无显著差异。
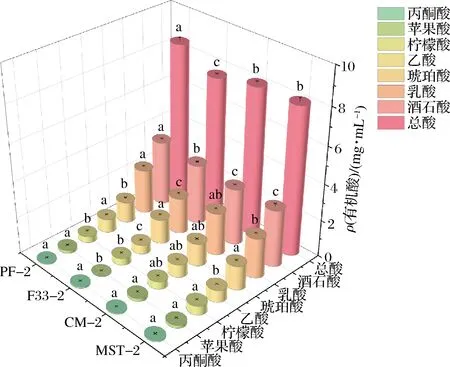
图3 酵母酒泥陈酿赤霞珠干红葡萄酒有机酸含量Fig.3 Organic acid content of Cabernet Sauvignon dry red wines aged in yeast mash
2.3.3 混菌发酵后酒泥陈酿结合β-葡聚糖酶处理对赤霞珠干红葡萄酒有机酸含量的影响
如图4所示,丙酮酸含量下降,最终F33-3含量最高;CM-3苹果酸含量比MST-3下降了28.57%,柠檬酸含量降低23.40%,乙酸含量比MST-3高出14.81%,PF-3比F33-3高出32.47%,琥珀酸含量降低,其中F33-3含量最高,乳酸含量在陈酿后增加,CM-3比MST-3增加9.92%,PF-3比F33-3增加16.25%,同样保持增加的有酒石酸,其中PF-3比F33-3增加4.66%(P<0.05)。添加β-葡聚糖酶的变化规律与酒泥陈酿相似,但差异更显著,说明在β-葡聚糖酶的作用下,葡萄酒中有机酸的含量及构成发生变化。
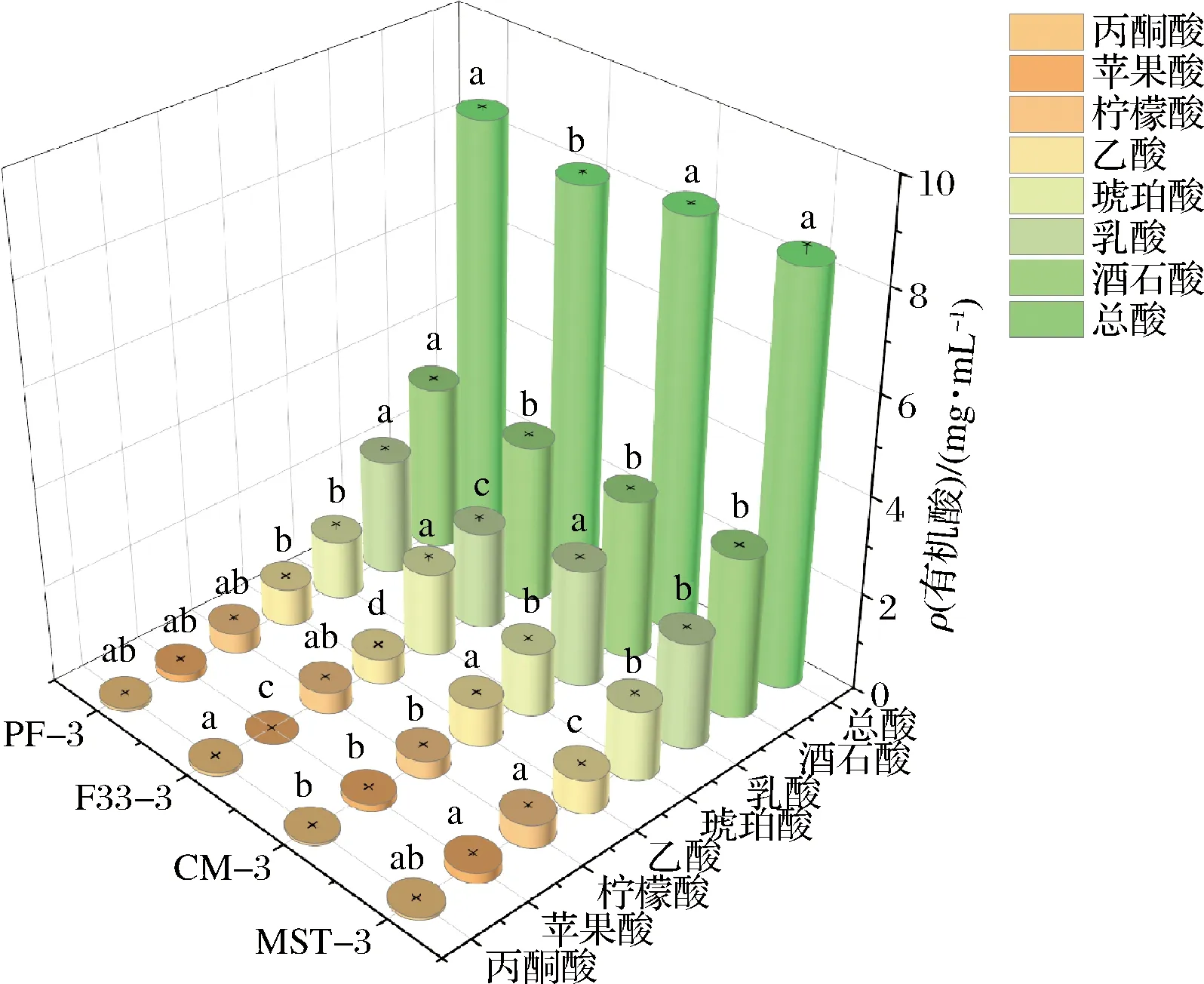
图4 酵母酒泥结合β-葡聚糖酶处理赤霞珠干红葡萄酒有机酸含量Fig.4 Organic acid content of Cabernet Sauvignon dry red wines treated by yeast mash combined with β-glucanase
2.3.4 各处理对赤霞珠干红葡萄酒有机酸含量影响的比较
如表4所示,混菌发酵后不同酒泥陈酿结合β-葡聚糖酶处理对葡萄酒中酒石酸含量有显著影响,检测结果显示其在7种有机酸中含量最高,约占总含量的38.59%~43.47%,样品处理中酒石酸含量MST-3>MST-2>MST-1,而CM-1酒石酸含量显著高于CM-2和CM-3,且CM-3>CM-2,酵母F33各处理组中酒石酸含量为F33-2>F33-3>F33-1,PF混菌酒泥陈酿处理则与之有相同规律,且显著高于F33各处理,酒泥陈酿可以保留葡萄酒中更多的酒石酸,特别是添加β-葡聚糖酶处理。混菌发酵可提升丙酮酸含量,PF-1显著高于F33-1,酿酒酵母酒泥陈酿后丙酮酸含量增加,F33-2、F33-3比F33-1显著提升(P<0.05)。陈酿后苹果酸含量出现下降。混菌发酵和酒泥陈酿均可产生更多的乳酸,MST-2、MST-3比MST-1提升5.90%、5.05%,MST与CT10混菌发酵与酒泥陈酿后乳酸含量可增加5.58%~12.66%,F33与PL09混菌发酵与酒泥陈酿后乳酸含量可增加16.07%~19.18%,由此可以看出混菌酒泥陈酿比单一酿酒酵母酒泥陈酿产生乳酸的效果更加显著,β-葡聚糖酶的添加促进了这种现象。经过混菌酒泥陈酿后酒样乙酸含量下降,CM-2比CM-1下降15.47%,PF-2比PF-1下降6.33%(P<0.05),说明酒泥陈酿能够吸附葡萄酒中的醋酸菌,改善葡萄酒品质;CM-1比MST-1柠檬酸含量高出28.57%,而PF-1与F33-1柠檬酸含量一致,这可能是CT10增酸所引起的现象,而通过酒泥陈酿和β-葡聚糖酶处理后,柠檬酸含量均有小幅提升,但CM处理出现下降现象且差异显著(P<0.05)。混菌发酵降低了琥珀酸含量,CM-1比MST-1减少10.08%,PF-1比F33-1减少11.45%,经β-葡聚糖酶处理后琥珀酸含量升高5.69%~23.84%,其中F33-3与F33-1提升23.84%差异显著(P<0.05)。混菌发酵增加了有机酸总含量,CM-1比MST-1提升13.02%,PF-1比F33-1提升5.37%;酒泥陈酿处理中MST-2比MST-1增加6.73%,CM-2比MST-1总酸含量增加6.62%(P<0.05),PF-2比PF-1增加4.73%,PF-2比F33-2增加10.52%,比F33-1增加12.53%(P<0.05);酒泥陈酿结合β-葡聚糖酶处理中MST-3比MST-2、MST-1分别增加3.84%、10.31%,CM-3比MST-1总酸含量增加10.53%(P<0.05),F33-3比F33-2、F33-1分别增加6.08%、8.19%,比PF-1增加7.67%,PF-3比F33-3增加4.84%,比F33-1增加12.63%(P<0.05)。
3 讨论与结论
有机酸是葡萄酒结构的重要组成部分,其中酒石酸是葡萄酒中呈酸涩味的特有有机酸[20],在7种有机酸中含量最高,本研究结果显示混菌发酵可提高酒石酸含量,在此基础上进行酒泥陈酿、添加β-葡聚糖酶处理效果更加明显,这是因为酒泥降解产生的多糖限制了葡萄酒中酒石酸的沉淀[21],且酒石酸具有抗分解作用,很少受到葡萄酒微生物的攻击,因此酿酒师在葡萄醪中添加较稳定的酒石酸[22]。样品中混菌发酵、酿酒酵母酒泥陈酿后可增加丙酮酸含量,研究发现,混合发酵能够有效促进葡萄糖苷特定前体物丙酮酸、乙醛等产量的增加[23],因此能够提高稳定色素的葡萄糖苷的合成[24];而混菌发酵酒泥陈酿以及β-葡聚糖酶处理后丙酮酸含量减少,在葡萄酒老化过程中,丙酮酸的减少可能是由于形成了其他化合物。吡喃花青素色素在花青素结构上显示出一个额外的吡喃环,被鉴定为丙酮酸亲核加成的结果[25],而丙酮酸是乳酸菌代谢的产物,也可由苹果酸和乳酸氧化产生[26]。苹果酸在葡萄中以及酒精发酵结束时含量较多,而经过MLF后含量逐渐减少,MLF是大多数葡萄酒生产中重要的二次发酵,通常由乳酸菌在酒精发酵完成之后进行,将尖锐的L-苹果酸转化为柔和的L-乳酸,通过乳酸菌残留的营养物质提高微生物的稳定性,可促进葡萄酒在乳酸菌次级代谢中的感官调节[27],样品中混菌发酵、酒泥陈酿以及结合β-葡聚糖酶处理可以依次提升葡萄酒中乳酸含量,这种现象可以使葡萄酒的口感更加圆润[20]。乙酸含量过高则会严重影响葡萄酒的品质[28],而检测结果显示混菌发酵和酿酒酵母酒泥陈酿均会引起乙酸的增加,前者可能是因为发酵初期非酿酒酵母发酵能力弱[29]所引起的,混菌酒泥陈酿与结合β-葡聚糖酶处理均使乙酸含量下降,说明酒泥自溶过程中吸附了对葡萄酒有消极影响的醋酸菌,能够改善葡萄酒品质。柠檬酸是三羧酸循环的中间产物[20],可以溶解Fe3+形成可溶性络合物,可防止葡萄酒的铁破败病,在酒精发酵过程会产生少量柠檬酸,MLF过程中乳酸菌则会消耗柠檬酸产生乙酸、乙偶姻和CO2等[30]。研究结果显示,与增酸非酿酒酵母CT10混合发酵可提升柠檬酸含量,但其含量经过酒泥陈酿后减少,而与增香非酿酒酵母PL09混合发酵则呈相反变化。琥珀酸是糖在葡萄酒发酵过程中产生的副产品,会使葡萄酒的味道有咸味、苦味和酸味[28],试验结果显示酒泥陈酿以及结合β-葡聚糖酶处理后琥珀酸含量升高,且与增酸非酿酒酵母结合处理的效果更显著,高水平的脉冲电场老化葡萄酒时使琥珀酸二乙酯水解,琥珀酸含量升高[22],酒泥陈酿过程中可能也发生了这样的反应。酒泥陈酿处理中除CM处理外,其他各组经酒泥陈酿后总酸含量均增加了2.25%~7.57%,添加β-葡聚糖酶的处理组增加更为明显,增幅达到7.67%~10.31%。综上,混菌发酵与酒泥陈酿有利于葡萄酒中总酸含量的提升,β-葡聚糖酶的添加使这种现象更加明显,史红梅等[11]发现贵人香葡萄酒经酒泥陈酿后有机酸总量提升,与本研究结果相似。
此外,酒泥陈酿过程中酵母发生自溶现象,细胞膜破裂内溶物被释放产生核苷、核苷酸、氨基酸、肽、葡聚糖、甘露糖蛋白等,增加葡萄酒的结构感和圆润度,提高澄清度[12];葡萄酒存在颜色褪色快的问题,史红梅等[31]利用不同酵母酒泥陈酿提高了蛇龙珠葡萄酒的颜色指标,增强颜色的稳定性。葡萄酒中农药残留问题是影响葡萄酒品质和健康的一大因素,酒泥陈酿过程中吸附农药,大幅降低残留量,改善葡萄酒的香气物质,李明月等[15]研究发现带细酒泥陈酿对红提葡萄酒风味有一定的积极影响。MAZA等[16]发现酒泥陈酿可降低葡萄酒涩感、软化单宁,从而达到修饰口感的作用。但是酒泥自溶速度较慢,陈酿工艺把控不好会出现葡萄酒感染杂菌、产生不愉快的酒糟味等问题,因此在加速酒泥自溶速度的研究中出现多种解决方法,例如超声、脉冲电场、商业甘露糖蛋白代替等[16],但都存在经济或实际条件限制的问题,还需进一步研究寻找较好的解决方法和符合实际的推广技术。
本研究通过酿酒酵母MST、F33分别与增酸非酿酒酵母CT10、增香非酿酒酵母PL09混菌发酵后进行酒泥陈酿,并添加β-葡聚糖酶促进酒泥自溶,采用高效液相色谱法检测样品中7种有机酸含量,结果显示混菌发酵与酒泥陈酿均对葡萄酒中有机酸含量有提升作用,其中酒石酸、乳酸、乙酸以及总酸的变化差异性较为显著,与CT10混酿后酒泥陈酿在β-葡聚糖酶的作用下,会更有利于有机酸的保留与产生,与PL09混菌发酵后酒泥陈酿可以使有机酸生成的代谢活动加强,使其含量增加;酿酒酵母酒泥陈酿后,有机酸总量增加,与混菌发酵酒泥陈酿的差异性减小,说明酒泥陈酿可以使葡萄酒中的物质发生变化,促进有机酸的产生,使葡萄酒口感平衡,达到增酸的目的,因此合理利用混菌发酵后的酒泥结合β-葡聚糖酶处理进行陈酿对葡萄酒有机酸的提升效果显著,具有一定的应用价值。

