不同产地柴胡的皂苷含量和ITS序列比较△
周蕾,为盼盼,韩文静,万河妨,江伟,骆骄阳*,隋春*
1.中国医学科学院 北京协和医学院 药用植物研究所 中草药物质基础与资源利用教育部重点实验室/濒危药材繁育国家工程实验室,北京 100193;
2.尚药堂大健康产业集团有限公司,天津 301600
柴胡始载于《神农本草经》[1],具有疏散退热、疏肝解郁、升举阳气的功效,用于感冒发热、寒热往来、胸胁胀痛、月经不调、子宫脱垂、脱肛等症[2]。现代药理研究表明,柴胡具有抗抑郁、抗炎、镇痛、护肝、抗肿瘤等药理作用[3]。《中华人民共和国药典》(以下简称《中国药典》)2020 年版规定柴胡药材为伞形科植物柴胡Bupleurum chinenseDC.或狭叶柴胡B.scorzonerifoliumWilld.的干燥根,分别习称“北柴胡”和“南柴胡”[2]。柴胡作为常用大宗中药材之一,资源分布较为广泛,主要源于栽培,主产于山西、河北、甘肃、四川等地[4],形成了各产地特色栽培种质。
不同产地柴胡药材的有效成分含量差异较大[5]。有研究表明,不同产地柴胡中皂苷含量最大相差10倍[6];柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f 总质量分数为5.32%~13.9%[7]。柴胡的基原鉴定一直存在争议,普遍认为山西、河北、河南和陕西主产北柴胡,黑龙江主产南柴胡,四川主要是引种北柴胡、三岛柴胡及当地的竹叶柴胡,甘肃除了种植北柴胡外还种植银州柴胡[7],同一地区也可能存在不同种的柴胡。基于柴胡种植范围广、地域环境和栽培种质差异大,本研究收集了山西、甘肃、四川地区的柴胡药材,测定了其皂苷含量及内转录间隔区(ITS)序列,结合两方面的数据,为分析地域因素和栽培种质对柴胡品质的影响、柴胡资源的收集评价和新品种选育提供借鉴。
1 材料
1.1 药材
28 份不同产地的柴胡药材,样品编号和来源见表1,典型药材横切面图见图1。样品经中国医学科学院药用植物研究所隋春研究员鉴定,9号为伞形科柴胡属纤细柴胡Bupleurum gracillimumKlotzsch,1、11、12、16号为北柴胡B.chinenseDC.,2、19、21、24号为狭叶柴胡B.scorzonerifoliumWilld.,5~8、10、14、15、25 号为竹叶柴胡B.marginatumWall.ex DC.,其余为太白柴胡B.dielsianumWolff。其中山西省18批(7批类似a形态、5批类似e形态、2批类似f形态、4批类似g形态)、甘肃省5批(3批类似b形态、1 批类似h 形态、1 批类似a 形态)、四川省5 批(3 批类似d 形态、2 批类似c 形态)。不同产地的柴胡在横截面形态上有一定差异,主要表现在边缘是否平坦、断面是否显纤维性、中间髓大小、内皮层颜色、放射状纹理排列方式等。
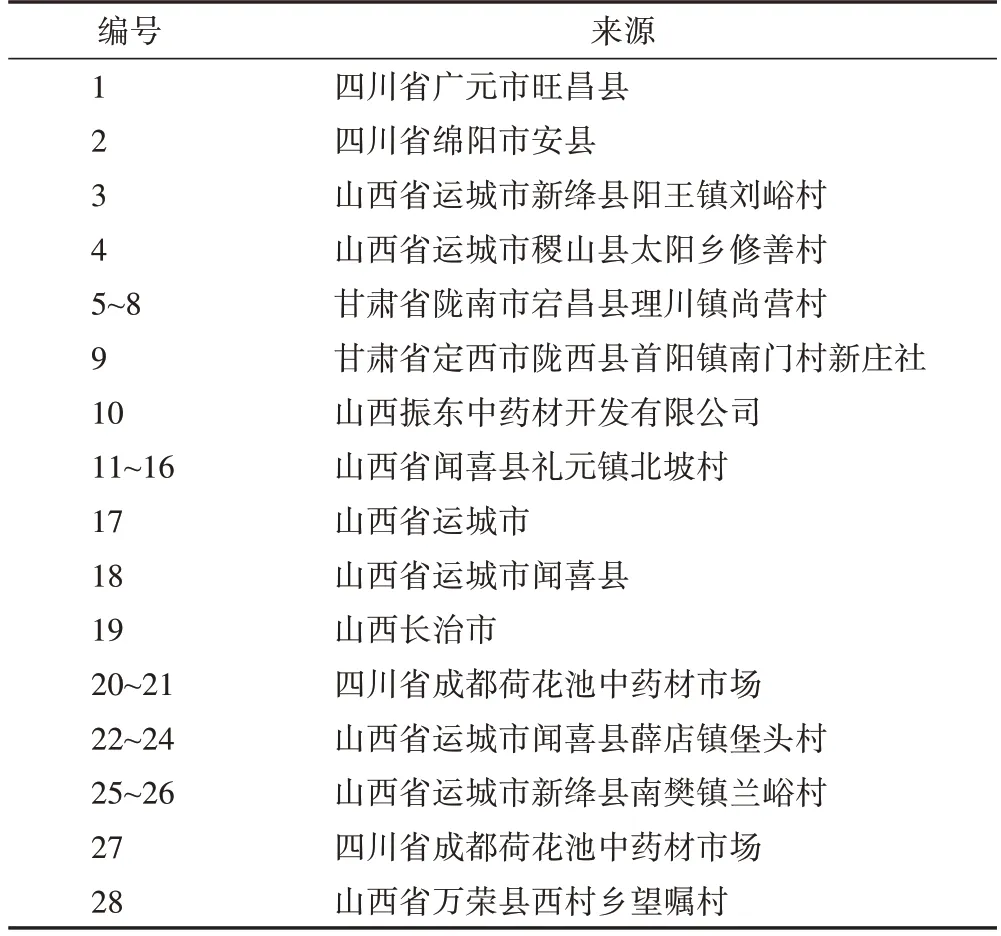
表1 柴胡药材来源信息

图1 典型柴胡药材横切面比较
从NCBI 中下载的ITS 序列为S1(北柴胡,GeneBank 登录号:KR902794.1)、S2(狭叶柴胡,GeneBank 登录号:MH712650.1)、S3(银州柴胡,GeneBank 登录号:HQ687967.1)、S4(竹叶柴胡,GeneBank 登录号:KR133183.1)、S5(纤细柴胡,GeneBank 登录号:LC489178.1)、S6(太白柴胡,GeneBank 登录号:EU220932.1)、S7(大叶柴胡,GeneBank登录号:HQ377215.1)。
1.2 仪器与试药
1525 型高效液相分析系统、2487 型双波长吸光度检测器(美国Waters 公司);Extend-C18色谱柱(250 mm×4.6 mm,5 μm,美国Agilent 公司);041BK9248 型电泳仪、PTC-200 型梯度聚合酶链式反应(PCR)扩增仪、721BR16894 型凝胶成像系统(美国Bio-Rad 公司);QL-901 型涡旋混合器(其林贝尔仪器制造公司);十六烷基三甲基溴化铵(CTAB)植物基因组DNA快速提取试剂盒(北京艾德来生物科技有限公司);对照品柴胡皂苷a(批号:CHB-C-014)、柴胡皂苷c(批号:CHB-C-017)、柴胡皂苷d(批号:CHB-C-018)均购于成都克洛玛生物科技有限公司,纯度≥98%;甲醇(分析纯,北京化工厂);浓氨水(分析纯,天津市北联精细化学品开发有限公司);乙腈[色谱纯,赛默飞世尔科技(中国)有限公司]。
2 方法
2.1 柴胡皂苷含量测定
2.1.1对照品溶液制备 取柴胡皂苷a、柴胡皂苷c、柴胡皂苷d对照品适量,精密称定,加甲醇制成1 mg·mL-1的各对照品的储备液。测试前,储备液加甲醇稀释成系列工作液浓度。
2.1.2供试品溶液制备 取柴胡样品粉碎,过四号筛,精密称定0.5 g,置具塞锥形瓶中,加入含5%浓氨试液的甲醇溶液25 mL,密塞后于30 ℃水温中超声处理(功率200 W,频率40 kHz)30 min,滤过后用甲醇20 mL 分2 次洗涤容器及药渣,合并洗液与滤液,回收溶剂至干。残渣中加入甲醇溶解,移至5 mL 量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.1.3色谱条件 采用高效液相色谱法(HPLC),具体操作流程参照《中国药典》2020 年版项下规定[2],色谱柱:Agilent Extend-C18色谱柱;流动相为乙腈(A)-水(B),梯度洗脱(0~50 min,25%~90%A;50~55 min,90%A);流速:1.0 mL·min-1;柱温:35 ℃;进样量:10µL;检测波长:210 nm。
2.2 DNA提取和PCR扩增
参照提取试剂盒使用说明提取基因组DNA。ITS 的PCR扩增采用通用引物5F:5′-GGAAGTAAAAGTCGTAACAAGG-3′和4R:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体积为25µL,体系内含PrimeSTAR HS(Premix)12.5µL、RNasefree Water 9.5µL、引物各0.5µL(10µmol·L-1)、模板DNA 2µL。扩增程序为98 ℃预变性5 min;98 ℃变性10 s;52.5 ℃引物与模板结合30 s;72 ℃延伸60 s,35 个循环;最后72 ℃延伸5 min,4 ℃保存。PCR 产物电泳检测后,送北京三博远志生物技术有限责任公司测序。使用CodonCode Aligner 5.12软件对测序峰图进行拼接校对,即得用于比较分析的ITS 序列。每个地区样品随机选择3个单根,但由于前期实验损耗,共有62 个单根用于ITS 序列对比测定。采用MEGA 5.0 软件构建邻接(NJ)系统发育树,置信度用bootstrap method检验,1000次循环。
3 结果与分析
3.1 不同产地柴胡药材的柴胡皂苷含量
柴胡皂苷为柴胡药材中的主要药效成分,其中,柴胡皂苷a、柴胡皂苷d含量较高,《中国药典》2020年版对柴胡药材品质要求为其柴胡皂苷a、柴胡皂苷d总质量分数不少于0.30%。另外,柴胡皂苷c也是柴胡中含量较高的皂苷单体。测定了不同产地柴胡中3个皂苷单体含量,典型色谱图见图2,结果见表2(样品10、15未进行含量测定)。柴胡皂苷a、柴胡皂苷d总质量分数为0.063%~3.873%,高于《中国药典》2020年版规定的有25份,仅1份未达到标准。柴胡皂苷c质量分数为0.004%~0.292%,其中,样品9(甘肃)的柴胡皂苷a、柴胡皂苷d 总质量分数和柴胡皂苷c质量分数均最高。样品2(四川)的柴胡皂苷a、柴胡皂苷d 总质量分数和柴胡皂苷c 质量分数均最低,3 个皂苷总质量分数与样品9 相差35.3 倍。在质量分数为0.004%~0.200%,柴胡皂苷c 与柴胡皂苷a+柴胡皂苷d 含量关系式为Y=0.800 2X+0.736 5(r=0.138 9),无明显相关性(图3)。
表2 柴胡样品中3个柴胡皂苷的质量分数( ± s,n=3)
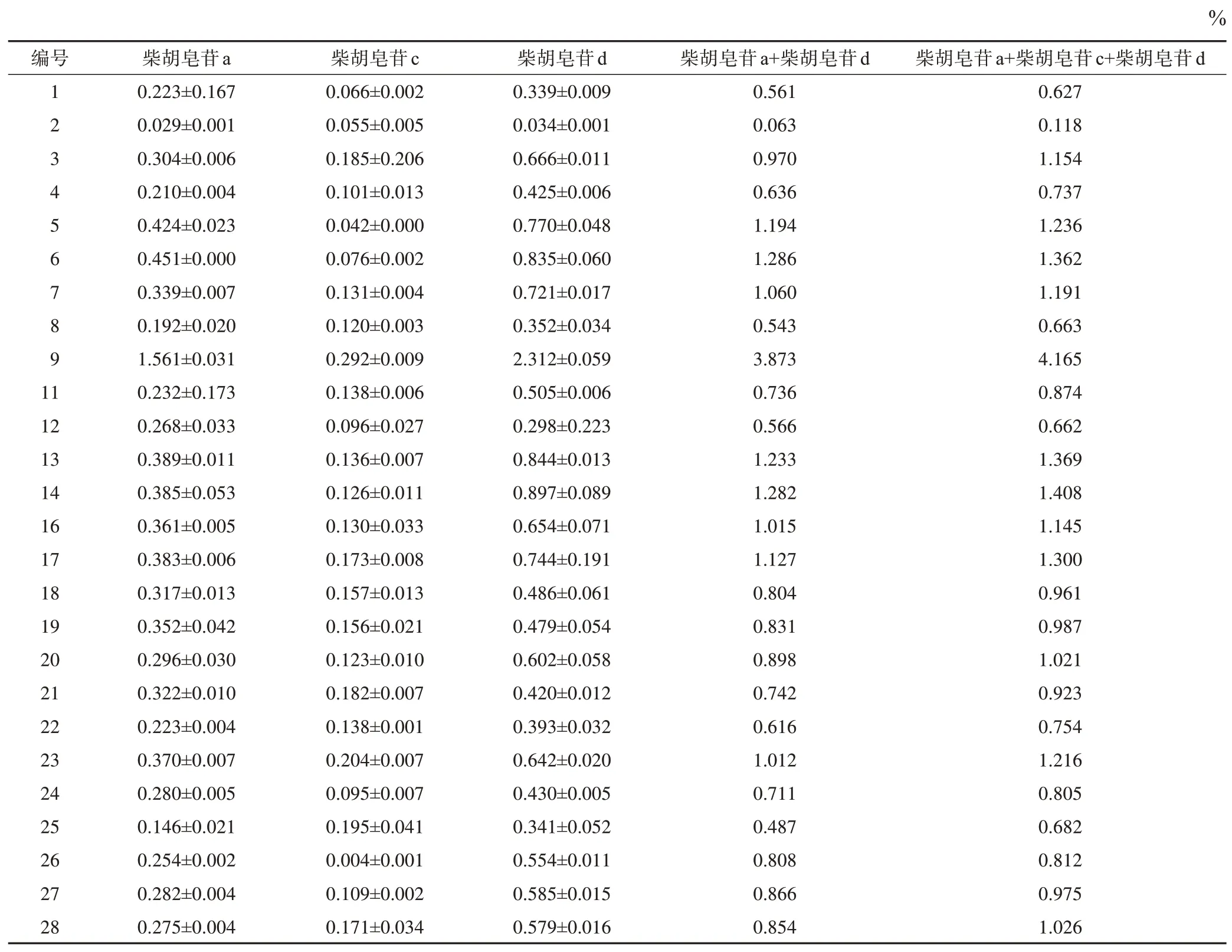
表2 柴胡样品中3个柴胡皂苷的质量分数( ± s,n=3)
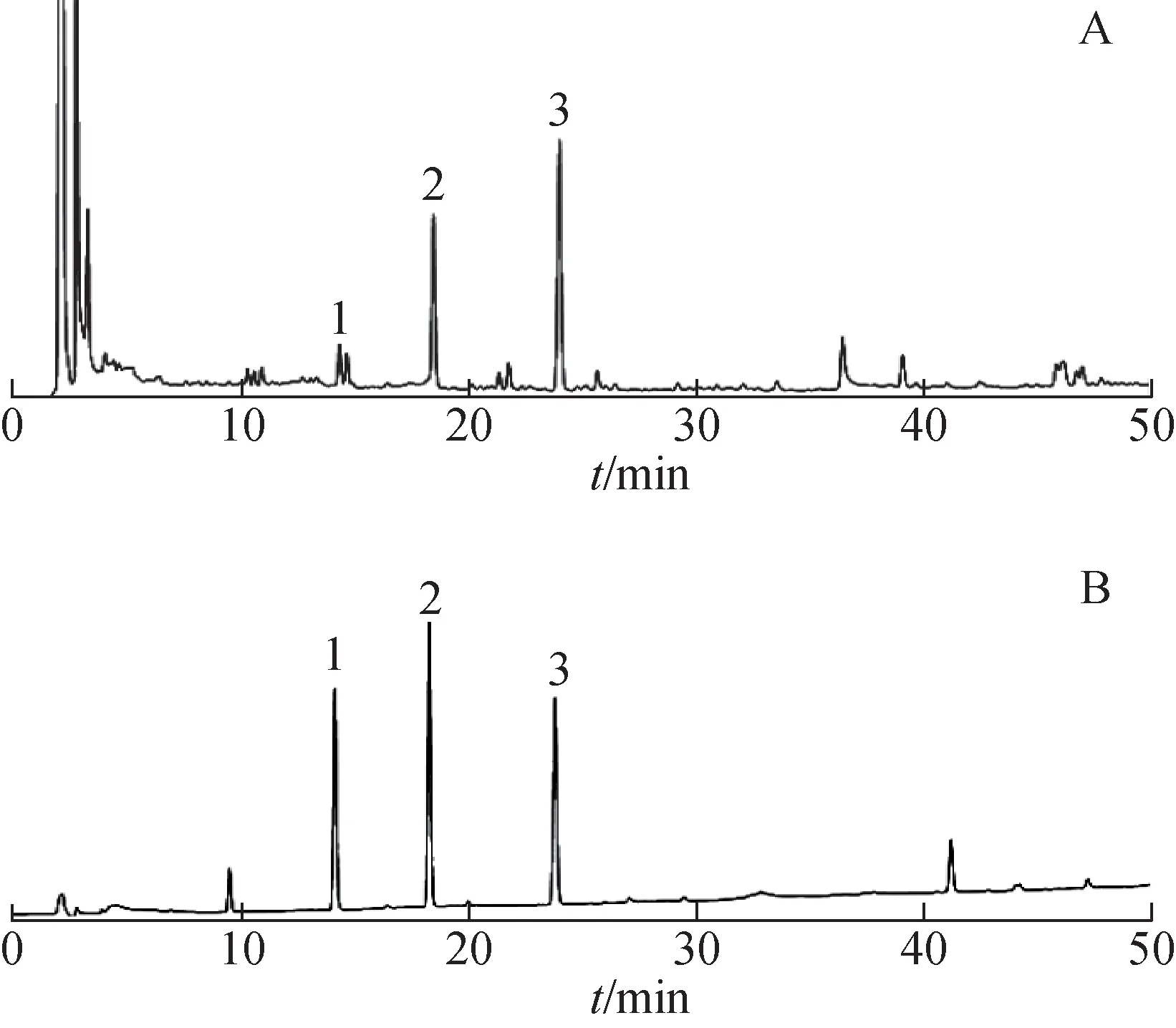
图2 柴胡样品及柴胡皂苷a、柴胡皂苷c、柴胡皂苷d对照品HPLC图
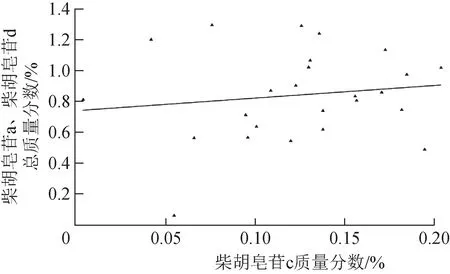
图3 柴胡皂苷c质量分数与柴胡皂苷a、柴胡皂苷d总质量分数的相关性变化趋势(n=25)
3.2 不同产地柴胡药材的ITS序列分析
依据NCBI 中下载的柴胡的序列与测定药材ITS序列构建进化树(图4),可将柴胡样品分为三类。S7(大叶柴胡)单独聚为一类(Ⅰ),与其他柴胡序列差异明显。样品9(甘肃)与S5(纤细柴胡)单独聚为一类(Ⅱ),与其他柴胡ITS 序列差异较大,推测该样品与纤细柴胡相似度更高。其余聚为一大类(Ⅲ),其中,样品2、19 的2 个单根和样品21、24 的各1 个单根的ITS 序列相近,与S2(狭叶柴胡)聚为一类(a),推测该类内的样品与狭叶柴胡更为接近;Ⅲ类中的其他序列聚为一类(b),b 类内样品又可细分为3 小类。样品13、17、26、27 的3 个单根,样品3、18、28 的2 个单根,样品4、20、22、23、25 的1 个单根和S6(太白柴胡)聚为一小类(i),推测该类内的样品与太白柴胡相似度更高,主产于山西、四川,柴胡皂苷a、柴胡皂苷c 和柴胡皂苷d 总质量分数为0.682%~1.369%。样品1、11的3个单根、样品12、16的2个单根和样品24的1个单根,S1(北柴胡),S3(银州柴胡)聚为一小类(ii),其中样品12的2个单根与样品11的3号单根与S3(银州柴胡)聚在一起,推测这3 个样品相似度与银州柴胡更为接近,其余样品与S1(北柴胡)更为相似。聚为ii 中的柴胡主产于山西,柴胡皂苷a、柴胡皂苷c 和柴胡皂苷d 总质量分数为0.627%~1.145%。样品6、7、15的3个单根,样品5、8、25的2 个单根,样品10、14、19 的1 个单根和S4(竹叶柴胡)聚为一小类(iii),推测该类内的样品与竹叶柴胡的相似度更高,主产于山西、甘肃,柴胡皂苷a、柴胡皂苷c 和柴胡皂苷d 总质量分数为0.663%~1.408%。
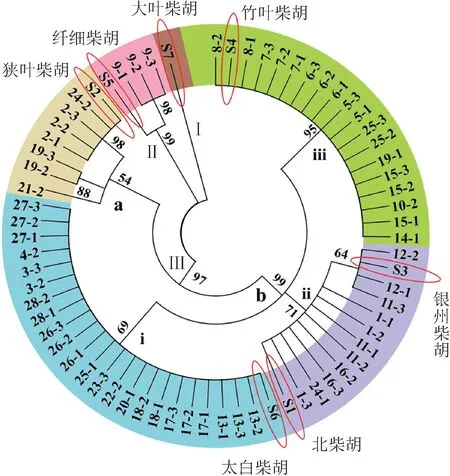
图4 基于ITS序列构建不同产地的柴胡样品的系统发育树
其中,来自甘肃的样品有5~8(iii)和9(Ⅰ);来自四川的样品有2、21(Ⅱ),20、27(i)和1(ii);来自山西的样品有19、24(Ⅱ),3、4、13、17、18、22、23、25、26、28(i),11、12、16(ii)和14(iii)。可以看出从同一地区收集得到的柴胡处于ITS 的不同类中,可能由于种间差异所导致。另外也存在同一批样品中测定的不同单根的ITS 序列差别较大,分属不同类,可能由于种内变异、不同栽培种质的混合种植群体等因素导致。因此,存在3 种不同的分类,推测原因可能是种内变异、种间差异。
4 讨论
药效成分含量是评价药材质量的关键因素,药效成分的形成又是植物自身遗传基因和外在环境共同作用的结果。柴胡自然分布较广,栽培柴胡的地区也很广泛,形成了多种栽培种质。本研究测定了3 个省28 份柴胡药材的柴胡皂苷含量和ITS 序列,进行了比较分析。柴胡皂苷a、柴胡皂苷d 总质量分数为0.063%~3.873%。以往研究报道,陕西、河南、河北、甘肃和内蒙古等地的柴胡,柴胡皂苷a、柴胡皂苷d 总质量分数为0.39%~2.11%,最高的是甘肃柴胡,为2.11%[8],与本研究中甘肃柴胡皂苷含量最高的结果一致。不同研究测定的材料来源有区别,得出的含量最高的地区也不同,但都可以得出同样的结论,不同产区柴胡药材的柴胡皂苷含量差异较大。ITS 序列比较结果显示,存在与大多柴胡药材序列差异较大的样品,尤其是来源于甘肃的样品9,皂苷含量最高,由于实验中测定的是药材的ITS,没有植株性状参数作为鉴定依据,还不能确定是不是与其他大多柴胡药材的植物基原分属于不同的植物种。
柴胡药理研究表明,柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f 可共同作用于14个关键靶点,通过磷脂腺肌醇3-激酶(PI3K)-蛋白激酶B(Akt)、Ras 等信号通路发挥抗炎、抗抑郁、抗肿瘤的作用[9]。柴胡皂苷c 能够刺激白细胞介素-6,抑制乙型肝炎病毒(HBV)合成前基因组RNA(pgRNA)的合成,具抗乙肝病毒的作用[10]。有学者测定了柴胡中柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f 的含量,数据显示柴胡皂苷c、柴胡皂苷f 质量分数约占总质量分数的11.46%、43.18%[8],且柴胡皂苷c、柴胡皂苷f 与柴胡皂苷a和柴胡皂苷d 的总质量分数无线性关系[6],建议将柴胡皂苷c 和柴胡皂苷f 列入标准,以提高药材质量的标准化。本研究除了测定《中国药典》2020 年版规定的柴胡皂苷a、柴胡皂苷d 含量,也测定了柴胡皂苷c 的含量,结果显示,当质量浓度为0.004%~0.200%,柴胡皂苷c 含量与柴胡皂苷a、d 含量无明显变化规律。
我国柴胡药材种植广泛,虽然《中国药典》2020 年版对柴胡药材基原已作规范,但各地习用种仍存在差异,受基原植物种间差异、生长环境、栽培方法等条件限制,不同地区的柴胡药材质量参差不齐[11]。柴胡抗旱性较强,目前各地引种的较多,从本研究中可以看出,ITS 序列同属于一个类或次级小类的不同地区的柴胡,柴胡皂苷含量存在差异,表明不同生态环境对药材的品质影响很大。基于不同产地柴胡药材药效成分含量变化,建议从标准和规范化角度更深入地研究柴胡适宜发展地区。

