基于生信分析筛选鼻咽癌放疗抵抗干性相关基因及相关通路的研究
陈劲海,徐亚丽
(广州医科大学附属第二医院耳鼻喉科,广东 广州510260)
鼻咽癌是一种起源于鼻咽黏膜上皮的恶性肿瘤,其全球地理分布极不平衡,80%的鼻咽癌病例都集中在中国华南地区和东南亚。大湾区NPC发病率高居全球第一,特别是广东地区的人患鼻咽癌的概率,是其它低发病率地区的20倍。放射治疗是非转移性鼻咽癌的主要治疗手段[1-2]。但是大约15%~30%的NPC患者在放射治疗后出现局部复发和/或远处转移,而放疗抵抗的存在可能是导致这类患者治疗失败的主要原因,并严重制约了患者的预后及生存质量[3-4]。
肿瘤干细胞是肿瘤中一群具有干细胞特性的异质细胞,这些细胞可以不断进行自我更新和无限增殖,并且多向分化,促使肿瘤生长、复发及转移[5]。普遍认为CSCs特征的细胞群比普通肿瘤细胞具有更明显的放疗抵抗效应,是造成许多晚期肿瘤患者对放疗耐受和复发的重要原因[6]。肿瘤干细胞学说的提出为我们重新认识肿瘤的起源和本质以及临床肿瘤治疗提供了新的方向。仍而,系统应用肿瘤干细胞理论来指导鼻咽癌的放疗增敏,计算识别干性相关基因还未有报道。因此,本文通过结合肿瘤相关转录因子、肿瘤放疗抵抗干性相关基因和肿瘤特征通路构建网络,甄别鼻咽癌放疗抵抗干性相关基因和关键的信号通路,为后期的增敏鼻咽癌放疗效果,改善和提高患者生存质量及预后提供了可靠的分子标志物和潜在的治疗靶点,具有重要的临床意义。
1 资料与方法
1.1 数据收集及处理
在GEO数据库下载鼻咽癌数据集GSE32389。数据内容主要包括转录组及对应的辐射信息等临床数据,数据下载完成后在本地后进行统一管理,数据进行对数变换进行标化操作,共有20例样本可以可用于下游的数据分析。差异表达基因的筛选条件为调整P<0.05和|log2FC|>1。
1.2 识别鼻咽癌放疗抵抗干性相关基因
肿瘤干性的数据和方法主要参考Tathiane MM[7],该文献通过分析人胚胎发育各阶段干性细胞数据,采用机器学习模型(单类别的logistic回归模型)得到了关于细胞干性指数的评价指标。其具体模型为最小化下述数学表达式为(参考gelnet软件包技术文档):
其中si=wTxi,w为基因干性的权重系数,gi为基因表达水平,正则化项:
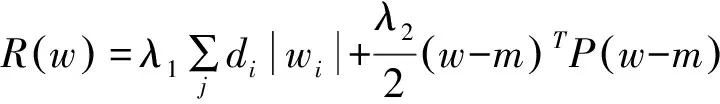
1.3 鼻咽癌放疗抵抗干性相关基因的基因本体(GO)和京都基因和基因组百科全书(KEGG)通路富集分析
基因的差异表达采用经验贝叶斯模型进行分析(limma v3.51.8),后续通过下载MSigDB(version 7.0,https:∥www.gsea-msigdb.org/gsea/msigdb/index.jsp)提供的基因集数据库,进行基因功能的富集分析(clusterProfiler v 4.3.4),包括GO 聚类和KEGG 信号通路等,识别调控鼻咽癌放疗抵抗相关基因的重要细胞分子过程及相关通路。
1.4 构建鼻咽癌放疗抵抗基因网络
通过Cistrome数据库(http:∥cistrome.org/)可下载318个肿瘤相关的转录因子(TFs),同时根据MSigDB数据库中收录的50个肿瘤特征集(Cacer hallmark),通过GSVA(version 1.38.0)计算单样本通路基因集变异分数,再结合上述识别的鼻咽癌放疗抵抗干性基因,可构建鼻咽癌放疗抵抗基因网络,在此基础上进行网络结构分析(igraph version 1.2.5),识别放疗抵抗重要的功能模块(Cystoscape与igraph软件包),同时根据网络结点的连接度,介数及紧密性等指标筛选重要的网络结点基因。
1.5 统计学方法
本研究均应用R(version 4.0.2)软件对数据进行分析,用ggplot2(version 3.3.3)软件包等统计可视化工具软件进行统计作图,其中热图采用ComplexHeatmap(v2.11.1),放疗抵抗基因网络采用network(v1.17.1)。
2 结 果
2.1 鼻咽癌干性指数的评分
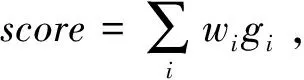
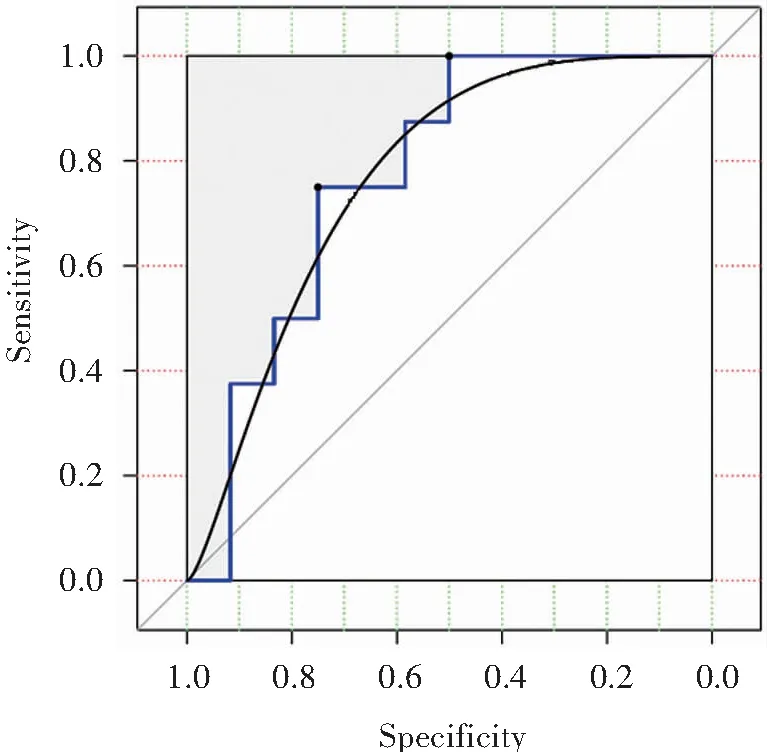
图1 鼻咽癌干性指数与放疗敏感性的ROC曲线
2.2 计算识别鼻咽癌放疗抵抗干性相关基因及GO,KEGG富集分析
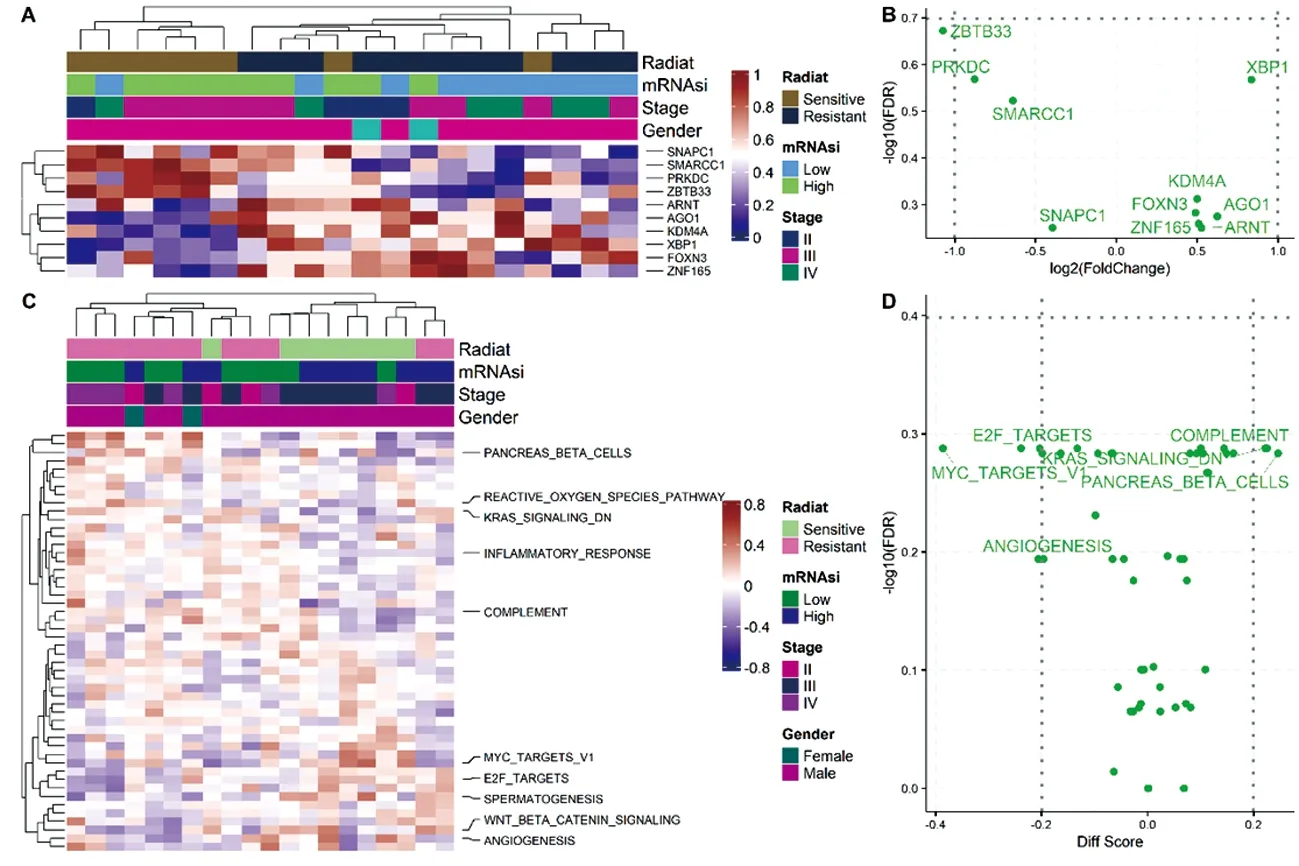
根据基因表达数据和干性分数,分别计算放疗抵抗差异表达基因733个和和干性相关差异基因678个(图2A,B和图3A,B)。GO分析显示放疗抵抗差异基因调节的生物过程主要集中在B细胞介导免疫、免疫效应过程和分子介导的免疫反应;调节的细胞成分富集在质膜外;调节的分子功能富集在细胞因子受体结合、细胞因子结合和酪氨酸蛋白激酶结合(图2C)。KEGG分析显示差异基因可在Intestinal immune network for IgA production、JAK-STAT、Cytokine-cytokine receptor interaction等信号通路富集(图2D)。另外,干性相关差异基因的GO分析显示其生物过程主要集中在细胞活化的正调控、适应性免疫反应、细胞黏附的正调控等。KEGG分析显示基因可在Cytokine-cytokine receptor interaction、I型糖尿病、同种异体移植排斥等相关信号通路富集(图3C,3D)。采用弹性网络logistic回归机器学习方法识别放疗抵抗干性相关差异表达相关基因,共筛选到27个,分别为ACTC1,AGTRAP,CHRM5,CNIH3,DPT,FAM8A1,FANCL,HAS2,HOXB2,IGLC1,IL1RN,KIFAP3,LNX1,MRPL13,MYL6,NLRP14,PRKDC,RABAC1,RABGAP1L,RALA,SENP5,SERPING1,SMDT1,SPAG7,TMA16,TMTC4和ZBTB33。

注:A:差异基因表达热图;B:差异基因表达的火山图;C:差异基因Go分析;D:差异基因KEGG分析
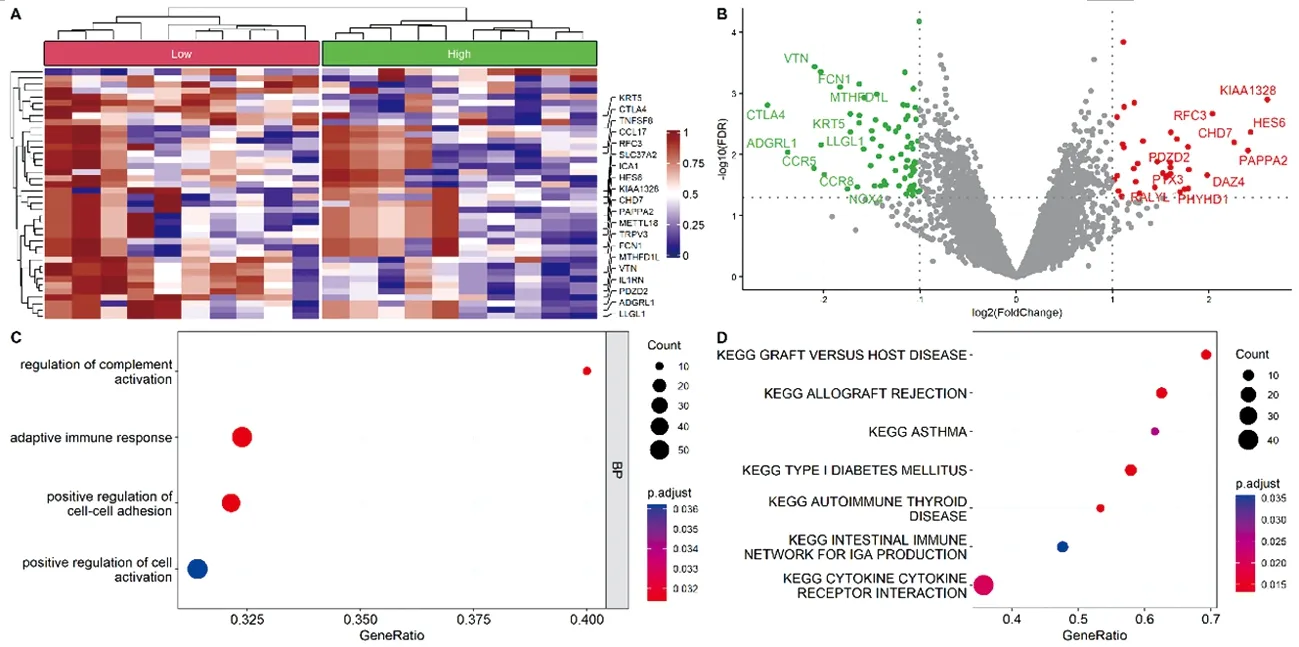
注:A:差异基因表达热图;B:差异基因表达的火山图;C:差异基因GO分析;D:差异基因KEGG分析
2.3 鼻咽癌放疗抵抗网络分析
首先进行放疗抵抗相关转录因子和肿瘤特征的筛选(图4),进而相关转录因子、肿瘤放疗抵抗干性相关基因和肿瘤特征变异分数计算两两相关系数,再根据相关系数构建三者的相关网络(图5)。通过网络结构分析,识别放疗抵抗重要的功能模块,同时根据网络结点的连接度,认为PRKDC、HOXB2和ZBTB33在网络中有着重要的作用,可作为鼻咽癌放疗增敏的侯选标靶。
注:A、B:鼻咽癌放疗抵抗干性相关转录因子的表达及对应的P值;C、D:鼻咽癌放疗抵抗干性相关肿瘤特征的变异分数及对应的P值。
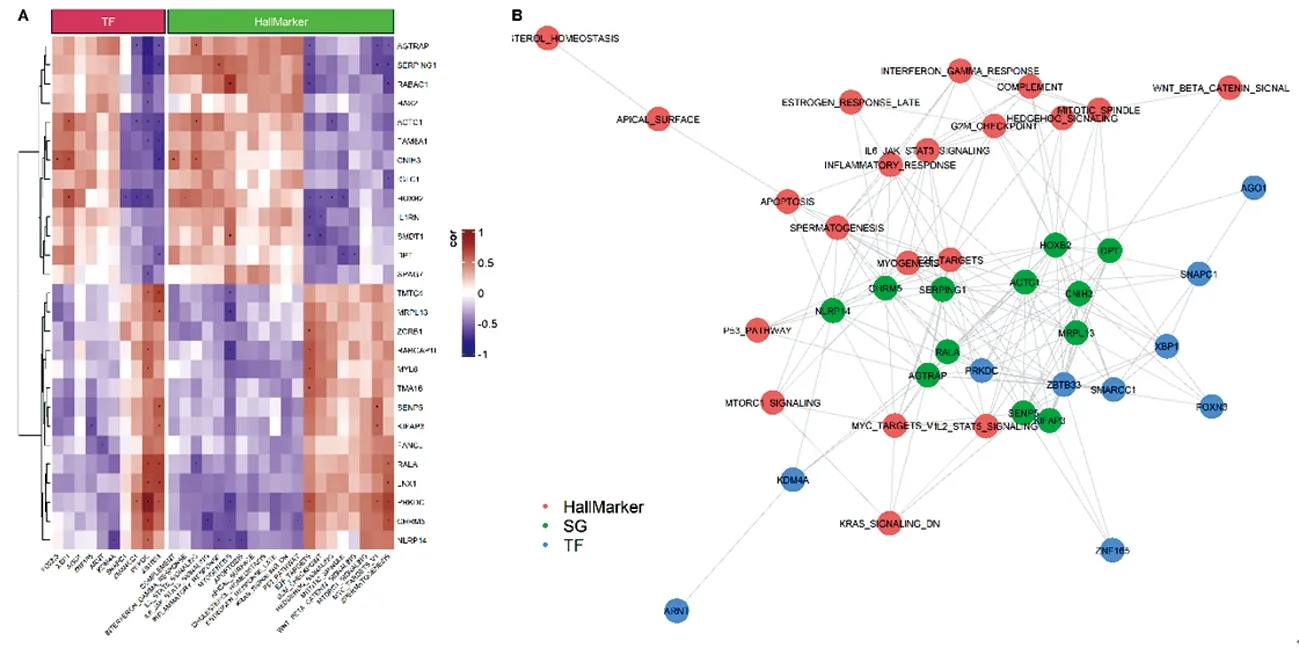
注:A:热图;B:网络拓扑结构图
3 讨 论
本研究围绕鼻咽癌临床工作中放疗抵抗导致治疗后肿瘤复发和转移这一突出问题,立足于肿瘤干细胞的视野,通过整合现有的肿瘤干细胞研究成果和多个有关鼻咽癌放疗相关数据,在统一统计模型下进行分析,识别鼻咽癌放疗抵抗干性相关基因,该方法可以解决传统上只针对大部分肿瘤细胞而忽略CSCs的问题,使靶点更为可靠。
本文采用弹性网络logistic回归机器学习方法识别到27个放疗抵抗干性相关差异表达相关基因。KEGG通路富集分析结果表明,其主要富集于JAK-STAT、Cytokine-cytokine receptor interaction等信号通路。肿瘤干细胞介导放疗抵抗性的机制涉及到DNA修复的激活、清除活性氧防止不可逆的氧化应激、抗细胞凋亡和改变肿瘤微环境[8]。大量研究表明,IL-6/JAK2/STAT3信号通路在许多类型的癌症中异常高活化,同时强烈抑制抗肿瘤免疫反应,它在抑制肿瘤生长、癌细胞的耐药、放疗抵抗、抗肿瘤免疫方面具有相当大的潜力和前景[9-13]。但IL-6/JAK/STAT3信号通路在鼻咽癌中的相关研究却并不多见,尤其是放疗抵抗方面的研究则更少见。
本研究最终确定的3个核心基因,PRKDC、HOXB2和ZBTB33均可以通过调控多种肿瘤细胞的DNA损伤修复、细胞周期和上皮间质转化等方面,维持不同肿瘤细胞的生物学活动[14-17]。
PRKDC(Proteinkinase,DNA-activated,catalytic subunit)基因编码合成细胞核内DNA依赖性丝氨酸/苏氨酸蛋白激酶(DNA-PK)的催化亚基,其蛋白产物为非同源末端连接修复(nonhomologous end joining,NHEJ)通路中重要的功能执行因子。帅等通过综合分析GEO和TCGA数据库,并结合预后差异发现,PRKDC与食管鳞癌放射敏感性和预后均相关,且高表达患者经过放射治疗更易获得完全缓解,预后也越好[18]。与其不同的是,Chen等发现miRNA-218-5p可以抑制抗辐射肺癌细胞的PRKDC的活性,从而加速DNA损伤、细胞凋亡并增加细胞的放疗敏感性[19]。Zhang等发现敲低胃癌细胞的PRKDC表达可以促进DNA损伤,并提高胃癌细胞的化疗抵抗性,提示PRKDC可作为克服胃癌化疗抵抗的潜在靶点[20]。
Jing等发现HOXB2 and FOXC1通过促进Wilms瘤细胞的增殖和迁移作用而协同驱动Wilms肿瘤的进展[16]。Xu等发现HOXB2可以直接与c-Myc和Nanog的启动子区域结合而激活其转录功能从而促进食管鳞状细胞癌干细胞特性[21]。
ZBTB33基因位于Xq23,编码的Kaiso蛋白属于锌指蛋白超家族中BTB/POZ转录因子亚家族的成员。Singha等研究发现Kaiso(ZBTB33)的亚细胞分布与其他乳腺癌生物标志物之间的多重多元分析揭示了Kaiso和自噬相关蛋白LC3A/B之间新的功能和预测联系,这些蛋白与肿瘤免疫微环境、生存和种族的特征相关[22]。Feng等发现miR-4262可抑制宫颈癌细胞的增殖和上皮间质转化,接着又通过生信分析和荧光素酶报告实验证实ZBTB33是miR-4262的潜在靶基因[15]。李等通过建立肺癌细胞增殖调控网络发现,ZBTB33可以通过p53信号通路促进肿瘤细胞的增殖[23]。
综上所述,本研究基于生物信息学分析发现,PRKDC、HOXB2和ZBTB33可能是导致鼻咽癌放疗抵抗的干性相关基因,这些基因可能成为提高鼻咽癌放疗增敏、改善预后的潜在治疗靶点。接下来,本研究团队将设计相关生物实验及临床样本进一步研究其分子机制,以期为今后临床试验和工作提供更加可靠的依据。

