组蛋白甲基转移酶WHSC1对三阴性乳腺癌增殖的作用研究
杨明强,曾珊珊,林鑫,刘浩,陈丹扬
(广州医科大学附属肿瘤医院肿瘤研究所,广东 广州 510095)
三阴性乳腺癌(triple negative breast cancer,TNBC)约占所有乳腺癌的10%~15%,其特征是缺乏雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和 人表皮生长因子2 受体(human epidermal growth factor 2 receptor,HER-2)的表达[1]。TNBC以浸润性导管癌为主,细胞增殖活性和组织分级均显著升高,恶性程度高,预后较差,复发率高且易发生远处转移[2-3]。目前,化疗是唯一治疗早期和晚期TNBC较为成熟的方法。由于其高侵袭的特性以及靶向治疗方式的缺乏,TNBC的基础与临床研究仍持续进行着,以期提高治疗效果,改善患者的临床预后。
Wolf-Hirschhorn 综合征候选基因1(Wolf-Hirschhorn syndrome candidate gene-1,WHSC1),也被称为核受体结合SET结构域蛋白(nuclear receptor binding SET domain-protein,NSD)或多发性骨髓瘤集合域(MMSET),是含有SET结构域的组蛋白赖氨酸甲基转移酶家族的成员,在早期生长和发育中发挥重要作用[4]。WHSC1能够催化组蛋白H3赖氨酸第36号位(H3K36)的二甲基化(H3K36me2),进而影响基因转录[5]。越来越多的研究表明,WHSC1在多种恶性肿瘤中高表达[6-8],并与某些肿瘤的侵袭转移、化疗抵抗和不良预后等相关[9-12]。尽管已知WHSC1在乳腺癌中表达异常[13],但其在TNBC中的作用及分子机制尚未被阐明,亟需进一步深入研究。
本研究拟通过生物信息学分析WHSC1在TNBC组织中的表达,从体外和体内水平检测其对TNBC细胞增殖的影响,初步探讨WHSC1调控TNBC细胞增殖的潜在分子机制。
1 材料与方法
1.1 实验材料
细胞培养基、胎牛血清、胰酶等购自美国Gibco公司,蛋白酶抑制剂PMSF购自美国Sigma公司,RIPA裂解液购自碧云天生物技术公司,ECL化学发光底物试剂盒购自美国Thermo公司,WHSC1、Ki-67、p21、GAPDH、β-Tublin蛋白一抗,HRP标记山羊抗鼠IgG、山羊抗兔 IgG购自美国CST公司,免疫显色试剂购自福州迈新生物技术开发有限公司,BALB/c裸鼠购自广东省实验动物中心,动物实验通过广州医科大学实验动物伦理委员会伦理审查。
1.2 细胞培养
人三阴性乳腺癌细胞株MDA-MB-231、BT549均来自广州医科大学附属肿瘤医院肿瘤研究所。MDA-MB-231、BT549细胞用含10% FBS的RPMI 1640培养基,于37 ℃、5% CO2培养箱内培养。1~2 d换液,每3~4 d传代1次,实验时选用对数生长期的细胞。
1.3 WHSC1稳定过表达细胞系的筛选
pCMV-WHSC1过表达质粒购自美国Origene公司。取对数生长期的细胞,接种于6孔板中,37 ℃、5% CO2的培养箱中培养过夜。根据Lipofectamine 2000转染试剂说明书,将相应的质粒转染至细胞中。培养48 h后,采用嘌呤霉素筛选稳定过表达WHSC1的细胞株。
1.4 qRT-PCR分析
利用Trizol试剂提取细胞总RNA,按Primescript RT reagent Kit反转录试剂盒说明书将RNA逆转录为cDNA,Real-time PCR反应体系及条件参照 SYBR Premix Ex TapTM试剂盒(TaKaRa),2-△△CT法计算mRNA的相对表达量,以GAPDH作为内参。每个实验组重复3次。WHSC1上游引物序列:5′-TGTGTGAGCTGCCATGCTTCCA-3′,下游引物序列:5′-TGAGCATCCTGCTGCCAGACAA-3′;GAPDH上游引物序列:5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物序列:5′-TGGTGAAGACGCCAGTGGA-3′。
1.5 MTS法检测细胞增殖
用0.25%胰酶消化对数生长期的细胞,细胞计数并以3 000个/孔的细胞数接种于96孔培养板中。细胞贴壁后,分别培养24、48、72 h,加入MTS试剂(20 μL/孔),培养箱中孵育2.5 h,酶标仪检测490 nm处的吸光值。以细胞贴壁后加入MTS的时间为横坐标、吸光值为纵坐标作图并拟合曲线。每组浓度设4个复孔。
1.6 Western blotting分析
收集过表达WHSC1的TNBC细胞及对照组细胞,用含PMSF的RIPA裂解液裂解细胞,离心后收集上清,BCA法测定蛋白质浓度。等量蛋白质样品经10%的SDS-PAGE分离后,转印至PVDF膜上,用5%脱脂奶粉室温封闭2 h,WHSC1、p21、GAPDH、β-tubulin蛋白一抗均以1∶1 000比例稀释,4 ℃ 孵育过夜。经PBST洗涤后,加入按1∶5 000比例稀释的HRP标记的特异性二抗,室温下孵育2 h,最后加入ECL化学发光试剂于Tanon成像系统拍照。
1.7 克隆形成实验
用0.25%胰酶消化对数生长期的细胞,细胞计数并按1 000个/孔的细胞数接种于6孔板中,37 ℃、5% CO2的培养箱内培养过夜。每隔3 d换液,培养1周后用预冷PBS洗涤细胞,加入甲醇固定细胞10 min,0.1%结晶紫染色15 min,水中漂洗干净,晾干后拍照,用Image J进行分析。
1.8 裸鼠皮下成瘤实验
将过表达WHSC1的MDA-MB-231细胞及对照细胞培养至对数生长期,胰酶消化并离心,无菌PBS洗涤2次,配置成浓度为5×107/mL的细胞悬液。选取4周龄的BALB/c雌性裸鼠,分成实验组和对照组,每组6只,将细胞充分混匀接种于裸鼠腋窝中后部,每只接种体积为0.1 mL。接种细胞5天后,游标卡尺测量并记录瘤体最大横径(a)及最大长径(b),每隔3天测量1次,计算肿瘤体积V=1/2×a×b2;3周后,处死裸鼠,剥离出肿瘤组织并拍照;肿瘤组织固定于10%福尔马林中,以备组织学使用。
1.9 免疫组织化学分析
组织切片经环保透明剂脱蜡后梯度乙醇脱水,PBS洗涤;将切片放入0.01 M枸橼酸钠缓冲液,进行高压抗原修复,PBS洗涤;滴加内源性过氧化物酶阻断剂A孵育10 min,PBS洗涤;滴加非特异染色阻断剂B孵育10 min,PBS洗涤;滴加稀释后的一抗Ki-67(1∶100),4 ℃孵育过夜;PBS洗涤后,滴加二抗室温孵育1 h;PBS洗涤后DAB显色、苏木素复染、盐酸酒精分化;脱水、透明、封片后显微镜下观察Ki-67的表达情况。
1.10 统计分析
应用GraphPad Prism 7.0软件分析处理数据。计量资料以均数±标准差表示,两组比较采用两独立样本t检验,P<0.05差异有统计学意义。
2 结 果
2.1 WHSC1在三阴性乳腺癌组织中的表达
在线癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库分析显示WHSC1在1 097例乳腺癌组织中的表达显著高于141例正常乳腺组织(P<0.001)(见图1A)。进一步分析WHSC1在不同亚型的乳腺癌组织中的表达情况,结果显示WHSC1在TNBC组织中的表达显著高于Luminal型乳腺癌组织(P<0.01)及HER2+型乳腺癌组织(P<0.001)(见图1B)。
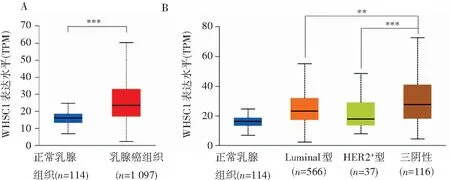
注:A:TCGA数据库分析WHSC1在乳腺癌组织中的表达;B:TCGA数据库分析WHSC1在不同亚型的乳腺癌组织中的表达;**P<0.01,***P<0.001
2.2 体外实验考察过表达WHSC1对三阴性乳腺癌细胞增殖的影响
为考察WHSC1对TNBC细胞的增殖影响,采用pCMV-WHSC1质粒转染MDA-MB-231和BT549细胞,构建稳定过表达WHSC1的细胞株及对照组细胞株。如图2A和2B所示,qRT-PCR及Western blotting验证,过表达WHSC1的MDA-MB-231和BT549细胞构建成功。接着,MTS实验结果显示,与对照组相比,过表达WHSC1可明显提高MDA-MB-231和BT549细胞的增殖能力(见图2C和2D)。克隆形成实验发现,过表达WHSC1的MDA-MB-231细胞克隆数为对照组的4.89±1.35倍(P<0.001),过表达WHSC1的BT549细胞克隆数为对照组的5.70±0.88倍(P<0.001),说明过表达WHSC1显著增强MDA-MB-231和BT549细胞的克隆形成能力(见图2E和2F)。
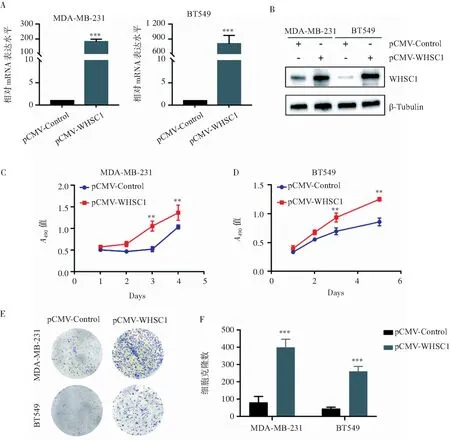
注:A:qRT-PCR检测稳定过表达WHSC1的MDA-MB-231和BT549细胞中WHSC1的mRNA表达水平;B:Western blotting检测稳定过表达WHSC1的MDA-MB-231和BT549细胞中WHSC1的蛋白表达水平;C:MTS检测稳定过表达WHSC1的MDA-MB-231细胞的增殖能力;D:MTS检测稳定过表达WHSC1的BT549细胞的增殖能力;E:克隆形成实验检测稳定过表达WHSC1的MDA-MB-231和BT549细胞的克隆形成能力;F:柱状图分析实验组和对照组细胞的克隆形成数量;**P<0.01,***P<0.001
2.3 体内实验考察过表达WHSC1对三阴性乳腺癌增殖的影响
WHSC1在体外水平对TNBC细胞增殖具有促进作用,为验证其在体内是否具有同样的功能,本组分别将稳定过表达WHSC1的MDA-MB-231细胞及对照细胞在裸鼠皮下接种,每隔3天测量并记录裸鼠肿瘤生长情况,并绘制生长曲线。图3A-D结果显示,过表达WHSC1组的裸鼠肿瘤体积为(759.29±188.25)mm3,明显大于对照组的肿瘤体积(105.41±79.10)mm3(P<0.01);过表达WHSC1组的移植瘤重量(0.51±0.15)g较对照组(0.05±0.04)g明显增加(P<0.01),说明过表达WHSC1能够显著促进裸鼠移植瘤的生长。接着,采用免疫组化实验分析移植瘤组织中增殖标志物Ki-67的表达情况。结果如图3E所示,过表达WHSC1组的Ki-67表达水平较对照组明显上调。上述结果表明,过表达WHSC1增强TNBC细胞在体内的增殖能力。
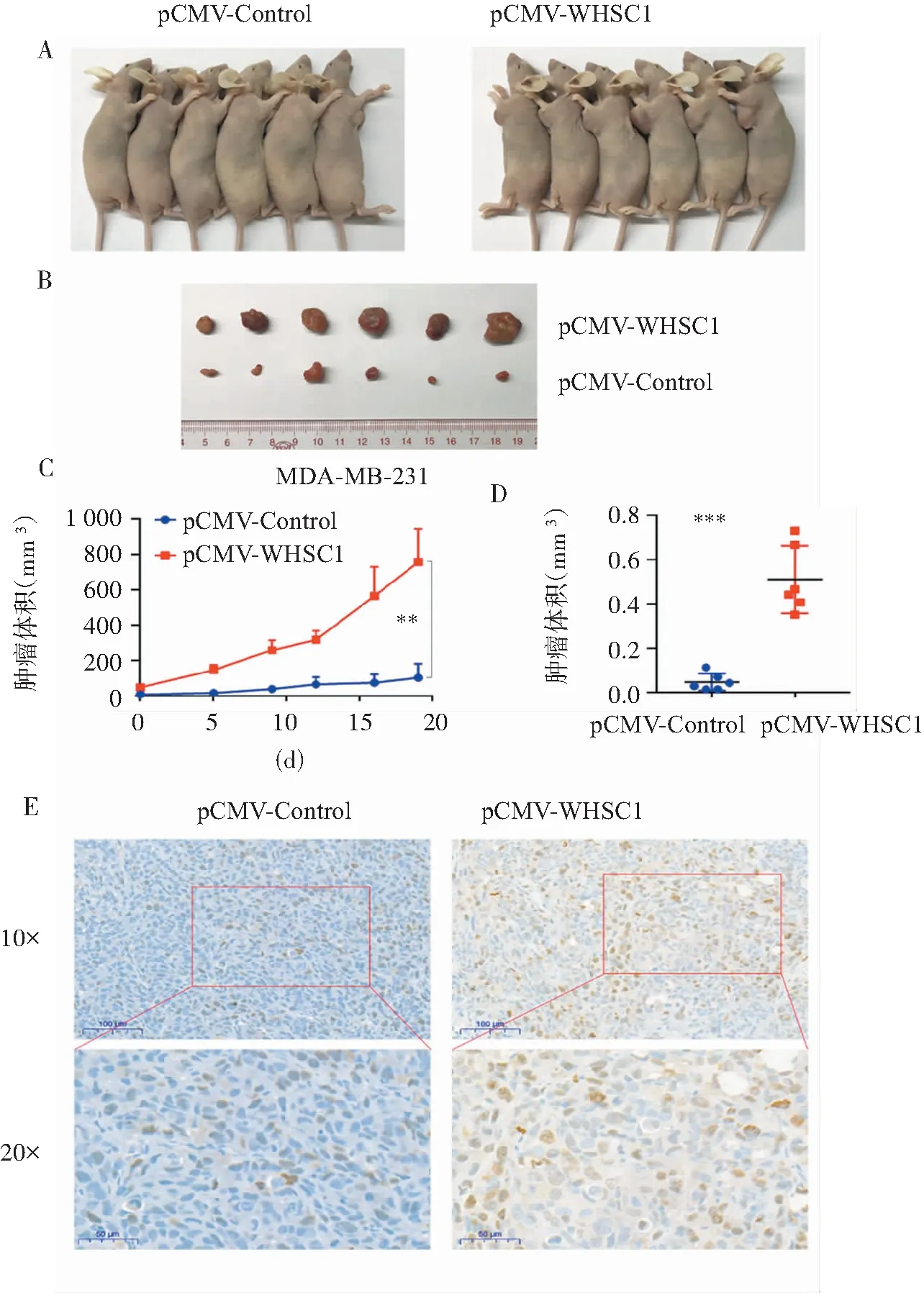
注:A:稳定过表达WHSC1的MDA-MB-231细胞及对照细胞在裸鼠皮下成瘤及生长情况;B:3周后,处死裸鼠,剥离出肿瘤组织并拍照;C:以时间为横坐标、肿瘤体积为纵坐标绘制肿瘤生长曲线图;D:对肿瘤组织进行称重并作图分析;E:免疫组化检测裸鼠肿瘤组织中Ki-67的表达情况;**P<0.01,***P<0.001
2.4 WHSC1对三阴性乳腺癌细胞增殖相关蛋白的影响
进一步采用Western blotting检测过表达WHSC1对TNBC细胞增殖相关蛋白的影响。结果如图4所示,与对照组相比,过表达WHSC1的MDA-MB-231细胞c-Myc和CDK4蛋白表达升高(P<0.01),而p21蛋白表达下调(P<0.001)。
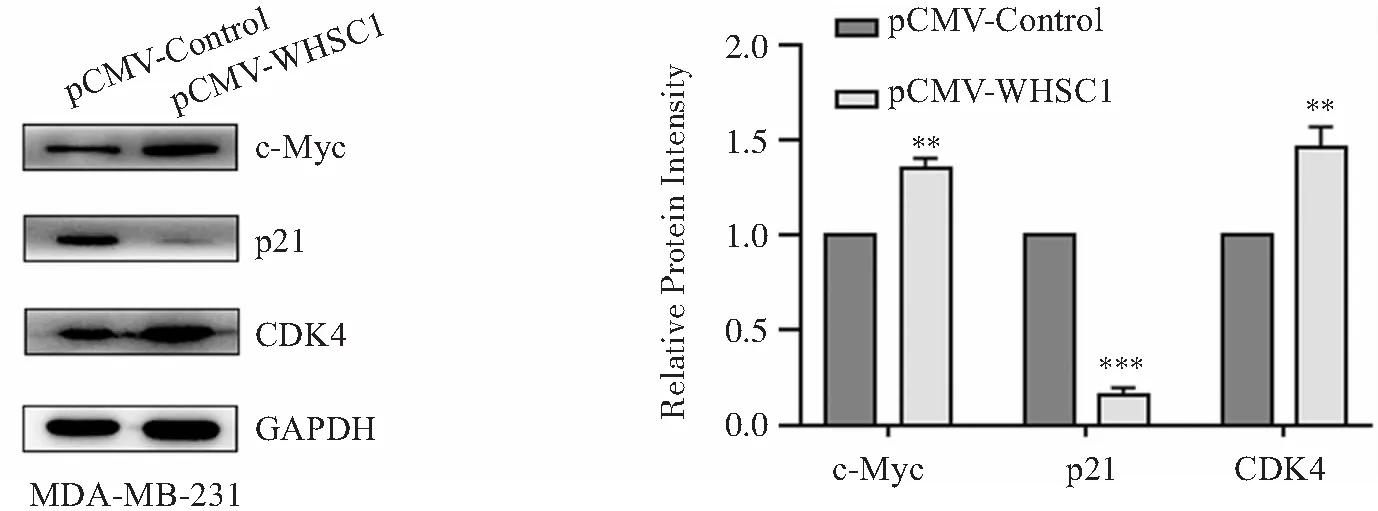
注:A:Western blotting检测过表达WHSC1前后MDA-MB-231细胞中c-Myc、CDK4和p21蛋白的表达变化;B:c-Myc、CDK4和p21蛋白表达的灰度分析;**P<0.01,***P<0.001
3 讨 论
三阴性乳腺癌是乳腺癌中恶性程度最高的亚型之一,因其ER、PR和HER-2表达的缺乏,传统的放疗及化疗往往不能得到满意的效果。大多数TNBC患者化疗后复发,预后不佳,主要原因是缺乏有效的靶向治疗[14],因此发现新的分子标志物或治疗靶标,对于TNBC的诊断及治疗具有重要意义。
越来越多研究也指出,WHSC1在多种恶性肿瘤中表达显著增高[6-8]。Wu等[8]研究发现WHSC1通过激活mTORC1信号促进肝癌细胞增殖、迁移和侵袭。Kojima等[15]研究表明WHSC1受EZH2调控,对卵巢癌细胞的增殖起重要作用。然而,WHSC1在TNBC中的作用尚未阐明。本研究中,前期通过TCGA数据库分析发现,WHSC1在TNBC组织中显著高表达;采用MTS及克隆形成实验检测,从体外水平上说明过表达WHSC1可增强TNBC细胞的增殖能力;构建裸鼠皮下成瘤模型从体内水平验证,过表达WHSC1可增强TNBC细胞的增殖。
组蛋白甲基化修饰是一种重要的表观遗传修饰方式,该甲基化过程发生在组蛋白赖氨酸或精氨酸残基上。组蛋白甲基化的异常可特异性地激活或抑制某些基因的转录活性,其功能失调往往与肿瘤的发生与发展相关[16]。在修饰组蛋白的酶中,组蛋白甲基转移酶是极具潜力的癌症治疗靶点[17-18]。WHSC1作为一种组蛋白赖氨酸甲基转移酶,包含具有催化活性的SET结构域,以核小体(组蛋白与DNA的复合体)为底物催化组蛋白的甲基化[19]。由于WHSC1能够引起细胞中H3K36me2水平增高从而影响基因的转录[5],因此WHSC1的高表达可能通过H3K36me2介导的染色体可及性变化来促进细胞增殖。本研究中,过表达WHSC1的MDA-MB-231细胞中,c-Myc的蛋白表达量较对照组明显升高(P<0.01)。c-Myc是一个致癌驱动因子,能够促进多种肿瘤的恶性转化[20]。有研究报道,敲低WHSC1能够显著降低c-Myc启动子区的H3K36me2水平,导致该基因的转录受到抑制[21]。这提示,WHSC1可能发挥其甲基转移酶的功能,上调c-Myc的转录进而影响下游各类基因表达,刺激肿瘤细胞代谢和增殖。另外,c-Myc在转录水平上能够抑制p21蛋白的表达。p21蛋白是一种细胞周期蛋白-细胞周期蛋白依赖性激酶(Cyclin-CDK)的抑制剂,能够抑制所有的cyclin-CDK复合物[22];p21已被证明能够抑制结合了Cyclin D1和Cyclin D2 的CDK4[23]。作为细胞周期的负调控因子,p21丢失会促进恶性肿瘤的发生及进展。本研究发现过表达WHSC1的MDA-MB-231细胞中p21蛋白表达降低,CDK4蛋白表达升高(图4,P<0.01),意味着细胞周期进程加快,进而促进TNBC细胞的增殖。
综上所述,WHSC1在TNBC中高表达,WHSC1能够促进TNBC细胞的增殖能力,其分子机制有待进一步的研究。

