介孔TiO2纳米粒在声动力学治疗肝细胞肝癌应用的生物相容性评估
王 希 汤 阳 张小龙 徐亚丹 王文平,2△
(1复旦大学附属中山医院超声科 上海 200032;2复旦大学超声医学与工程研究所 上海 200032)
肝细胞肝癌是最常见的肝脏恶性肿瘤[1],其转移复发率、病死率高[2],许多患者就诊时已处于中晚期,失去手术机会,高强度聚焦超声(high intensity focused ultrasound,HIFU)是目前声波治疗此类患者的重要手段之一,但对靶区周围正常组织及毗邻重 要 器 官 容 易 造 成 损 伤[3]。 声 动 力 学 治 疗(sonodynamic therapy,SDT)利用声敏剂对肿瘤的靶向定位,从而实现对低强度声波照射部位肿瘤组织的选择性杀伤及正常组织的保护[4-5],是声波治疗实体瘤的研究新热点。
优秀的声敏剂不仅能有效杀伤肿瘤,且具备组织无毒性。传统有机类(卟啉类为代表)声敏剂稳定性、分散性和可修饰性差,很难实现静脉给药,且兼具光敏物质的毒性反应和不良反应。无机二氧化钛(titanium dioxide,TiO2)纳米粒作为声敏剂显示出理想的稳定性和安全性以及优秀的杀伤细胞能力[6]。然而传统TiO2纳米粒具有容易聚集的问题[7],一定程度限制了TiO2纳米粒的医学应用,其家族新成员介孔TiO2纳米粒具有清晰的介孔形貌,其有机-无机杂化以及表面可修饰性对实现特定的纳米医学应用打开了新窗口[8]。本研究旨在探讨介孔TiO2纳米粒作为声敏剂应用的安全性,代谢情况以及声动力治疗的可行性。
资料和方法
主要实验试剂及仪器设备主要试剂:钛酸四丁酯(TBT),醋酸(HAc),PBS 溶液,去离子水,乙醇,聚乙二醇(NH2-PEG5000);MTT 试剂盒,2′,7′-二氯荧光素二乙酸酯(DCFH-DA),HemosILTM试剂盒;新鲜人血浆(上海市血液中心)。仪器设备:50 mL 水热反应釜,透射电子显微镜,Nano ZS90 动态光散射仪,Bio-Tek EL×800 酶标仪,ITO US-100型超声治疗仪,荧光显微镜IX81,ACL7000 全自动血凝分析仪,等离子体原子发射光谱仪ICP,7170 全自动生化分析仪。
制备介孔TiO2纳米粒溶剂热处理预水解软模板合成法:将醋酸15 mL 与1 mL 钛酸四丁酯在水热釜中充分磁力搅拌后加入0.5 mL 去离子水,150 ℃水热处理12 h,冷却至室温,离心收集产物(13 000 r/min,离心半径:10 cm,离心时间:10 min,全文同),分别于乙醇及去离子水中共洗涤3 次,离心收集产物,分散于去离子水中。加入聚乙二醇NH2-PEG5000的去离子水溶液(0.5 mg/mL,100 mL),磁力搅拌48 h 后离心收集并于去离子水中洗涤3 次。
介孔TiO2 纳米粒介导声动力学对HepG2 细胞的作用实验分为对照组、TiO2纳米粒共培养组、超声辐照组和SDT 组(声动力治疗组)。将HepG2肿瘤细胞接种至共聚焦专用培养皿,细胞贴壁后TiO2纳米粒共培养组及SDT 组换以50 μg/mL 浓度TiO2纳米粒的培养液。继续共培养12 h,用PBS 小心冲洗。在4 组共聚焦培养皿中加入DCFH-DA 溶液(调整终浓度为10 μmol/L),避光静置20 min。超声辐照组及SDT 组采用1.5 W/cm2,占空比20%,时长60 s 的超声参数于培养皿底部(不含气无菌耦合剂)对行超声辐照。在激光共聚焦荧光显微镜下,选择488 nm 激发波长和525 nm 发射波长观察细胞情况。
将HepG2 肿瘤细胞(5×103/孔,每孔100 μL)接种至96 孔板中,细胞贴壁后用梯度浓度(25、50、100、200、400 μg/mL)TiO2纳米粒的培养液替换原培养基。孵育结束后,用培养液清洗2 次。每孔加入0.6 mg/mL MTT 的培养液,共培养4 h 后弃液加入100 μL DMSO,在Bio-TekEL×800 酶标仪上测试吸光度(λ=490 nm)。细胞存活情况以百分比表示(n=6)。
介孔TiO2 纳米粒静脉注射安全性评估TiO2纳米粒配制成梯度浓度的PBS 溶液(25、50、100、200、300 和500 μg/mL,n=5)。取50 μL 的混合溶液加入到450 μL 人血浆中,离心后吸取上清液,采用HemosILTM试剂盒,在全自动血凝分析仪中,检测凝血酶原时间(prothombin time,PT)、纤维蛋白原(fibrinogen,FIB)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT),以不加血浆作为空白对照。
实验采用SPF 级昆明小鼠,将TiO2纳米粒配置成生理盐水溶液,通过尾静脉注射给药,梯度给药剂量为10、50、150 mg/kg(n=5,0.1 mL/只)。2 周后,用眼球后静脉采集血液标本,部分收集在EDTA K2 抗凝管进行全血测定,部分离心取上清于7170 型全自动生化分析仪进行生化检测(血常规、肝功能、肾功能)。取心、肺、肝、脾、肾组织块,经4%甲醛固定后,常规石蜡包埋,4 μm 厚度切片进行HE 染色并观察。
介孔TiO2 纳米粒代谢分布研究建立人HepG2 裸鼠种植瘤模型:将HepG2 细胞悬液100 μL(约5×106个)细胞接种于Balb/c 裸鼠右侧肩背部皮下,7 天后裸鼠注射部位皮下均出现种植瘤,14 天后瘤体直径约10 mm 开始实验。将TiO2纳米粒配置成无菌生理盐水溶液,通过尾静脉注射给药,每只剂量50 mg/kg,注射剂量为0.1 mL。昆明小鼠于注射前和注射后24 h、1 周、4 周的时间点,荷瘤裸鼠于注射前和注射后1、2 、4 、8 、18 及24 h,用颈椎脱位法处死(n=5),取主要器官组织(心、肝、脾、肺、肾)及皮下肿瘤组织(荷瘤裸鼠),分别称重并记录,放置于王水(浓盐酸∶浓硝酸=1∶3)中充分消化后,用电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectrometer,ICPOES)测定Ti 元素浓度(功率:1.20 kw;等离子气体流 量:15.0 L/min;雾 化 气 压 力:200 kPa;泵 速:15.0 r/min)。最后,采用(组织中Ti 含量/注射剂量)/组织重量,即ID%/g 计算各器官组织中TiO2纳米粒的聚集浓度。
统计学分析所有数据以±s表示,采用SPSS 22.0 进行统计分析,两组均数比较用LSD 法,P<0.05 为差异有统计学意义。
结 果
介孔TiO2纳米粒理化性质通过N2吸附-解吸技术明确了其介孔特性,所得BET 比表面积、孔容以及孔径分别为96 m2/g,0.27 cm3/g 以及3.8 nm(图1A、B)。通过动态光散射DLS 分析,高度分散的椭圆形纳米粒平均粒径为124.0 nm,其水溶液显现出良好的丁达尔现象,即入射光遇到液体中的粒子发生了散射现象呈现出均匀光带,提示纳米颗粒在水溶液中符合胶体系的特性(图1C),PEG 化的纳米粒通过傅立叶变换(fourier transform infrared,FTIR)红外光谱分析,在1 500 cm-1光谱范围区出现吸收峰,对应Ti-N-O 基团的存在(图1D)。
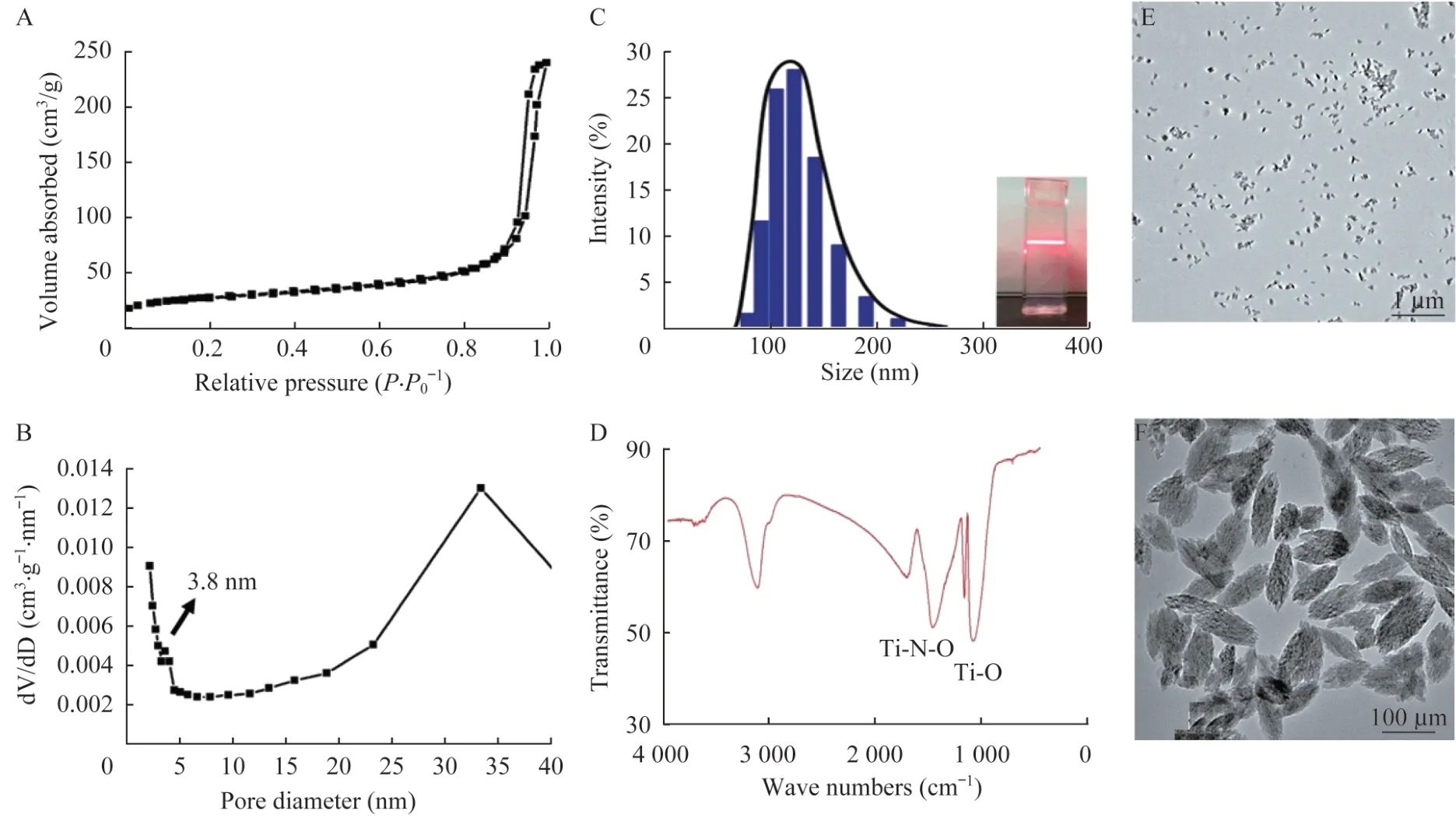
图1 介孔TiO2纳米粒理化性质Fig 1 Physicochemical properties of mesoporous TiO2 nanoparticles
介孔TiO2 纳米粒介导声动力学对HepG2 细胞的作用MTT 还原测试结果表明,各梯度浓度介孔TiO2纳米粒共培养24 h 后,人肝癌HepG2 细胞的相应存活率(n=4)为:99.02%±3.15%(25 μg/mL)、99.85%±7.02% (50 μg/mL) 、97.62%±4.83%(100 μg/mL)、94.14%±6.32%(200 μg/mL)、95.30%±7.86%(400 μg/mL),与对照组比较差异均无统计学意义。
在超声激活纳米粒诱导HepG2细胞内产生ROS实验中,超声单独治疗组以及纳米粒共培养组中,均未呈现出荧光显像,而在SDT 组细胞内,观察到了DCF 所呈现的绿色荧光,表明在这一组肿瘤细胞内产生了大量的ROS(图2)。相同超声参数及纳米粒浓度下,MTT 测试超声辐照组细胞存活率为97.05%±2.27%,SDT 组存活率为78.09%±4.42%。
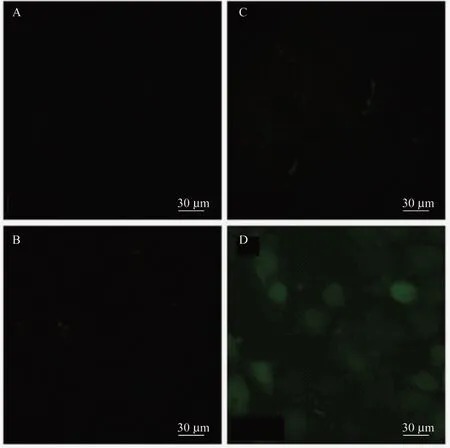
图2 DCFH-DA 显影介孔TiO2纳米粒介导声动力治疗后细胞内ROSFig 2 DCFH-DA showing intracellular ROS by mesoporous TiO2 nanoparticles mediated sonodynamic therapy
介孔TiO2 纳米粒静脉注射安全性评估测得PT、FIB 和APTT 见图3。25、50、100、200、300 和500 μg/mL 浓度的PEG-MTNs 的PT 值(s)分别为16.45±0.06、 16.07±0.11、 16.57±0.06、 16.50±0.10、16.33±0.12、16.13±0.11 和15.70±0.17。FIB值(g/L)的样品测值分别为2.52±0.05、2.80±0.04、2.66±0.16、2.66±0.16、2.56±0.06、2.52±0.05 和2.52±0.11。 APTT 值(s)的 样 品 测 值 分 别 为32.33±0.05、 32.47±0.06、 33.30±0.17、 33.07±0.23、33.43±0.12、34.03±0.15 和34.43±0.23。各浓度样品间同一指标的测值差异均无统计学意义。
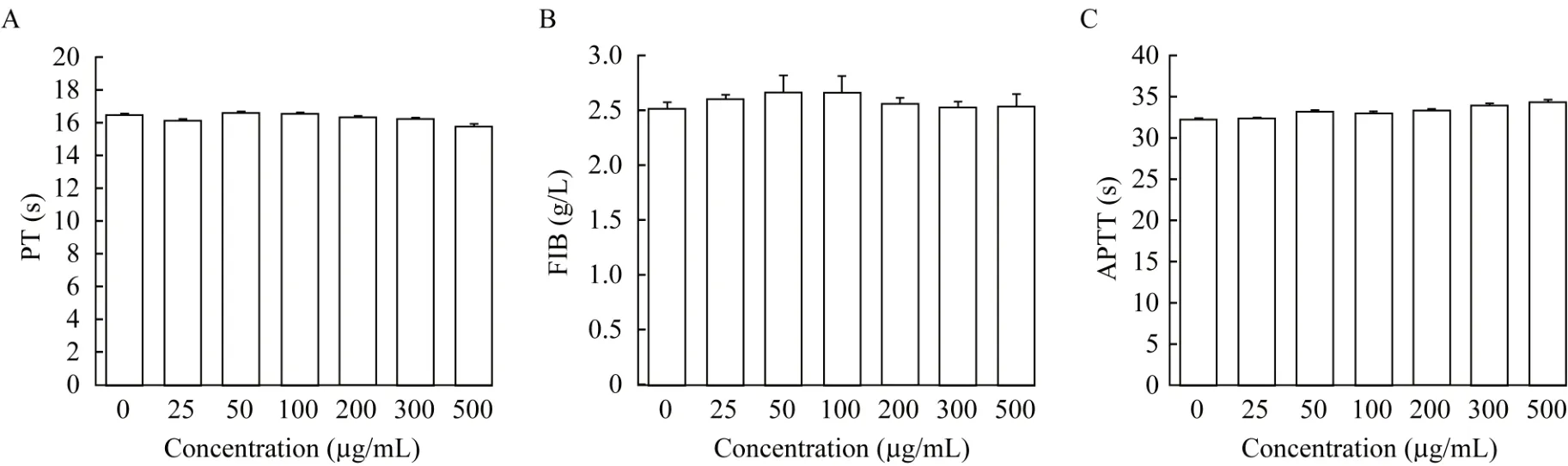
图3 介孔TiO2纳米粒血液凝集实验Fig 3 Coagulation assay of mesoporous TiO2 nanoparticles
尾静脉注射介孔TiO2纳米粒后2 周内,无动物给药后死亡,小鼠皮肤未发现明显破损,未发现明显的脱毛现象,小鼠无异常行为(包括异常的发声、呼吸困难,行动困难,易激惹或攻击行为等)。小鼠所有血液学指标和生化指标结果与对照组比较,差异均无统计学意义(图4)。各梯度给药剂量组的重要脏器组织切片HE 染色结果显示,组织结构清晰完整,与对照组相比较,未发现明显差异(图5)。
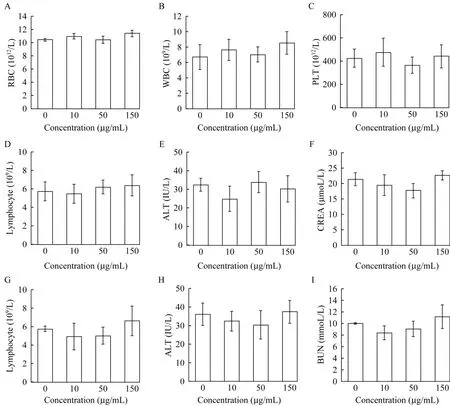
图4 介孔TiO2纳米粒静脉注射后小鼠血常规及肝肾功能检测Fig 4 Hematology,liver and kidney function in mice after intravenous injection of mesoporous TiO2nanoparticles
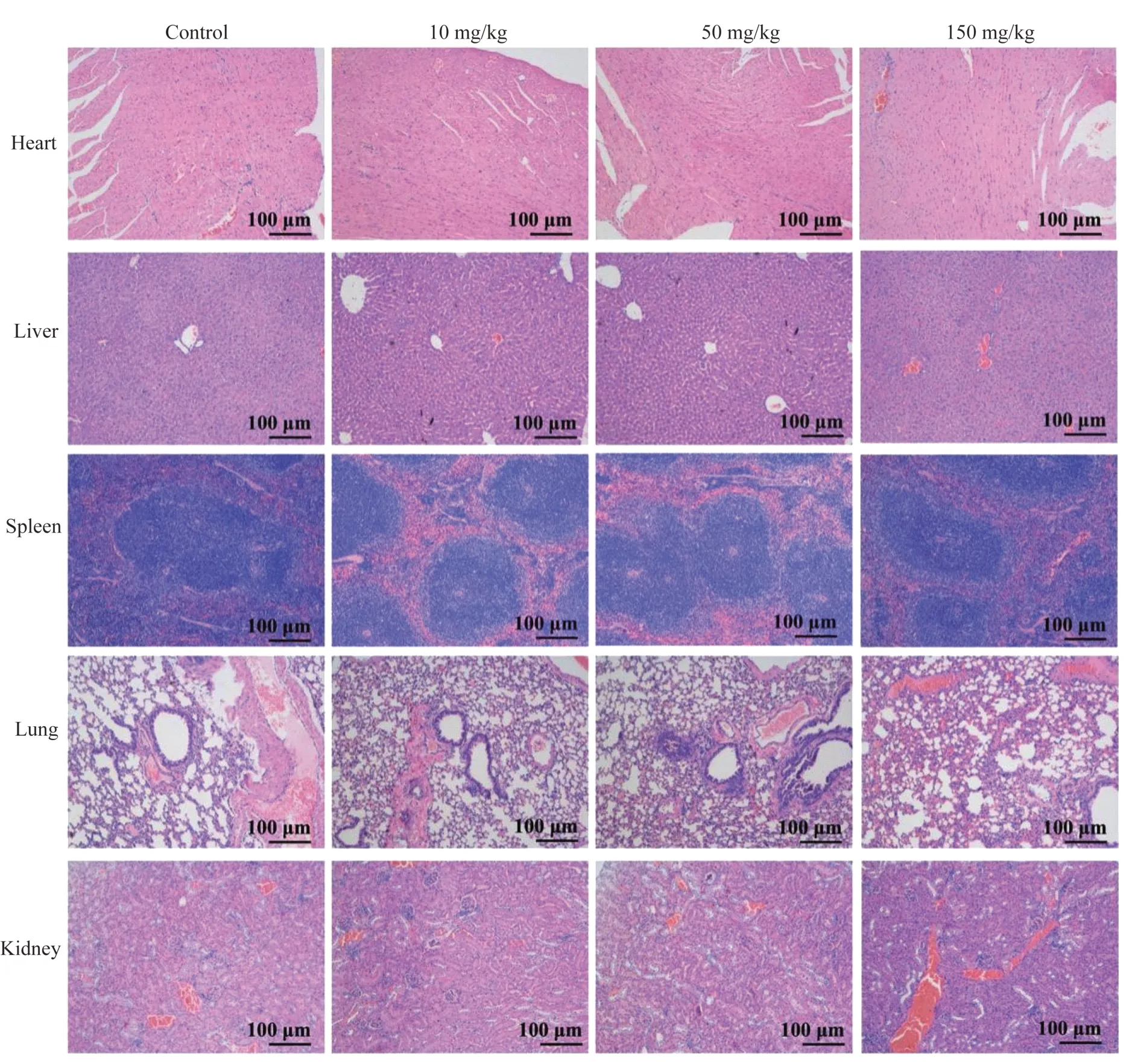
图5 介孔TiO2纳米粒静脉注射后小鼠内脏切片HE 染色Fig 5 HE staining of mouse visceral sections after intravenous injection of mesoporous TiO2nanoparticles
介孔TiO2 纳米粒代谢分布研究ICP-OES 测定结果根据(组织中Ti 含量/注射剂量)/组织重量计算后,如图6 所示。介孔TiO2纳米粒通过体循环浓聚在网状内皮系统肝脾组织(注射后24 h 达22.34 %总Ti 量)并在1 个月内逐渐代谢完全(图6A)。在HepG2 种植瘤裸鼠研究中,肝脾组织在2 h的Ti 含量较1 h 降低(P<0.05),而4 h 时呈现明显上升(P<0.05),8 h 达峰(51.32%),随后出现较大幅度的下降。此外,注射后1 h 肿瘤组织Ti 含量达到6.74%,并于1 天内呈现维持浓度。

图6 ICP-OES 测定介孔TiO2纳米粒静脉注射后代谢分布Fig 6 Metabolic distribution of nanoparticles determined by ICP-OES after intravenous injection of mesoporous TiO2nanoparticles
讨 论
声动力学治疗是对肿瘤部位先给予声敏剂,后用低强度超声对肿瘤部位进行辐照,产生ROS 从而杀伤肿瘤[5,9]。SDT 研究初期,声敏剂选择主要为部分光敏剂,集中在卟啉类有机物[10-11](5-ALA,ATX-70等),然而其稳定性和分散度欠佳,难以通过增强的高通透性和滞留效应(enhanced permeability and retention effect,EPR)沉积于肿瘤组织,影响ROS 产能,且常伴随光照性皮炎等不良反应。新近的研究通过脂质体包裹[12-13]、无机纳米粒携带[14-15]、自组装纳米粒[16]为有机声敏剂开辟了新道路。无机TiO2因生物安全性良好近年受到SDT 领域的关注[6,17],然而其本身的化学特性限制了静脉给药。
本研究采用新颖的软模板方法成功合成了具有良好分散度和均一性的椭圆形介孔TiO2纳米粒(图1),其中最低能量原则即具有热力学稳定性质的脱钛矿二氧化钛Wulff 结构占据了主导地位(高达94%)[18-19]。钛前驱体遇水后水解产生钛的低聚物以及正丁醇,而后凝结形成Ti-O-Ti 框架。原位形成的醋酸丁酯具有相对较长的碳链能形成微团,与水解/凝结的钛低聚物共同形成纳米介孔的结构(图7)。这种有机/无机的自组装过程类似于传统无机介孔硅的形成过程[20-21]。通过非共价键形式连接NH2-PEG5000的氨基和纳米粒的Ti,进一步改善溶液中的稳定性。可见光(波长在400~700 nm)透过纳米粒水溶液呈现出的丁达尔现象(图1C)提示其水溶液符合胶体系特性,具有高度分散性和理想直径,为静脉注射提供了保障。
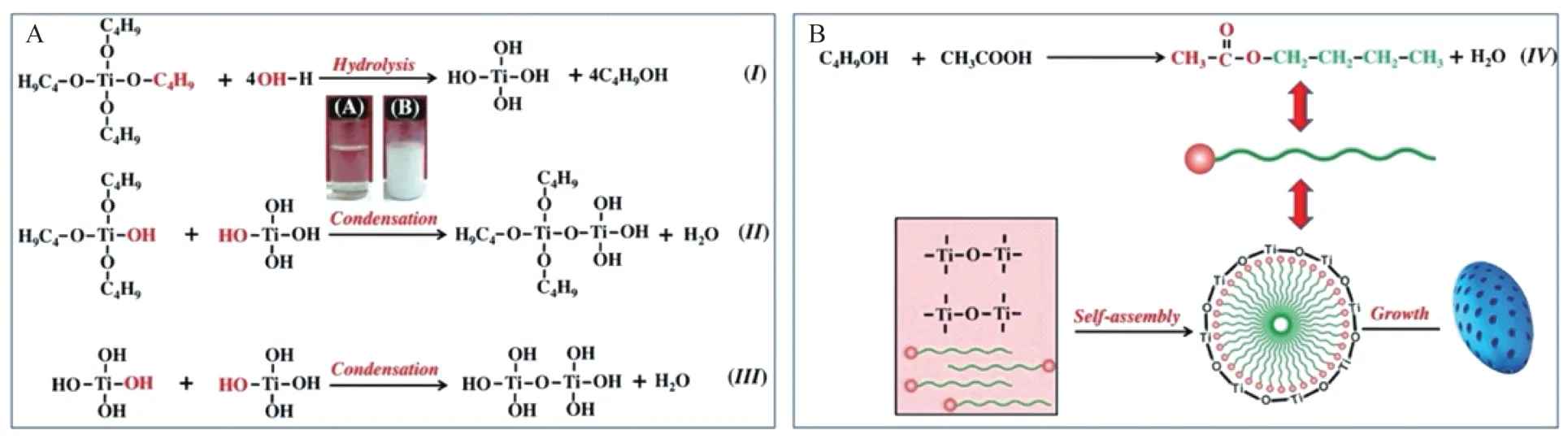
图7 介孔TiO2纳米粒合成机制及微结构Fig 7 Mesoporous TiO2 nanoparticles nanoparticle synthesis mechanism and microstructure
在声动力疗法抗肿瘤的众多机制理论[5,9]中,超声空化作用产生ROS 被广泛认可。超声能激活有机 类 声 敏 剂 在 肿 瘤 细 胞 内 产 生ROS[10,22-23],上 调 凋亡相关蛋白(如Bax、Caspase-9 等)[24],损坏线粒体,诱导细胞凋亡。本实验用荧光探针DCFH-DA 进行ROS 测定。1.5 W/cm2、占空比20%、时长60 s 的超声参数下,超声辐照组细胞存活率为97.05%±2.27%,证明了该参数对细胞的安全性,而在加入纳米 粒(50 μg/mL)后,存 活 率 下 降 至78.09%±4.42%,表明该参数能诱导纳米粒损伤细胞,而非超声热效应和机械效应杀伤细胞。当探针与HepG2细胞共孵育时,DCFH-DA 穿过细胞膜水解成DCFH 滞留于细胞内,后进行超声辐照即刻观察。所有组别中仅SDT 组的细胞内观察到了绿色荧光(DCFH 被ROS 转化成了DCF),表明纳米粒能大量进入细胞质内发挥声敏作用产生ROS。超声辐照所产生的空化效应能介导声光触发和热解反应,进一步激活具有半导体性质的TiO2纳米粒,使之从高电子能的价带产生电子(e-)形成低电子能的导带,造成价带出现电子空穴(h+)。电子(e-)和电子空穴(h+)进一步与溶解的氧分子及水分子进行反应,从 而 产 生 具 有 毒 性 的ROS(O2-、HO2和OH)[6,16-17]。近年TiO2抗肿瘤的研究也印证了ROS理论[25-27]。此外,粒径(124 nm)大小使其本身成为了空化核,增加超声声能在细胞质内沉积从而局部增强SDT 作用,几种因素产生的大量ROS 在细胞质内直接损伤细胞。
声敏剂不仅要求高ROS 产能,还应具有良好的生物相容性,其化学特性、药代动力学特征都是SDT 疗 效 的 关 键[28]。共 培 养 实 验 中,在 最 高400 μg/mL 纳米粒浓度条件下,细胞存活率依然高达95.30 %,表明位于胞质中的纳米粒没有对细胞器产生损伤,印证了其无毒或极低毒性的特性。
为确保静脉途径给药,血液相容性评估尤为重要。本研究将APTT 作为内源性凝血因子缺乏的筛选试验,PT 反映外源性凝血系统情况,FIB 反映纤维蛋白原的含量。所有指标在各纳米粒浓度组间无明显差异,表明没有激活凝血途径,对血浆的凝血/抗凝性能没有明显影响。部分介孔材料由于比表面积大,吸附容量高而易引起凝血。本研究合成的纳米粒比表面积小,预先PBS 浸润减少吸附,均有效降低凝血的激活。实验进一步通过小鼠血液系统(三系情况)和生化指标(肝,肾功能),以及主要脏器HE 染色观察来全面评估静脉注射后的生物安全性。静脉注射2 周内没有出现动物死亡,呼吸困难或行为异常。血液生化指标与对照组间均无显著差异,组织切片观察没有异常(图3、4),证实了介孔TiO2纳米粒静脉注射的生物安全性,蓄积于脏器的纳米粒对正常细胞较为安全。
我们从纳米粒药代分布研究结果推测纳米粒通过静脉进入体循环后,2 h 时已有部分代谢,而4 h时网状内皮系统通过血液循环拦截了身体其他部分代谢的纳米粒而呈现上升的趋势。此外,注射后1 h 肿瘤组织Ti 含量达到6.74%,并于1 天内呈现维持浓度,证实纳米粒能通过静脉途径有效蓄积于肿瘤组织。由此,找准组织低浓度、肿瘤高浓度的时间窗为SDT 的应用奠定了基础。
本研究采用软模版方法合成了介孔TiO2纳米颗,系统性证实了其无毒性和静脉注射安全性,并从药物代谢特点为SDT 应用找到时间窗口。介孔结构赋予其进一步作为药物载体与SDT 协同抗肿瘤作用的潜能,为基于TiO2的生物纳米系统在生物医学领域的应用开辟了一条新的道路。
作者贡献声明 王希 构思和设计,文献调研,可行性分析,构建模型,数据分析和保存,绘制图表,获取资助,完成实验,论文撰写和修订。汤阳,张小龙,徐亚丹 文献调研和整理,数据搜集,执行实验,构建模型,绘制图表。王文平 构思和设计,可行性分析,监督指导,获取资助,论文修订。
利益冲突声明 所有作者均声明不存在利益冲突。

