阳离子交换树脂催化合成甲酸异丁酯的动力学研究
高 媛,鲁将丰
(闽南科技学院 生命科学与化学学院,福建 泉州 362000)
甲酸异丁酯是一种常见的化工有机原料,广泛用作溶剂、香料、杀虫剂,以及色谱分析和有机合成等工业领域中[1-2]。目前,国内甲酸异丁酯的生产通常以甲酸及异丁醇水溶液为原料,采用浓硫酸等液体强酸作催化剂,直接酯化合成甲酸异丁酯粗品,再经精制可制得成品。该方法操作简单,但采用的液体酸催化剂容易对生产设备造成腐蚀,且在粗品产物中不易回收,导致设备投入和精制分离成本过高。因此,亟待使用一种新型催化剂以改善直接酯化法中液体酸催化剂的缺点。
强酸性阳离子交换树脂作为一种新型固体酸催化剂,具有良好的催化活性、不腐蚀设备、易分离和可循环利用等优势[3-4],在酯化反应中已有广泛的应用[5-11]。因此,本工作以NKC-9强酸性阳离子交换树脂为催化剂,在间歇釜式搅拌反应装置中,消除内扩散影响的前提下,考察多个实验因素对催化速率的影响,探讨了NKC-9催化合成甲酸异丁酯的反应动力学,最后获得反应动力学基础参数,旨在为催化合成甲酸异丁酯的工艺设计及生产提供基础数据。
1 实验部分
1.1 实验试剂
甲酸,分析纯,国药集团化学试剂有限公司;异丁醇,分析纯,国药集团化学试剂有限公司;甲酸异丁酯,色谱纯,上海阿拉丁生化科技股份有限公司;NKC-9强酸性阳离子交换树脂,粒度 0.6 mm,江阴市南大合成化学有限公司。
1.2 实验方法
NKC-9催化合成甲酸异丁酯反应动力学实验采用三口烧瓶为反应器,装置装有恒温磁力搅拌器、冷凝器、干燥器、温度计和微量取样管。反应器由恒温油浴控制反应温度,精度为 ±0.5 ℃。实验进行时,反应器中加入定量异丁醇和催化剂,开启磁力搅拌,通过油浴预热至反应温度。待温度计读数稳定后,反应器中加入定量已预热的甲酸,计为反应初始时间并计时。反应每隔一定时间取样,取样后立即采用冰浴冷却,并及时分析,防止反应进一步进行。待前后多次试样的产物浓度变化相近,可近似认为反应达到平衡。实验过程中确保取样前用反应液润洗取样器,同时保证总取样量小于反应液的3%,消除取样对反应的影响。改变实验条件,重复上述实验方法考察其他实验变量影响。
1.3 分析方法
采用普兰德数字瓶口滴定器(型号Titrette 50 mL)分析取样的组成,分析方法为酸碱中和法。数字瓶口滴定器精度0.01~50.00 mL。
2 结果与分析
2.1 外扩散的影响
测定甲酸异丁酯合成反应动力学,实验选用粒径一致的NKC-9阳离子交换树脂,因此首先考察外扩散对该反应的影响。消除外扩散影响可通过增大搅拌速率实现,不同搅拌速率对反应速率的影响如图1所示。
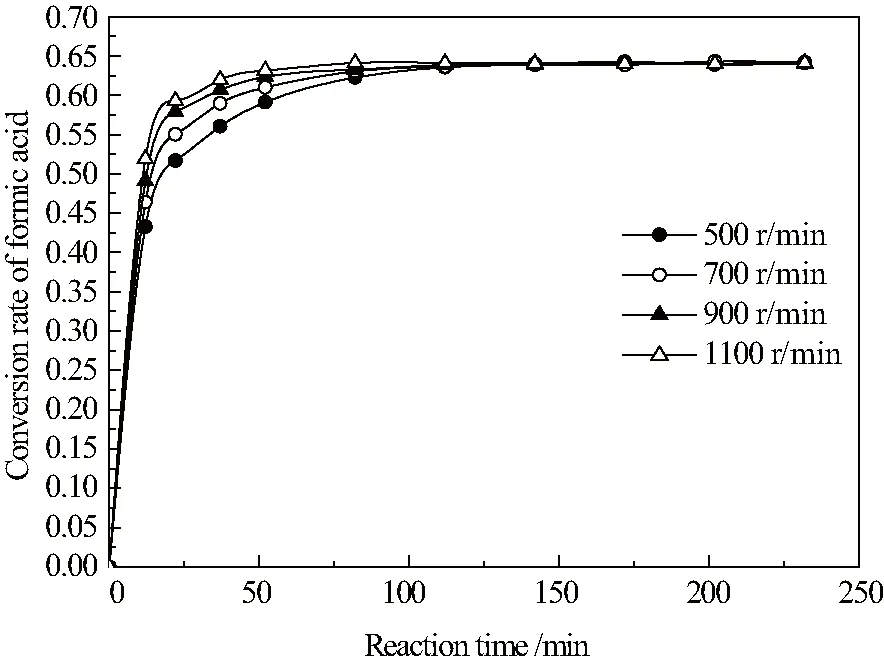
图1 不同转速对甲酸酯化反应速率的影响
图1表明:搅拌速率由 900 r/min 递增至 1100 r/min,两者反应速率相近,即认为搅拌速率为 900 r/min 时已可以消除外扩散对反应的影响。
2.2 催化剂用量的影响
催化剂对反应速率的影响取决于催化活性中心位点的数量,即反应速率受催化剂用量影响。不同质量分数的催化剂对反应速率的影响如图2示。
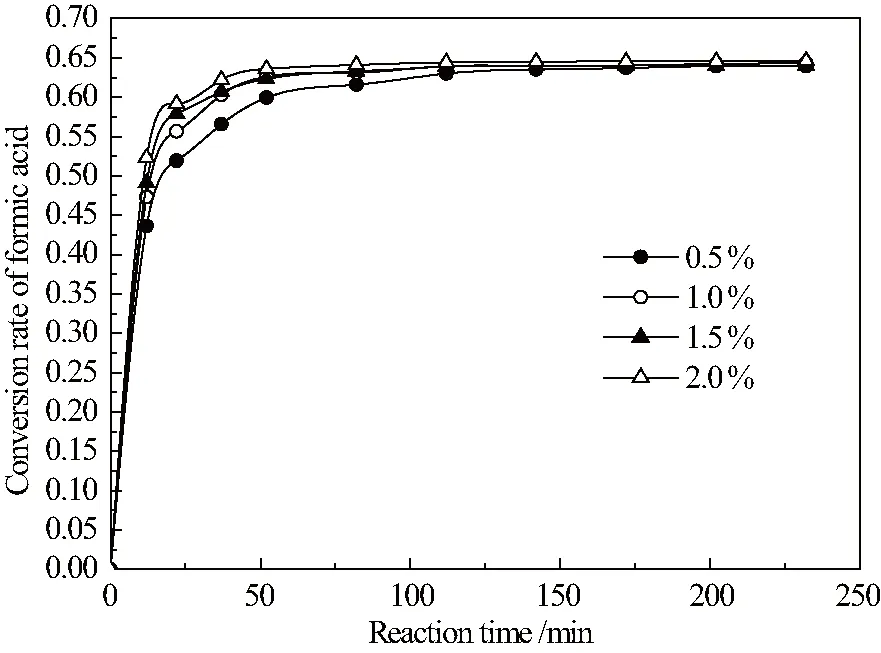
图2 不同催化剂用量对甲酸酯化反应速率的影响
图2表明:催化剂质量分数由0.5%递增至2.0%,酯化反应速率明显提高,同时平衡转化率不变。催化剂质量分数由1.5%递增至2.0%,酯化反应速率提高不再显著,两者速率相近。一般认为,受速率控制的酯化反应其反应速率受限反应温度和原料比等因素,催化剂用量达到一定量后,反应速率不再因催化活性中心位点数量而变化。
2.3 反应温度的影响
反应温度对吸热或放热反应的反应速率和平衡转化率有较大影响。但对反应物为共沸组分的多元复杂共沸体系而言,反应温度的影响有一定限制。不同温度对反应速率的影响如图3示。

图3 不同反应温度对甲酸酯化反应速率的影响
图3表明,反应温度由 333.15 K 提高至 358.15 K,在反应的前 50 min 反应速率明显加快,反应达到平衡的时间缩短,但平衡转化率提高不显著。由此可初步认为,该酯化反应为弱吸热反应,提高反应温度有助于加快反应速率。但由于体系存在复杂的多元共沸组成,在常压下提高反应温度影响体系反应物共沸情况,因此反应平衡转化率没有显著提高。
2.4 醇酸比的影响
反应中增加某一反应物的组成有助于促进化学平衡向正反应方向移动,提高反应的平衡转化率。不同醇酸比对反应速率的影响如图4示。
图4表明:提高醇酸比,平衡前反应速率加快,平衡转化率提高。醇酸比为3∶1,平衡转化率可达80%左右。
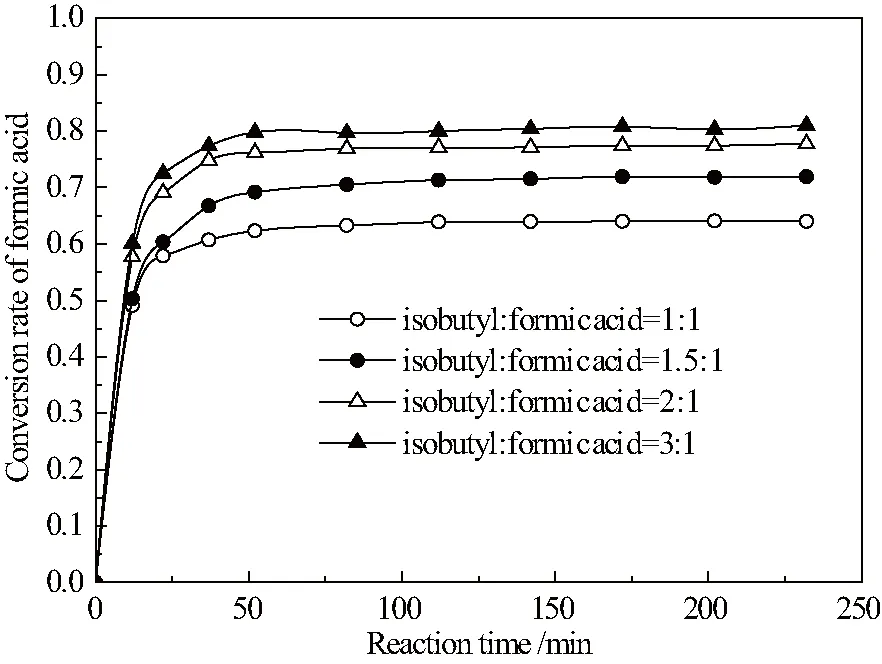
图4 不同醇酸比对甲酸酯化反应速率的影响
2.5 反应动力学
强酸性阳离子交换树脂催化过程中易解离出H+,类似于均相酸性催化酯化反应机理,因此采用拟均相反应模型[12-15]关联反应动力学数据。甲酸与异丁醇酯化是二级可逆反应,记甲酸为A,异丁醇为B,产物为C和D,反应速率表达式如式(1):
(1)
式中:CA~CD为t时刻各组分的浓度,k+和k-分别为正反应速率常数和逆反应速率常数,化学平衡常数Keq关系式如式(2):
Keq=k+/k-
(2)
设甲酸初始浓度为CA0,初始醇酸比为M,t时刻甲酸的转化率为xA,则式(1)可写为:
(3)
甲酸酯化反应平衡时,平衡常数与浓度关系如式(4):
(4)
按式(4)计算不同反应温度下的平衡常数,按式(3)代入平衡常数等项,拟合得正反应速率常数,并根据式(2)计算得逆反应速率常数,如表1。
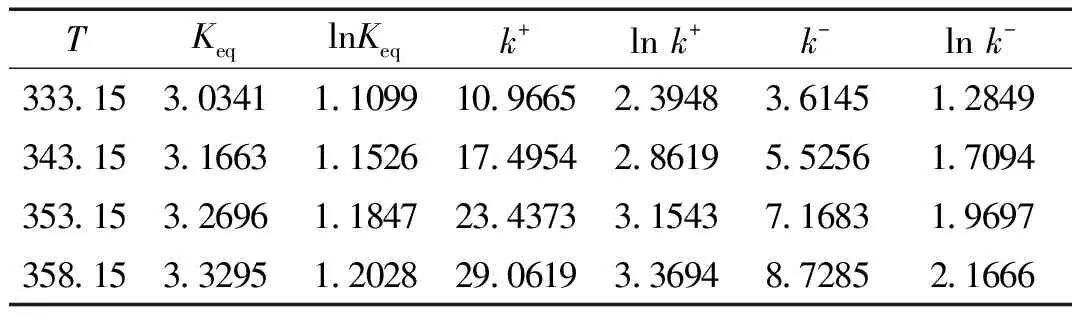
表1 各温度下的平衡常数值和正逆反应速率常数值
分别作1/T与lnKeq、lnk+和lnk-一阶线性拟合,如图5至图7所示,所得关系式如式(5)~(7)。
(5)
其中,线性相关度R2=0.997。
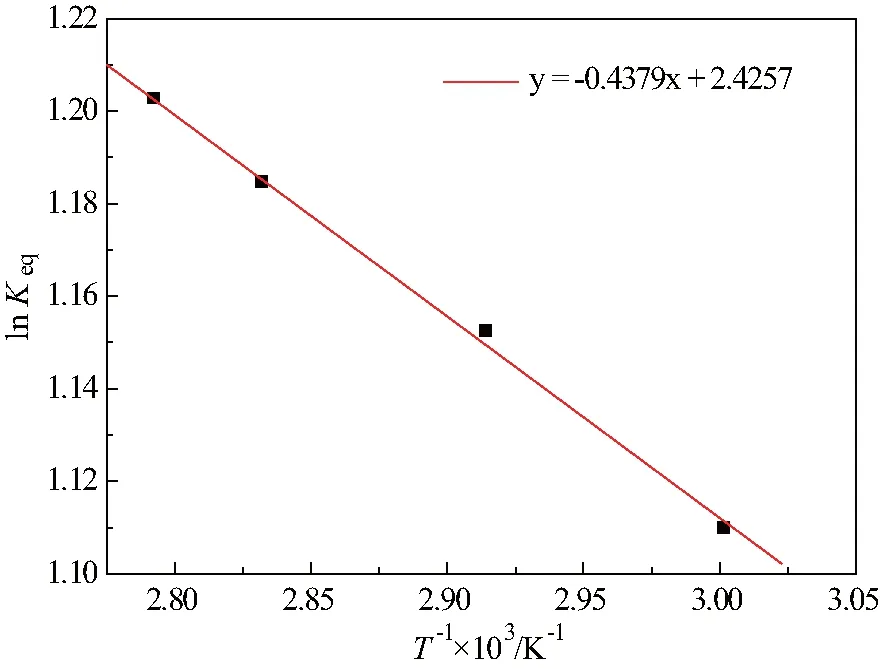
图5 温度与反应平衡常数的关系
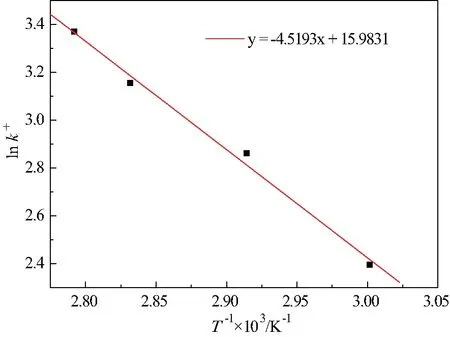
图6 温度与正反应速率常数的关系

图7 温度与逆反应速率常数的关系
(6)
其中,线性相关度R2=0.993。
(7)
其中,线性相关度R2=0.993。
根据范特霍夫方程,变换方程并代入式(5)线性拟合结果,可得温度与平衡常数关系式,如式(8)。
(8)
由式(8)得,甲酸与异丁醇酯化反应为微吸热反应,其反应热为:3.6407 kJ·mol-1
根据阿伦尼乌斯方程,代入式(6)、式(7)拟合结果,可得温度与正、逆反应速率常数关系式,如式(9)、式(10)。
(9)

(10)
由式(9)得,正反应指前因子A+=8.7372×106L·mol-1·min-1,Ea+=37.5735 kJ·mol-1。
由式(10)得,逆反应指前因子A-=7.7236×105L·mol-1·min-1,Ea-=33.9319 kJ·mol-1。
2.6 反应动力学模型验证
将平衡常数及正逆反应速率常数关系代入上述拟均相反应动力学模型式(3),计算得各温度下t时刻甲酸的转化率拟合值,并与实验数据对比,验证上述拟均相反应动力学模型的有效性,关联结果如图8示。
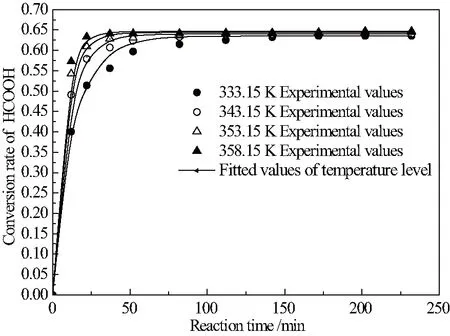
图8 各温度下的反应速率实验值与拟合值对比
图8表明,不同温度下的甲酸酯化反应速率实验值与拟合值接近重合,即验证上述拟均相反应动力学模型(3)可准确描述甲酸与异丁醇酯化反应动力学过程。
3 结论
1)本工作选用NKC-9强酸性阳离子交换树脂为甲酸异丁酯合成反应催化剂,在间歇釜式反应实验装置中,保持消除内外扩散影响的条件,采用控制变量法考察不同实验因素对甲酸反应速率及平衡转化率的影响。结果表明,在催化剂用量和反应温度的一定范围内,增大变量有助于显著提高甲酸酯化反应速率。提高反应初始醇酸比,反应速率加快,平衡转化率显著提高。
2)根据拟均相反应动力学机理,建立了甲酸异丁酯合成反应动力学模型,并通过拟合动力学实验数据,计算得相关模型参数:(化学平衡常数表达式如(8)),甲酸异丁酯合成反应为微吸热反应,其反应热为3.6407 kJ·mol-1;(正逆反应速率表达式如(9)、(10)),正反应活化能为 37.5735 kJ·mol-1,正反应指前因子为8.7372×106L·mol-1·min-1;逆反应活化能为33.9319 kJ·mol-1,逆反应指前因子为7.7236×105L·mol-1·min-1。
3)由拟均相反应动力学模型计算得不同温度条件下的甲酸酯化反应速率拟合值,并与实验值进行比较可知,不同条件下的实验反应速率曲线与拟合反应速率曲线接近重合。因此,拟均相反应动力学模型可准确描述甲酸与异丁醇酯化反应动力学过程,其动力学参数可为工艺稳态模拟探究提供理论基础。

