重组人角质细胞生长因子2对辽宁绒山羊血清KGF-2浓度的影响
孙亚波,朱延旭,冀红芹,贾富勃*,王春艳,吉尚雷,全治国,刘媛缘
(1.辽宁农业职业技术学院,辽宁 营口 115009;2.辽宁省现代农业生产基地建设工程中心,辽宁 沈阳 110032;3.辽宁省辽宁绒山羊原种场有限公司,辽宁 营口 115200)
角质细胞生长因子2(KGF-2)是成纤维细胞生长因子家族(FGFs)的一员,也称成纤维细胞生长因子-10(FGF10)。KGF-2分子全长627 bp,编码蛋白由208个氨基酸残基组成[1]。KGF-2具有促进上皮细胞生长、增殖和分化的功能[2],参与并调控多种组织器官的形成。有研究发现,敲除KGF-2基因大鼠的肺和前后肢未发育,牙齿和毛囊等也存在发育缺陷[3]。有研究认为,KGF-2存在于真皮乳突中,对皮肤组织和毛囊的发育具有调控作用[4]。严家荣等[5]研究发现,重组角质细胞生长因子2(rhKGF-2)对治疗试验大鼠角膜烧伤的效果较好;马丽等[6]研究发现,烫伤大鼠外用rhKGF-2可促进皮肤伤口愈合和毛发再生;王泽[7]研究发现,脱毛大鼠采用rhKGF-2涂抹给药,试验后第14 d可明显看到毛发再生。
上述文献启示,外源KGF-2可调控动物的毛发生长。柳楠等[8]对敖汉细毛羊不同部位皮肤毛囊中FGF10的mRNA和蛋白表达量进行对比研究发现,FGF10的蛋白表达量与毛囊发育存在正调节作用。羊绒是绒山羊皮肤内次级毛囊生长的一类无髓毛,经济价值非常高。本试验设想通过外源给药的方式,将rhKGF-2补充进绒山羊皮内,探讨其能否促进其次级毛囊发育,提升产绒量。已有文献多数采用外用涂抹给药方式,但在绒山羊生产实际中没有可操作性;外源补充rhKGF-2在动物体内存留量和存留时间决定了其发挥效果的显著性。本研究主要探讨rhKGF-2不同方式和不同剂量对绒山羊体内KGF-2浓度的影响,期望筛选出适宜的剂量参数和合适的给药方法,实现一次性给药使动物体内KGF-2浓度维持较长时间,为后续研究KGF-2调控绒山羊绒毛生长提供参考。
1 材料与方法
1.1 试验设计
试验动物来自辽宁省辽宁绒山羊原种场,选择24只5~7月龄、体重为(26.95±1.87)kg的辽宁绒山羊,公母各半,随机分为4组,每组6只羊。试验设计与各处理体重见表1。

表1 试验设计与各处理体重Tab.1 Design of experiment and body weight of each treatment单位:kg
试验1组皮下注射rhKGF-2胶原蛋白溶液,试验2组皮下注射rhKGF-2温敏感凝胶溶液,试验3组皮下注射rhKGF-2生理盐水溶液;试验4组为对照,不做KGF-2处理。本试验设3个周期,每个周期18 d,依次给予低、中、高等3个剂量[9-10]处理,分别为每只羊每日10、20、30μg/kg。
1.2 试剂及制备方法
本试验所使用的rhKGF-2购自成都云希化工有限公司,纯度为95%。胶原蛋白粉和温敏感凝胶购自沈阳鼎国生物科技公司。
1.2.1 rhKGF-2胶原蛋白溶液的制备
在无菌操净台下,分别称量5 mg和55 mg的rhKGF-2和胶原蛋白粉[11]于灭菌的10 mL离心管中,加入温度为15~18℃的灭菌超纯水6 mL,玻璃棒搅动,涡旋振荡器振荡3~5 min,KGF-2和胶原蛋白粉充分混匀,达到静止30 min后不分层的状态。将溶液分装于1.5 mL离心管中,-20℃保存。
1.2.2 rhKGF-2温敏感水凝胶溶液的制备
温敏感水凝胶制备方法参照Chen等[12]的冷溶法。
在无菌操净台下,称量2.2 g温敏感凝胶于灭菌的10 mL离心管中,加入温度为4℃的灭菌超纯水6 mL,玻璃棒搅动,振荡器振荡5~10 min,温敏感凝胶充分混匀,无气泡和小的凝胶颗粒。在操作过程中利用冰块间断性地对离心管降温,4℃条件下静置过夜,形成透明溶液。称量5 mg的rhKGF-2加入离心管的溶液,再次振荡混合,达到充分混匀、完全溶解、无气泡、无颗粒、不分层的状态,分装,0~4℃保存。
1.2.3 rhKGF-2生理盐水溶液的制备
在无菌操净台下,分别称量rhKGF-2和灭菌生理盐水5 mg和11 mL于灭菌的15 mL离心管中,涡旋振荡器振荡5~8 min,使溶液完全混匀。分装保存同1.2.1。
1.3 试验方法
试验当日上午,试验动物称重。14:30各组试验动物分别于左侧颈部皮下注射,注意将温敏凝胶试剂管始终放置于0~4℃左右的低温盒中取用。

1.4 测定指标及方法
在试验处理前以及处理后6、18、42、90、138、210、258、354、426 h,分别采集试验羊静脉血5 mL,3 500 r/min离心15 min,制备血清,分装至1 mL离心管,-20℃冷冻保存。采用ELASA法,应用华卫德朗DR-200BS酶标分析仪测定绒山羊血清KGF-2水平。
1.5 数据统计与分析
采用Excel 2010软件处理原始数据,SPSS 19.0软件进行单因素方差分析(One-way ANOVA),Duncan's法进行多重比较。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 不同剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化
2.1.1 低剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化(见表2)
由表2可知,3个试验组血清KGF-2浓度均随着时间推移呈先增加后降低的趋势,对照组未发生显著波动。试验处理6 h后,3个试验组血清KGF-2浓度均显著高于对照组(P<0.05)。处理18 h后,3个试验组血清KGF-2浓度均极显著高于对照组(P<0.01)。处理42 h后,3个试验组血清KGF-2浓度均极显著高于对照组(P<0.01),同时试验1组显著高于试验3组(P<0.05)。

表2 低剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化Tab.2 Changesof serum KGF-2 concentration in Cashmere goatstreated with low-doserhKGF-2 单位:ng/L
处理90 h后,试验1组和试验2组血清KGF-2浓度均极显著高于试验3组和对照组(P<0.01)。处理138 h后,试验1组血清KGF-2浓度极显著高于对照组(P<0.01),并显著高于试验3组(P<0.05),试验2组极显著高于试验3组和对照组(P<0.01)。处理210 h及之后,各试验组血清KGF-2浓度差异均不显著(P>0.05)。
从处理前到处理后258 h,3个试验组均在试验处理后42 h达到高峰,其后逐步降低,对照组随着时间推移血清KGF-2浓度无显著的变化。从血清KGF-2浓度绝对值看,试验1组和试验2组在各时间点均略高于试验3组,3个试验组在此期间均高于对照组。
2.1.2 中剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化(见表3)
由表3可知,各试验组血清KGF-2浓度均呈先增加后降低的趋势,对照组未发生显著波动,浓度比较平稳。在试验处理6~42 h后,3个试验组血清KGF-2浓度均极显著高于对照组(P<0.01)。处理90 h后,试验1组和试验2组血清KGF-2浓度极显著高于对照组(P<0.01),试验3组显著高于对照组(P<0.05)。

表3 中剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化Tab.3 Changes of serum KGF-2 concentration in Cashmeregoats treated with middle-dose rhKGF-2 单位:ng/L
处理138 h后,试验1组血清KGF-2浓度极显著高于试验3组和对照组(P<0.01);试验2组显著高于试验3组(P<0.05),并极显著高于对照组(P<0.01);试验3组高于对照组,但差异不显著(P>0.05)。在处理210~258 h后,试验1组和试验2组血清KGF-2浓度极显著高于试验3组和对照组(P<0.01);试验3组与对照组差异不显著(P>0.05)。试验处理后354 h后,各组间差异均不显著(P>0.05)。
从处理前到处理后426 h,试验1组血清KGF-2浓度在试验处理后138 h达到高峰,试验2组则在90 h达到高峰,试验3组在42 h后达到高峰,其后各组均降低;其中试验1组和2组呈近似抛物线形式下降,但试验3组浓度呈近似直线形式急剧下降。对照组随着时间推移血清KGF-2浓度无显著的变化。从血清KGF-2浓度绝对值看,试验1组和试验2组在各时间点明显高于对照组,同时试验1组总体上高于试验2组,试验3组自210 h后,与对照组基本无显著差异。
2.1.3 高剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化(见表4)
由表4可知,各试验组血清KGF-2浓度均呈现随着时间推移先增加后降低的趋势,对照组血清KGF-2浓度未发生显著波动。试验处理6~18 h后,3个试验组血清KGF-2浓度均极显著高于对照组(P<0.01),同时试验3组显著高于试验1组和2组(P<0.05)。在试验处理后42 h后,3个试验组血清KGF-2浓度均极显著高于对照组(P<0.01)。试验处理90~138 h后,试验1组和2组极显著高于试验3组和对照组(P<0.01),试验3组极显著高于对照组(P<0.01)。

表4 高剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化Tab.4 Changesof serum KGF-2 concentration in Cashmeregoatstreated with high-doserhKGF-2 单位:ng/L
试验处理210 h后,试验1组极显著高于其他组(P<0.01),试验2组极显著高于试验3组和对照组(P<0.01)。试验处理258~354 h后,试验1组和2组极显著高于试验3组和对照组(P<0.01)。试验处理426 h后,试验1组显著高于试验3组和对照组(P<0.01),试验2组极显著高于试验3组和对照组(P<0.05)。自处理210 h后,试验3组与对照组差异不显著(P>0.05)。
按照时间轴来对比,试验1组血清KGF-2浓度在试验处理后138 h达到高峰,试验2组则在90 h达到高峰,试验3组为42 h达到高峰,其后逐步降低,对照组随着时间推移血清KGF-2浓度无显著的变化。从血清KGF-2浓度绝对值看,试验1组和试验2组在各时间点均明显高于对照组。
2.2 各处理方式下绒山羊血清KGF-2浓度的变化
2.2.1 胶原蛋白溶液处理方式下绒山羊血清KGF-2浓度的变化(见图1)
由图1可知,随着注射剂量增加,血清中KGF-2的峰值出现时间由42 h逐渐延后至138 h;从各个时间点的血清KGF-2的绝对值看,提高注射剂量可使血清KGF-2浓度增加、延长血清KGF-2高水平维持时间。

图1 胶原蛋白溶液处理方式下绒山羊血清KGF-2浓度的变化Fig.1 Changesof serum KGF-2 concentration in Cashmere goatstreated with collagen solution
2.2.2 温敏感凝胶溶液处理方式下绒山羊血清KGF-2浓度的变化(见图2)
由图2可知,检测到随着剂量的增加,血清KGF-2浓度高峰出现时间由18 h顺延至90 h;在42 h后,增加处理剂量可使血清KGF-2浓度增加;提高处理剂量可使血清KGF-2高浓度(高于对照组)维持时间增加至426 h。

图2 温敏感凝胶溶液处理方式下绒山羊血清KGF-2浓度的变化Fig.2 Changes of serum KGF-2 concentration in Cashmeregoats treated with temperature-sensitivegel solution
2.2.3 生理盐水溶液处理方式下绒山羊血清KGF-2浓度的变化(见图3)
由图3可知,低剂量rhKGF-2生理盐水溶液皮下注射,在处理18 h后,血清KGF-2浓度即开始断崖式降低,在138 h接近于试验前水平和对照组水平;中剂量试验和高剂量试验表明,在处理42 h后血清KGF-2浓度达到最高峰,之后呈迅速下降,138~210 h即下降至试验前或对照组水平。
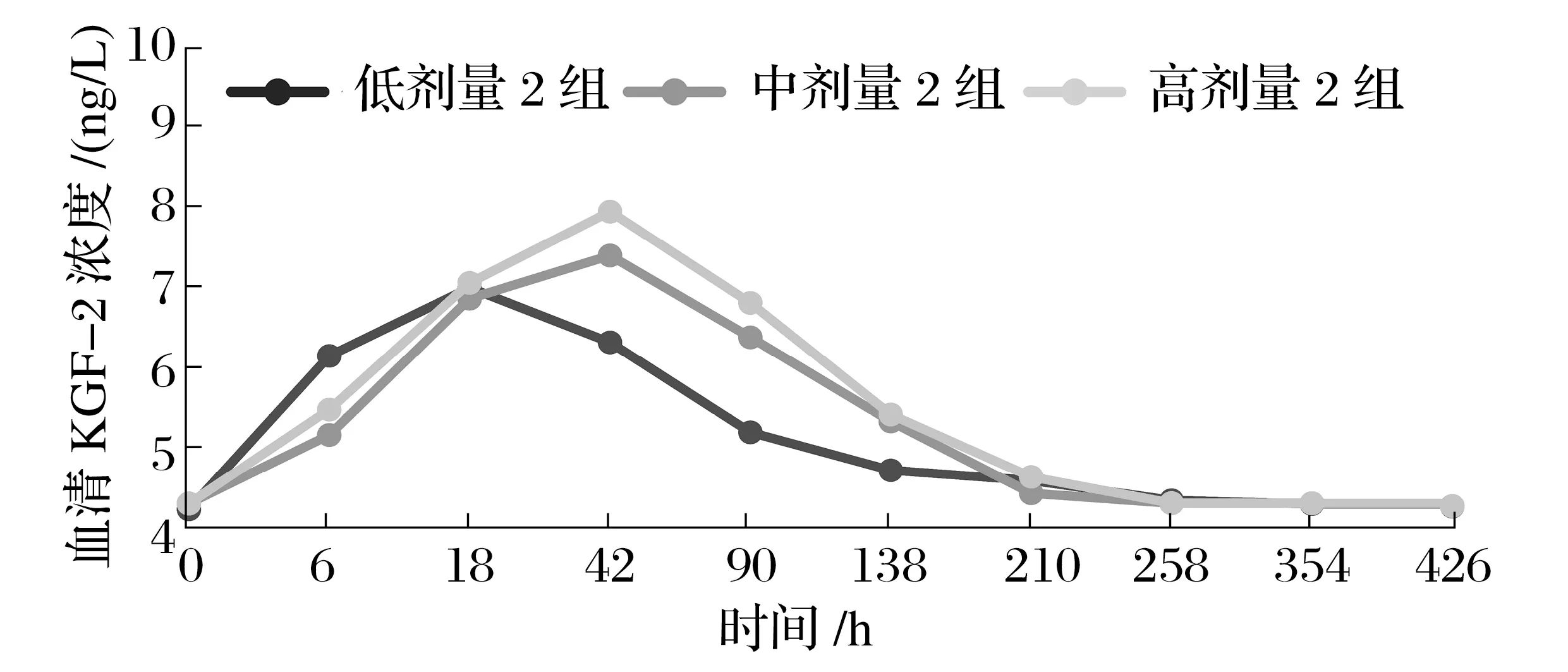
图3 生理盐水溶液处理方式下绒山羊血清KGF-2浓度的变化Fig.3 Changes of serum KGF-2 concentration in Cashmeregoats treated with normal salinesolution
3 讨论
KGF-2对皮肤组织损伤修复[13]和毛囊发育具有重要影响[6],研究其对绒山羊毛囊发育的作用在生产中具有极大的意义。外源补充rhKGF-2对绒山羊毛囊发育的作用要依靠体内持续的高浓度KGF-2水平,其作用效果主要受给药方式和给药剂量的影响。
3.1 不同剂量rhKGF-2处理下绒山羊血清KGF-2浓度的变化
在相同剂量下,以胶原蛋白溶液、温敏感凝胶和生理盐水方式给绒山羊补充rhKGF-2,均可使血清KGF-2浓度先升高而后缓慢下降。
低剂量补充rhKGF-2后,3种处理的绒山羊血清KGF-2浓度在42 h即达到顶峰,而后下降,至240 h左右与对照组相近。中剂量组在138 h前达到顶峰,之后开始下降,至408 h左右与对照组相近。高剂量组则在426 h仍高于对照组。因此,从绒山羊血清KGF-2高浓度维持时间看,高剂量组更适宜。
3.2 不同rhKGF-2处理方式下绒山羊血清KGF-2浓度的变化
3.2.1 胶原蛋白溶液处理方式下绒山羊血清KGF-2浓度的变化
在胶原蛋白溶液给药方式下,不同处理剂量对血清KGF-2的浓度和维持时间均具有一定影响,本研究设置的低、中、高3个剂量分别为10、20、30μg/kg,主要参考宗英[9]和郑杰民等[10]的毒性试验研究得出的KGF-2安全剂量以及王泽等[4]对试验秃毛大鼠每日涂抹给药剂量而设计。利用胶原蛋白作为rhKGF-2的载体可以制作成具有缓释作用的制剂,蔡敏倩[11]以猪皮为原料提取出胶原蛋白,并以此胶原蛋白为原料与KGF-2复合制作成了KGF-2生物蛋白复合海绵,该复合物能在25℃和37℃下稳定保存6个月,经过测定其KGF-2可缓慢释放14 d,释放量为51.33%。
本研究利用胶原蛋白作为骨架材料制成rhKGF-2胶原蛋白溶液,通过皮下注射进辽宁绒山羊体内。注射不同剂量rhKGF-2胶原蛋白溶液后发现,随着注射剂量增加,血清中KGF-2的峰值出现时间从42 h逐渐延后到138 h,从各个时间点的血清KGF-2的绝对值看,提高注射剂量可使血清KGF-2浓度增加、延长血清KGF-2高水平维持时间。
3.2.2 温敏感凝胶溶液处理方式下绒山羊血清KGF-2浓度的变化
温敏感水凝胶是一类具有温敏感特性的智能高分子材料[14-15],可以吸收并保留大量水而维持其三维网络结构,能够应对环境的改变产生智能性响应,是人医载药系统中一类特殊的载体[16],常利用温敏感水凝胶制作成微囊给药[17],从而达到缓释效果。本试验所采用的温敏感凝胶是N-异丙基丙烯酰胺(NIPAM)是热缩温敏水凝胶的一种,在低温下该凝胶溶于水中形成液态凝胶;当温度高于32~35℃时,则聚合形成聚N-异丙基丙烯酰胺(PNIPAM)的固态凝胶。该聚合物可形成网络结构,可作为药物缓释载体[18]。利用温敏感材料做KGF-2缓释载体可以产生延缓KGF-2释放速度的作用[19],生长因子和合适的载体材料组合可以防止蛋白酶水解,有效保护和缓慢释放生长因子[20]。付文亮等[21]曾利用壳聚糖、壳聚糖季铵盐等配制成温敏感材料与KGF-2复合,形成一种敷料,其KGF-2的蛋白活性可基本保持稳定,并具有一定的缓释效果。
本试验将KGF-2在4℃下与NIPAM溶解制成溶液,注射到试验绒山羊皮下。由于羊的体表温度高于32℃,即可形成PNIPAM,KGF-2存在于凝胶网络中即可发挥缓释效果。本试验皮下注射了低、中、高等3个剂量的rhKGF-2,结果显示,随着剂量的增加,血清KGF-2浓度高峰出现时间由18 h顺延至90 h;在处理42 h后,增加处理剂量可提高血清KGF-2浓度;提高处理剂量可使血清KGF-2高浓度(高于对照组)维持时间增加至426 h。
3.2.3 生理盐水溶液处理方式下绒山羊血清KGF-2浓度的变化
生理盐水是动物给药常用的溶剂。本研究发现,低剂量rhKGF-2生理盐水溶液皮下注射18 h后,血清KGF-2浓度即开始断崖式降低,在138 h接近于试验前水平和对照组水平;中计量试验和高剂量试验表明,在42 h时,血清KGF-2浓度达到最高峰,之后呈迅速下降,138~210 h即下降至试验前或对照组水平。由此可知,用生理盐水溶液注射给药后羊体内rhKGF-2快速吸收、快速代谢分解,无法持续发挥作用,此方式在生产实际中的可操作性不强,应用的局限性较大。
综上可知,提高rhKGF-2的剂量均增加了试验绒山羊血清KGF-2的浓度,使血清KGF-2峰值延时出现,使血清KGF-2高浓度(高于对照组)维持时间延长至426 h。合适的缓释时间是rhKGF-2调控羊的绒毛生长在生产中能否施行的关键;本研究发现,给予30μg/kg的剂量可使缓释时间达到接近18 d,效果较为理想。
对比胶原蛋白和温敏感凝胶这两种处理方式发现,二者对KGF-2的延时释放效果相似,且各具优势。胶原蛋白溶液方式处理后血清KGF-2浓度更高,温敏感凝胶处理后羊血清KGF-2浓度在峰值之后下降更平缓;但rhKGF-2温敏感凝胶溶液制作过程中要求在低温条件下操作,否则凝胶不易溶解,比胶原蛋白方式操作复杂。
综上所述,在本研究条件下认为,采用KGF-2胶原蛋白溶液更合适。
4 结论
按照30μg/(kg·d)的剂量配制KGF-2胶原蛋白溶液皮下注射绒山羊后,绒山羊的血清KGF-2浓度在138 h达到高峰,血清KGF-2高浓度(高于对照组)维持时间可达426 h。因此,本试验条件下rhKGF-2的适宜补充剂量为30μg/kg,合适的给药处理方式是胶原蛋白溶液。

