Carb/NH2 固相萃取柱净化-气相色谱-质谱法测定乳粉中二苯胺的残留量
安红梅,王丽娟,李春扬,何蕙园,谢精精
(1.中国食品发酵工业研究院有限公司,北京 100015; 2.中轻检验认证有限公司,北京 100015)
二苯胺是一种常见的杀菌剂、保鲜剂,其能引起变性血红素症,为可疑致癌物[1]。欧盟严格规定了各类食品中二苯胺的限量,其中乳制品中二苯胺的限量为0.05 mg·kg-1[2]。GB 2763-2021[3]《食品安全国家标准 食品中农药最大残留限量》仅规定了生乳中二苯胺的残留限量(0.01 mg·kg-1),并无乳粉中残留限量的规定。为全面评估乳粉进出口风险,应持续有效监控乳粉中二苯胺的残留量。
目前,乳制品中农药残留的检测方法主要有气相色谱法(GC)[4]、气相色谱-质谱法(GC-MS)[5-6]、气相色谱-三重四极杆串联质谱法(GC-MS/MS)[7-8]、液相色谱-串联质谱法(LC-MS/MS)[9-10]等。虽然文献报道的乳制品中的检测对象种类繁多,但均未涉及二苯胺[1]。国内乳粉中二苯胺的检测标准有GB/T 23210-2008《牛奶和奶粉中511种农药及相关化学品残留量的测定 气相色谱-质谱法》[11]和GB/T 23211-2008《牛奶和奶粉中493种农药及相关化学品残留量的测定 液相色谱-串联质谱法》[12]。受制于试验成本等因素,GB/T 23210-2008所采用的GC-MS的应用较为广泛,但是该标准存在一定局限性,比如易受基质干扰,容易出现假阳性结果等问题,故标准要求采用空白基质匹配法补偿基质效应,但通过标准方法很难得到二苯胺空白基质。鉴于此,本工作对国家标准 GB/T 23210-2008的前处理方法进行改进,以乙腈作提取溶剂,以石墨化碳黑-氨基复合固相萃取柱(Carb/NH2小柱)净化,以GC-MS检测,外标法定量。该方法操作简单、灵敏度高,避免了GB/T 23210-2008易出现的假阳性现象,能够满足乳粉中二苯胺残留量日常监控的需求。
1 试验部分
1.1 仪器与试剂
GCMS-QP2020 型气相色谱-质谱仪;GCMSTQ8040型气相色谱-三重四极杆质谱仪;DC-12型氮气吹干仪;RE-52AA 型旋转蒸发仪;R-104 型均质器;十八烷基键合硅胶固相萃取柱(C18小柱,2 000 mg/12 mL);弗罗里硅土(Florisil)固相萃取柱(Florisil小柱,1 000 mg/6 mL);Carb/NH2小柱(500 mg/6 mL)。
二苯胺标准储备溶液:100 mg·L-1,于4 ℃条件下储存。
二苯胺标准中间使用液:10.0 mg·L-1,以正己烷稀释二苯胺标准储备溶液配制而成,于4 ℃条件下储存。
二苯胺标准溶液系列:取适量二苯胺标准中间使用液,用正己烷逐级稀释,配制成0.01,0.02,0.05,0.10,0.50,1.00 mg·L-1的标准溶液系列,于4 ℃条件下储存。
乙腈、正己烷、丙酮、乙酸乙酯均为色谱纯;10种乳粉样品(包含6 种国产乳粉和4 种进口乳粉)均购自当地药店、超市。
1.2 仪器工作条件
1.2.1 色谱条件
DB-17MS 石英毛细管色谱柱(30 m ×0.25 mm,0.25μm);载气为氦气,纯度为99.999%;恒线速率模式,线速率39.8 cm·s-1;进样口温度290 ℃;不分流进样;进样量1μL。柱升温程序:初始温度55 ℃;以30 ℃·min-1升温至130 ℃;以10 ℃·min-1升温至290 ℃,保持8 min;总运行时间为26.5 min。
1.2.2 质谱条件
电子轰击离子源;电离能量70 e V;离子源温度230 ℃;接口温度280℃;溶剂延迟时间5 min;选择离子监测(SIM)模式;扫描离子质荷比(m/z)169,168,167,第一个离子为定量离子。
1.3 试验方法
将3 g(精确至0.01 g)乳粉样品置于50 mL 具塞离心管中,加入20 mL乙腈和5 g氯化钠,用均质器均质2 min,以4 200 r·min-1转速离心5 min,上清液转移至50 mL 鸡心瓶中。用20 mL 乙腈重复提取一次,合并上清液,于40℃旋蒸至1 mL。用体积比3∶1 乙腈-甲苯混合溶液5 mL 润洗Carb/NH2小柱,保持柱体湿润,将上述溶液过柱,收集流出液。用体积比3∶1乙腈-甲苯混合溶液5 mL 洗涤鸡心瓶,洗涤液过柱,再加入体积比3∶1乙腈-甲苯混合溶液20 mL洗脱柱子,收集流出液。净化过程控制流出速率为1 mL·min-1,合并流出液,于40℃水浴中旋蒸至近干,氮气吹干,用1 mL乙酸乙酯溶解后按照仪器工作条件测定。
2 结果与讨论
2.1 色谱条件
按照仪器工作条件测定二苯胺标准溶液,保留时间为10.0 min,其色谱图见图1。
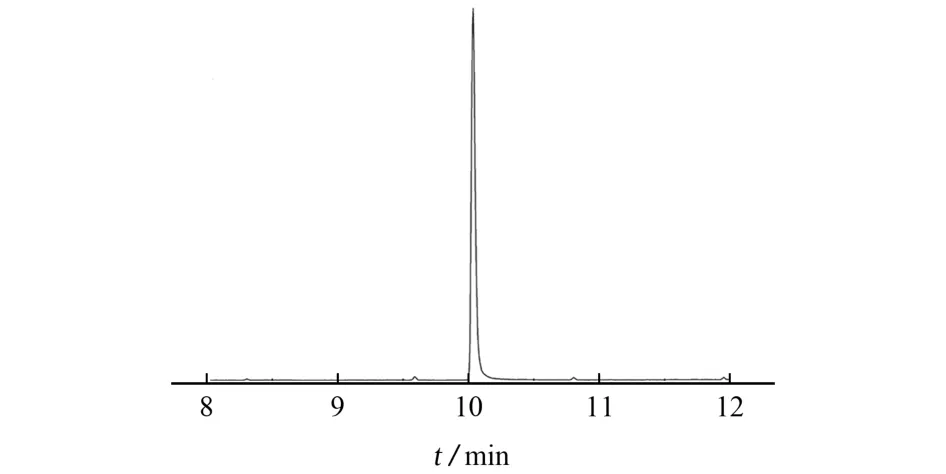
图1 二苯胺的色谱图Fig.1 Chromatogram of diphenylamine
2.2 提取条件的选择
试验比较了分别以丙酮、乙腈、体积比1∶1乙酸乙酯-正己烷混合溶液作为乳粉中二苯胺的提取溶剂时的提取效果。结果表明,除乙腈外,其他提取溶剂均会提取出大量脂肪,给后续净化带来较大负担,故试验选择以乙腈作为提取溶剂。
另外,GB/T 23210-2008 在提取时会加入一定量的无水硫酸镁用于除水,因此试验比较了加入无水硫酸镁前后加标样品中二苯胺回收率的变化。结果表明,加入无水硫酸镁前后,二苯胺的回收率无显著差异,推测与乳粉属于干性样品且二苯胺在水中溶解度极低有关。因此,试验选择在提取时不加无水硫酸镁。
2.3 净化柱的选择
参照GB/T 23210-2008,以乙腈作提取溶剂,以C18小柱作净化柱,在SIM 模式下(以m/z169作为定量离子,m/z167,168 作为定性离子)用GCMS测定10种市售乳粉中二苯胺的残留量,以基质匹配法定量。结果显示,样品中二苯胺的检出率为100%,推测可能存在假阳性现象。为验证这一推测,参照GB/T 23210-2008,用GC-MS 对二苯胺标准溶液和乳粉样品溶液分别进行质谱全扫描。结果显示,二苯胺标准溶液质谱图的基峰为m/z169,而样品溶液质谱图中丰度比较高的峰分别在m/z73,169处,其中基峰为m/z73,提示有基质干扰存在。进一步用GC-MS/MS 进行二级质谱确认,所得二苯胺的定量离子对为m/z169.1/66.0,定性离子对为m/z167.1/139.1和m/z167.1/77.0,其中二苯胺标准质谱图中3个离子对的丰度比为100∶99∶49,而样品中的丰度比为100∶21∶16,说明样品中疑似二苯胺的物质为干扰物质,即以GB/T 23210-2008检出的二苯胺结果为假阳性,可能原因为国家标准方法前处理过程净化不完全,乳粉中的干扰物质随着待测物一起流出,造成基质干扰。
Florisil小柱和Carb/NH2小柱均是农残分析常用的固相萃取净化柱,其中前者成本较低,可用于复杂基质样品的分析;后者上层是活性炭,脱色效果明显,下层为富含氨基的物质,能和糖、蛋白质、脂肪中的相关基团形成氢键,从而去除基质中大部分干扰物[13]。分别采用Florisil小柱和Carb/NH2小柱替代C18小柱净化加标样品(加标量为0.05 mg·kg-1)。其中,以Florisil小柱净化时,先分别用体积比1∶9 丙酮-正己烷混合溶液和正己烷各5 mL润洗Florisil小柱,保持柱体湿润;将提取液氮吹至干,用2 mL正己烷复溶,过Florisil小柱,收集流出液,用体积比1∶9 丙酮-正己烷混合溶液5 mL洗涤鸡心瓶,洗涤液过柱,加入体积比1∶9的丙酮-正己烷混合溶液5 mL 洗脱柱子;净化过程控制流出速率为1 mL·min-1,合并流出液,于40 ℃旋蒸至近干,氮气吹干,用1 mL 乙酸乙酯溶解,按照仪器工作条件测定。
结果显示:Florisil小柱和Carb/NH2小柱所得二苯胺的回收率分别为129%和89.6%,前者所得回收率超出GB/T 27404-2008《实验室质量控制规范 食品理化检测》[14]关于回收率范围的规定(加标量小于0.1 mg·kg-1时,回收率为60%~120%),说明采用Carb/NH2小柱所得测定值的准确度更高。
分别采用Florisil小柱和Carb/NH2小柱净化空白样品,比较了两种净化柱的杂质去除效果,结果见图2。
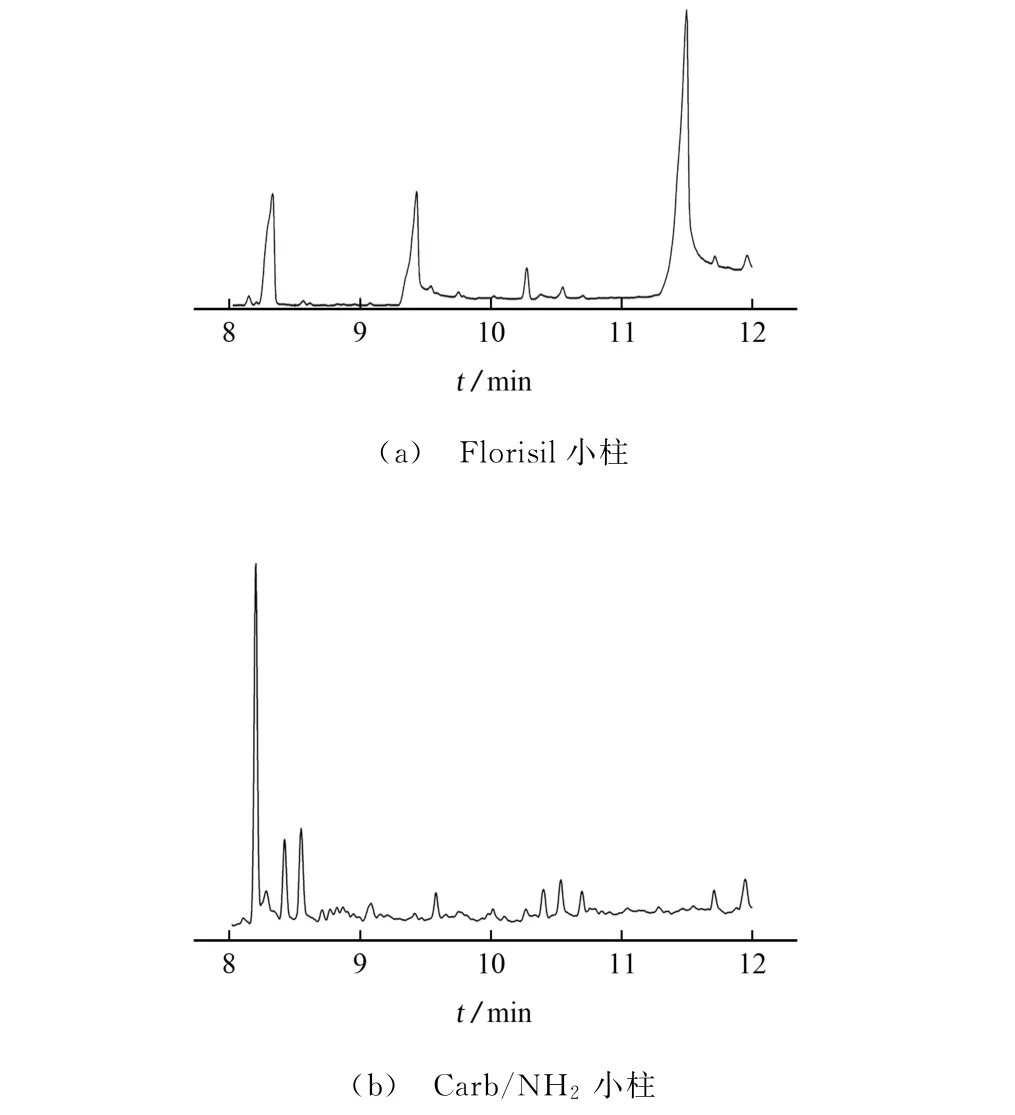
图2 Florisil小柱和Carb/NH2 小柱净化后空白样品溶液的总离子流色谱图Fig.2 Total ion chromatograms of blank sample solutions purified by Florisil cartridge and Carb/NH2 cartridge
由图2可知:经Florisil小柱净化后,空白样品溶液分别在9.4,11.5 min处出现两处峰展宽较大的杂质峰,对色谱系统有潜在污染,仪器的维护成本高;而Carb/NH2小柱的净化效果较好,并未出现峰展宽较大的杂质峰。
乳粉基质复杂,含有大量的蛋白质、脂肪和糖等[15],基质干扰较大。参考文献[16-19],进一步比较了分别采用Florisil小柱和Carb/NH2小柱净化时的基质效应。分别用空白样品溶液和正己烷配制基质匹配标准溶液系列和标准溶液系列(浓度点均为0.01,0.02,0.05,0.10,0.50,1.00 mg·L-1),按 照仪器工作条件测定并进行线性回归。以前者标准曲线和后者标准曲线斜率的差值与后者标准曲线斜率比值计算基质效应(ME)值[20]。结果表明:Florisil小柱所得ME值为53.3%,显示出强基质效应(ME值绝对值大于50%),应通过一定补偿措施来降低或消除,比如加入同位素标记的目标物、采用基质匹配法、加入目标物保护剂、增加净化步骤或进样前稀释等[15,20];Carb/NH2小柱所得ME 值为-5.3%,显示出弱基质效应(ME 值绝对值不大于20%),可直接采用正己烷配制的二苯胺标准溶液系列定量[19]。
综上,采用Carb/NH2小柱净化时,测定值准确度高、样品溶液中干扰物少且基质效应较弱,因此试验选择以Carb/NH2小柱净化样品。
2.4 标准曲线和检出限
按照仪器工作条件测定二苯胺标准溶液系列,以二苯胺质量浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线。结果显示,标准曲线的线性范围为0.01~1.00 mg·L-1,线性回归方程为y=4.855×105x+1.350×103,相关系数为0.998 8。
以不小于3倍信噪比对应的质量浓度计算检出限,所得结果为3.4μg·kg-1。
2.5 精密度和回收试验
对空白乳粉样品进行3个浓度水平的加标回收试验,加标量分别为0.01,0.05,0.20 mg·kg-1,加标后混匀并静置2 h,按照试验方法分析,每个浓度水平均分析6个平行样,计算回收率和测定值的相对标准偏差(RSD)。结果显示,3个浓度水平下二苯胺的回收率分别为84.6%,88.1%,93.1%,测定值的RSD 分别为7.5%,5.5%,4.2%,精密度和准确度均符合检测要求[14]。
2.6 样品分析
按照试验方法分析10种市售乳粉样品,若为阳性样品,则用GC-MS/MS 进行进一步确证。结果显示,10种乳粉样品中均未检出二苯胺,在一定程度上说明市售乳粉中二苯胺残留风险较低。
针对国家标准方法GB/T 23210-2008假阳性率高的现象,本工作改进了国家标准方法,以Carb/NH2小柱代替C18小柱净化样品,用GC-MS测定,以普通外标法代替基质匹配法进行定量。本方法简单、快速、精密度高、准确度好,可用于乳粉中二苯胺残留量的测定。

