FGD5-AS1和miR-223在川崎病患儿血浆中的水平及意义*
何坤, 王芳洁, 郑瑞利
郑州大学附属儿童医院心血管内科(河南郑州 450000)
川崎病(Kawasaki disease,KD)即小儿皮肤黏膜淋巴结综合征,是一种急性自限性血管炎,好发于婴幼儿,其最主要的临床症状为持续高热,且抗生素治疗无效。近年来,KD发病的婴幼儿越来越多,其发病可能与免疫、感染等多种因素相互作用有关。尽管经静脉注射免疫球蛋白后多数预后良好,但仍有部分患儿存在冠状动脉病变等后遗症,不利于心脏发育,并且可能会增加成年后心血管疾病的发生风险[1]。因此,寻找与KD发病及冠状动脉损伤发生相关的指标,对个体化治疗KD及避免或降低冠状动脉损伤具有重要的临床意义。相关研究显示[2-3],微小核糖核酸(microRNAs,miRNAs)及长链非编码核糖核酸(long noncoding RNAs,LncRNA)在心血管系统中具有强大的生物学功能,在多种心血管疾病的诊疗中发挥重要作用。微小核糖核酸-223(microRNA-223,miR-223)是作用较广泛的一种miRNAs,参与血管生成、动脉粥样硬化形成等多个过程[4]。已有研究证实[5],微小核糖核酸-223-3p是KD血管内皮损伤的重要调控因子。而FGD5-AS1作为一种LncRNA,被证实在血管内皮损伤、缺血再灌注损伤等心血管损伤中发挥保护作用[6]。但miR-223及FGD5-AS1在KD发病及患儿冠状动脉损伤发生中的作用尚不十分明确。因此,本研究连续选取75例KD患儿作为研究对象,着重探讨血浆miR-223、FGD5-AS1的表达水平及与冠状动脉损伤发生的关系,旨在为KD的防治提供新思路。
1 资料与方法
1.1 一般资料 连续选取2019年4月至2021年4月本院收治的KD患儿75例作为KD组,其中男46例,女29例;年龄1~4岁,平均(2.83±0.90)岁。纳入标准:(1)均符合KD诊断标准[7];(2)均为急性期入组;(3)临床及实验室检查资料齐全。排除标准:(1)入院前接受治疗者;(2)KD复发者;(3)合并其他感染者;(4)存在自身免疫性疾病;(5)存在先天性畸形;(6)伴随其他心血管疾病。另选取同期在本院体检的健康儿童60例作为健康对照组,及本院收治的感染发热患儿60例作为发热对照组。健康对照组男34例,女26例;年龄1~4岁,平均(3.03±0.91)岁。发热对照组男31例,女29例;年龄1~4岁,平均(2.97±0.95)岁。发热对照组患儿纳入标准:(1)肺炎或上呼吸道感染者;(2)临床及实验室检查资料齐全。排除标准:(1)合并其他感染者;(2)存在自身免疫性疾病;(3)存在先天性畸形;(4)存在心脏功能障碍;(5)入组前接受过治疗。3组间性别、年龄具有可比性。本研究经本院医学伦理委员会批准(2019000-12),且取得所有研究对象家长的知情同意。
1.2 冠状动脉损伤诊断标准[7]KD患儿均接受静脉注射免疫球蛋白和口服阿司匹林治疗,于病程的第14天行心脏超声心动图检查,并根据冠状动脉Z值将75例KD患儿分为无冠状动脉损伤组(Z值<2,n=59)和冠状动脉损伤组(Z值≥2,n=16)。
1.3 方法
1.3.1 标本收集 采集健康对照组儿童体检时,及发热对照组和KD组患儿入院当天外周静脉血,另收集治疗第14天时KD组患儿外周静脉血,每例3 mL并置于肝素抗凝管中,30 min内离心,3 000 r/min离心10 min,提取血浆并分为2份,保存于-80℃低温环境中。1份用于检测血小板计数(blood platelet,PLT)、白细胞介素-6(interleukin-6,IL-6)、血沉(erythrocyte sedimentation rate,ESR)、氨基末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)等实验室指标,另1份用于检测血浆miR-223、FGD5-AS1表达水平。
1.3.2 血浆miR-223、FGD5-AS1表达水平检测 采用实时荧光定量PCR检测研究对象血浆miR-223、FGD5-AS1表达水平。以Trizol法(试剂盒购自上海联迈生物工程有限公司)提取细胞总RNA,并按照反转录试剂盒(购自北京索莱宝科技有限公司)说明书将其反转录为cDNA,然后进行PCR反应。FGD5-AS1上游引物:5′-AACAGTGCCTATGTGGACGG-3′,下游引物:5′-CCCATCACAGAGGTCCACAC-3′;FGD5-AS1内参GAPDH上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′-GAAGATGGTGATGGATTTC-3′。miR-223上游引物:5′-CGGACGTGTATTTGACAAGC-3′,下游引物5′-CAGTGCAGGGTCCGAGGTA-3′;miR-223内参U6上游引物:5′-TTTATGCTTGAGCCTTGA-3′,下游引物5′-CTTGCCTGAAATACTTGC-3′。反应条件为:95℃、5 min,95℃、10 s,60℃、45 s,运行40个循环。利用公式2-ΔΔCt计算研究对象血浆miR-223、FGD5-AS1的相对表达量。
1.3.3 相关指标水平检测 采用血细胞分析仪(型号:迈瑞BC-5000,武汉科尔达医疗科技有限公司)检测PLT水平。采用全自动化学发光免疫分析仪(型号:罗氏Cobas-E411,上海罗氏制药有限公司)及酶联免疫吸附法试剂盒(货号:IB-E2006,江西艾博因生物科技有限公司;货号:KIT10395A,北京义翘神州科技股份有限公司)检测血浆NT-proBNP、IL-6水平。采用全自动血沉分析仪(型号:Vision-C,上海涵飞医疗器械有限公司)检测ESR水平。
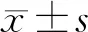
2 结果
2.1 3组研究对象血浆miR-223、FGD5-AS1表达及相关指标水平的比较 3组研究对象血浆miR-223、FGD5-AS1表达及相关指标水平相比,差异均有统计学意义(P<0.05)。KD组、发热对照组患儿PLT、ESR及血浆miR-223、IL-6、NT-proBNP表达水平均明显高于健康对照组儿童(P<0.05),FGD5-AS1表达水平明显低于健康对照组儿童(P<0.05)。KD组患儿PLT、ESR及血浆miR-223、IL-6、NT-proBNP表达水平均明显高于发热对照组患儿(P<0.05),FGD5-AS1表达水平明显低于发热对照组患儿(P<0.05)。见表1。
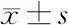
表1 3组研究对象血浆miR-223、FGD5-AS1表达及相关指标水平的比较
2.2 KD患儿治疗前后血浆miR-223、FGD5-AS1表达水平比较 治疗后KD患儿血浆miR-223表达水平明显降低,FGD5-AS1表达水平明显升高(P<0.05)。见表2。
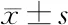
表2 KD患儿治疗前后血浆miR-223、FGD5-AS1表达水平比较
2.3 KD患儿血浆miR-223、FGD5-AS1表达与相关指标水平的相关性 KD患儿血浆miR-223
与FGD5-AS1表达水平呈负相关(r=-0.407,P=0.000),见图1。经ENCORI数据库预测,miR-223与FGD5-AS1的3′UTR存在相应的结合位点,见图2。KD患儿血浆miR-223表达水平与血浆IL-6、NT-proBNP表达水平呈正相关(r=0.565、0.622,P<0.05),与PLT、ESR无明显相关性(r=0.205、0.198,P>0.05);KD患儿血浆FGD5-AS1表达水平与血浆IL-6、NT-proBNP表达水平呈负相关(r=-0.510、-0.487,P<0.05),与PLT、ESR无明显相关性(r=-0.201、-0.175,P>0.05)。见表3。

图1 KD患儿血浆miR-223表达与FGD5-AS1表达水平相关性

图2 miR-223与FGD5-AS1靶向关系预测

表3 KD患儿血浆miR-223、FGD5-AS1表达与相关指标水平的相关性
2.4 KD患儿有无冠状动脉损伤血浆miR-223、FGD5-AS1及相关指标水平的比较 冠状动脉损伤组患儿PLT、ESR及血浆miR-223、IL-6、NT-proBNP表达水平均明显高于无冠状动脉损伤组患儿(P<0.05),FGD5-AS1表达水平明显低于无冠状动脉损伤组患儿(P<0.05)。见表4。
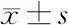
表4 KD患儿有无冠状动脉损伤血浆miR-223、FGD5-AS1及相关指标水平的比较
2.5 血浆FGD5-AS1、miR-223表达水平对KD患儿冠状动脉损伤诊断价值分析 血浆FGD5-AS1、miR-223水平联合检测(并联)诊断KD患儿冠状动脉损伤的ROC曲线下面积(AUC)为0.907(95%CI:0.845~0.969),明显高于血浆FGD5-AS1、miR-223水平单独检测曲线下面积0.819(95%CI:0.742~0.895)、0.824(95%CI:0.751~0.898)(Z/P=1.973/0.024、1.872/0.031)。见表5、图3。

表5 血浆FGD5-AS1、miR-223表达水平对KD患儿冠状动脉损伤的诊断价值

图3 血浆FGD5-AS1、miR-223对KD患儿冠状动脉损伤诊断价值的ROC曲线
3 讨论
KD的主要病理改变为全身性发生血管炎症,易累及冠状动脉,其治疗的主要原则为控制全身血管炎症及减少冠状动脉病变。研究发现免疫球蛋白的早期使用可明显降低KD患儿冠状动脉损伤的发生风险,但由于许多家长担心其安全性而未能及时输注,致使目前冠状动脉损伤的发生概率仍居高不下,严重危害患儿的远期心脏健康[8]。因此,探讨能早期评估KD患儿冠状动脉损伤发生情况的有效指标,对降低冠状动脉损伤发生率、治疗方案的制定及改善患儿远期心脏功能是非常重要的。
miRNAs是一类参与多种基因表达的单链非编码RNA,在心力衰竭、冠心病等生理和病理过程中起重要作用。miR-223属于miRNAs,定位于X染色体q12,在骨髓造血细胞、粒细胞等血液系统中广泛表达[9]。有研究报道,急性心肌梗死和慢性心力衰竭患者血清中miR-223高表达,与心肌细胞凋亡、冠状动脉病变及心脏损伤存在关联[10-11]。Wang等[5]研究中,发现KD急性期患儿血清微小核糖核酸-223-3p表达水平明显高于正常对照者。本研究通过实时荧光定量PCR检测血浆miR-223表达水平,结果发现KD患儿血浆miR-223表达水平最高,其次为发热对照组患儿,健康对照组儿童血浆miR-223表达水平最低,且治疗后KD患儿血浆miR-223表达水平明显降低,与Wang等[5]研究类似,提示血浆miR-223表达水平升高可能参与KD发病。
LncRNA是一类长链非编码RNA,在机体免疫应答、细胞生长分化等生物进程中存在调控作用参与心脑血管、肿瘤等多种疾病的发生发展。有研究报道,急性心肌梗死患者心肌细胞中LncRNA FGD5-AS1低表达,上调FGD5-AS1表达可通过调节miRNA水平提高心肌细胞活力,减少凋亡,改善心肌缺血和缺血再灌注损伤[12]。本研究结果中,KD组、发热对照组、健康对照组血浆FGD5-AS1表达水平依次显著降低(P<0.05),且治疗后KD患儿血浆FGD5-AS1表达水平明显升高,与既往研究[6,13]在心肌损伤、脓毒症发生中研究结果相似,提示血浆FGD5-AS1低表达可能与KD的发生有关。FGD5-AS1低表达可能促进炎症反应增加、血管内皮细胞异常改变等促使心肌细胞损伤,进而诱导KD的发生[14]。有研究发现,FGD5-AS1与miR-233间存在靶向调控作用,与神经细胞增殖和神经元损伤有关[15]。而本研究结果显示,KD患儿血浆miR-223与FGD5-AS1表达水平呈负相关,且经ENCORI数据库预测,miR-223与FGD5-AS1的3′UTR存在相应的结合位点,表明KD发生发展中FGD5-AS1与miR-233间也存在相互调控作用。陈翠翠等[16]发现通过外源miR-223抑制物干预,有利于减轻KD冠状动脉内皮细胞损伤。本研究中,冠状动脉损伤组患儿血浆miR-223表达水平较无冠状动脉损伤组患儿高,FGD5-AS1表达水平明显低于无冠状动脉损伤组患儿,提示FGD5-AS1、miR-223可能参与冠状动脉损伤发生,临床通过检测血浆FGD5-AS1、miR-223表达水平对评估KD患儿冠状动脉损伤情况有所帮助。
IL-6是由成纤维细胞、单核巨噬细胞等合成并分泌的多功能细胞因子,可通过识别靶细胞表面的人IL-6受体参与多种疾病进展[17]。研究发现KD发病后机体可产生大量的IL-6,引起炎症反应,从而导致冠状动脉损伤[18]。NT-proBNP是一种由心肌细胞合成并分泌的多肽,其水平异常升高可作为判断心肌损伤的依据[19]。江雅静等[20]研究报道,血清NT-proBNP水平升高与KD患儿冠状动脉损伤有关。本研究也得出相似的结果,血浆IL-6、NT-proBNP表达水平及从高至低依次为KD组患儿、发热对照组患儿、健康对照组儿童,冠状动脉损伤组患儿血浆IL-6、NT-proBNP表达水平均较无冠状动脉损伤组高,提示血浆IL-6、NT-proBNP表达水平参与KD发生、发展。此外,Pearson检验分析发现,KD患儿血浆miR-223表达水平与血浆IL-6、NT-proBNP表达水平均呈正相关,FGD5-AS1表达水平与血浆IL-6、NT-proBNP表达水平均呈负相关,进一步提示FGD5-AS1、miR-223与IL-6、NT-proBNP一样,可能作为评估KD患儿冠状动脉损伤发生的有效指标。而PLT、NT-proBNP在发热组患儿血浆中升高,可能原因为发热不仅引发肺炎、上呼吸道感染,还会导致其他脏器受累,影响心脏功能以及炎症反应增加。本研究还通过ROC曲线分析发现,血浆FGD5-AS1、miR-223水平联合检测诊断KD患儿冠状动脉损伤的曲线下面积为0.907,明显高于血浆FGD5-AS1、miR-223水平单独检测曲线下面积,且敏感度较高,提示二者联合检测对KD患儿冠状动脉损伤的诊断价值较高。
综上所述,miR-223在KD患儿血浆中明显升高,参与冠状动脉损伤发生,且与IL-6、NT-proBNP呈正相关,可能为KD的防治及减少冠状动脉损伤提供帮助。但本研究有一定局限性,样本量少且未进行远期随访,miR-223在KD发病机制中的具体作用,需增加样本并延长随访进一步探讨。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:何坤提出研究思路、设计研究方案、实施研究过程、论文撰写;郑瑞利资料收集整理,进行统计学分析,王芳洁指导论文修改。

