高频超声引导下应用真空辅助活检系统对乳腺钙化灶行旋切活检的临床研究
张雅男 董凌云 姚云燕
乳腺钙化灶是指多种因素导致组织坏死、乳腺钙盐沉积,多见于乳腺发育异常、乳腺良性疾病、乳腺癌等[1]。全球每年乳腺癌发生率位居女性癌症第一位,占女性新发癌症病例24%左右[2]。乳腺病变是女性常见多发病,其致病因素复杂,诊治不及时易发生癌性病变,严重威胁妇女生命健康[3]。分析乳腺钙化灶部位、数目、与周围结构的关系及病理学诊断是鉴别乳腺疾病性质的敏感指标。乳腺超声检查可显示部分钙化灶但敏感性较低,因此临床上首选钼靶X线观察乳腺钙化灶,但其含有低剂量辐射。随着超声技术的进步及高频探头的应用,高频超声技术还可观察乳腺微小钙化灶,应用于活检手术中[4]。临床上乳腺钙化灶活检方式主要有开放切除和穿刺两种方式,开放切除创伤大,因此目前临床上常采用穿刺活检。本研究主要探讨高频超声引导下应用真空辅助活检系统对乳腺钙化灶行旋切活检的临床研究。
1 资料与方法
1.1 研究对象
回顾性分析我院2017年7月至2020年8月行乳腺活检的乳腺钙化灶患者62例107个病灶,年龄23~57岁,平均(34.59±4.16)岁,病灶直径0.9~32.1(16.71±5.24)mm。纳入标准:①女性患者;②高频超声可视乳腺钙化灶,符合《乳腺超声检查和诊断共识》[5]中相关诊断标准;③未伴有心脑血管严重疾病;④无凝血功能障碍;⑤超声影响检查为美国放射学会的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分级[6]Ⅱ~Ⅳ级:Ⅱ级为良性病变,基本排除恶性可能,Ⅲ级可能为良性病灶,恶性病变率<2%,Ⅳ级疑似恶性病变。排除标准:①有出血倾向者;②合并严重肝肾等器官障碍者;③乳腺假体植入者;④处于妊娠及哺乳期患者;⑤手术禁忌症者。患者一般资料见表1。

表1 患者一般资料
1.2 方法
仪器设备:超声仪采用SonoSite(索诺声)彩色超声诊断系统S-Nerve型,购于富士胶片索诺声(中国)股份有限公司;真空旋切仪采用Mammotome revolve麦默通锐旋双向真空辅助乳房活检与旋切系统,购于泰维康医疗器械(上海)有效公司。
手术方法:患者取仰卧位肩背垫高,手臂举抱过头充分暴露乳房,采用无菌超声探头进行体表探测病灶,根据钙化灶分布部位、大小,标记探针进针方向。皮肤常规碘伏消毒后采用1%利多卡因(中国大冢制药有限公司,10 ml∶0.2 g,国药准字H20065388)10~20 ml联合少量肾上腺素(北京双鹤药业股份有限公司,1 ml∶1 mg,国药准字H11021685)对病灶基底、乳房后隙等多点进行局部浸润麻醉。麻醉起效后,在进针处用手术尖刀做3 mm左右切口,选择合适角度在超声引导下将Matmmotome旋切刀(HH8BRX型)沿乳房后间隙刺入,避开重要血管。到达目标乳腺病灶基底部或侧方,调整刀头凹槽方向使其头端凹槽完全对准病灶打开旋切窗,将病灶组织吸入旋切刀收集槽中进行旋切,在高频超声引导下利用真空负压吸引装置将病灶吸入凹槽中,做多次、多方位扇形旋切。直至将病灶完全切除,高频超声探测影像切面显示病灶无残留终止旋切,搜集切除乳腺钙化灶标本。旋切过程中和拔出旋切刀前可用真空抽吸清除局部积血,多病灶患者继续切除。所有切除标本固定后送病理检查。穿刺点皮肤小切口采用止血贴粘合。术后局部压迫术区10 min,绷带加压包扎。
1.3 统计学分析

2 结果
2.1 病灶病理结果
良性病灶96例(89.7%),高危病灶7例(6.5%),恶性病灶4例(3.7%),见表2。乳腺超声BI-RADS分级Ⅱ级~ⅣC级良性病灶结果差异具有统计学意义(P<0.05);乳腺超声BI-RADS分级Ⅱ级~ⅣC级高危病灶结果差异具有统计学意义(P<0.05);乳腺超声BI-RADS分级Ⅱ级~ⅣC级恶性病灶结果差异具有统计学意义(P<0.05),见表3。
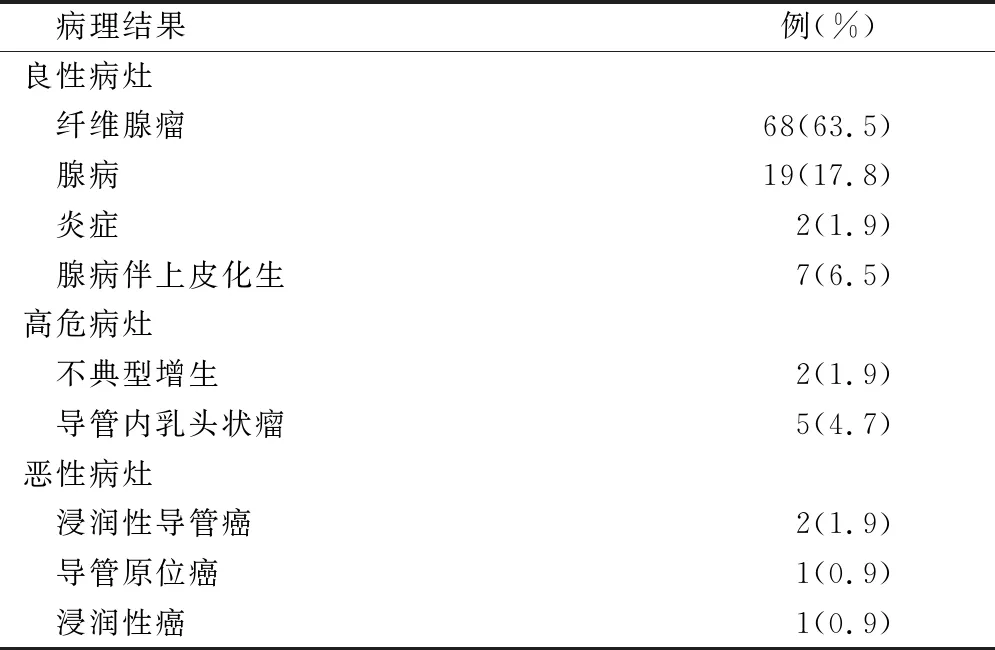
表2 107个病灶病理结果
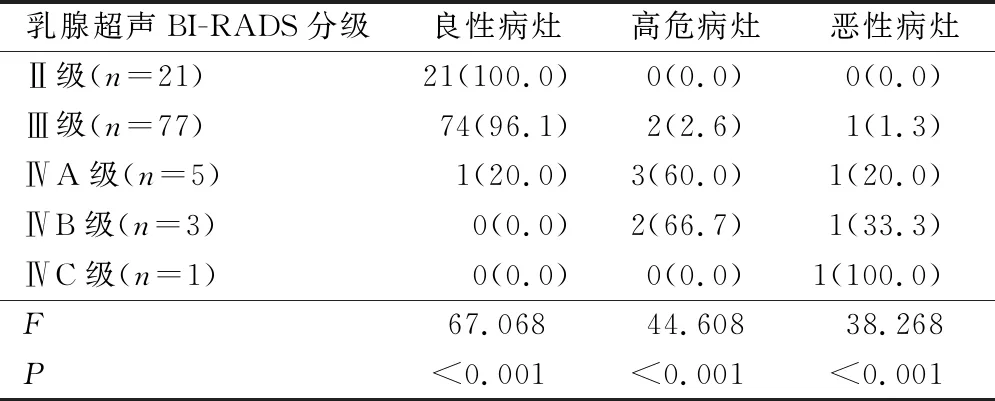
表3 乳腺超声BI-RADS分级与病理结果的关系(例,%)
2.2 术后并发症
62例患者术后出现局部血肿4例,未进行特殊处理1个月后血肿消失。乳头溢血2例,7 d后自行停止。于术后7 d复查时采用高频彩超发现肿瘤残留2例,总并发症发生率为12.9%,见表4。
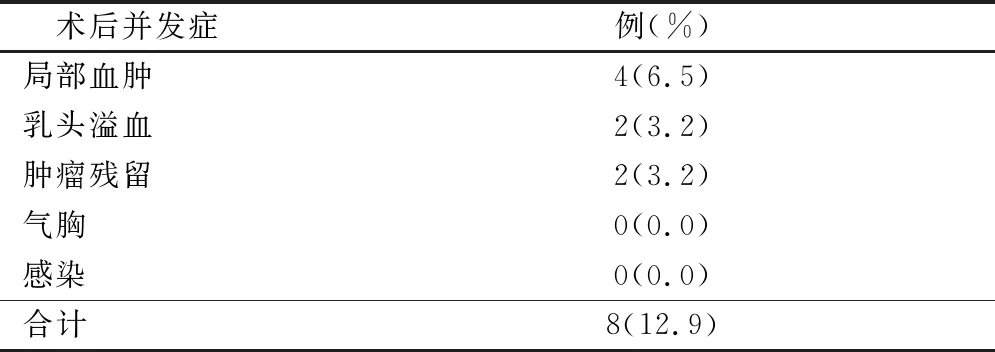
表4 术后并发症
2.3 随访
62例患者(107个病灶)于术后6个月复查,患者创面愈合良好,无明显瘢痕。
3 讨论
女性乳腺相关疾病患病率逐年上升,而乳腺癌患病率已成为我国女性恶性肿瘤首位[7]。钙化是乳腺癌常见的影像学表现之一,乳腺钙化女性乳腺癌患病几率是无乳腺钙化女性2倍左右,乳腺癌患者的乳腺钙化发生率约为40%[8-9]。临床多采用钼靶X线观察乳腺钙化灶,或在其引导下进行钙化点切除,但在金属定位线的引导下切除钙化灶存在较大损伤及误切风险[10]。但随着超声仪器的提高和高频超声技术的不断发展,超声检查也能够清晰显示乳腺钙化灶,以往难以观察的细微钙化灶也能清晰显示。高频超声影像中提示的钙化灶,在无手术禁忌症的情况下均可采用真空辅助旋切活检系统对其进行切除及活检[11]。由真空辅助旋切活检取出标符合病理学检查所需组织长度和宽度,可保证诊断的可靠性,降低假阴性率,为早期诊断乳腺疾病提供依据,提高乳腺疾病的早期诊断率[12]。有研究显示,真空辅助旋切系统切除乳房可疑病灶的准确率为97%,敏感性为94%,特异性为100%,阴性预测值为94%,阳性预测值100%[13-14]。与以往活检手术相比,高频超声引导下真空辅助旋切系统对乳腺钙化灶及异常阴影活检更简便,无辐射损害,准确性更高。
本研究结果中,107例病灶良性病灶96例占(89.7%),其中纤维腺瘤68例占所有病例的63.5%,腺病19例占比 17.8%。纤维腺瘤是最常见的乳腺良性病变,多发18~25岁女性,乳腺腺病常见25~45岁的女性,多伴有纤维腺瘤或瘤样增生[15]。进行手术切除后多可治愈,但少数患者术后出现复发,一旦出现多次复发临床应提高警惕、早期防治,防止发展为恶性病变。结果显示高危病灶7例占6.5%,恶性病灶4例占比3.7%。乳腺钙化灶发病多与患者内分泌机制失调相关,有研究显示雌激素过量分泌对乳腺疾病的发展及发生起一定的作用,但发病机制尚未明确,而对高危病灶应进行二次开放手术明确诊断,避免延误治疗[16-17]。本研究结果显示乳腺超声BI-RADS分级Ⅱ级~ⅣC级良性病灶、高危病灶、恶性病灶结果均具有统计学差异。其中Ⅱ、Ⅲ级多为良性病变,占比分别为100%、96.1%,BI-RADSⅢ级恶性病变1例占比1.3%,符合BI-RADS恶性病变符合率。ⅣA、ⅣB、ⅣC级恶性病变均为1例,占比分贝为20%、33.3%、100%,BI-RADS中ⅣA恶性符合率为2%~10%,ⅣB为10%~50%,ⅣC为50%~94%,仅ⅣB恶性符合率与本研究结果相符,这可能是因为本研究样本病例较少[18]。本研究结果中62例患者术后出现局部血肿4例、乳头溢血2例、肿瘤残留2例,总并发症发生率为12.9%,未出现气胸、感染等并发症,这可能与局部浸润麻醉、高频超声引导等相关。麻醉是保障旋切手术顺利进行的关键,本研究麻醉药物浸润乳房后隙,钙化灶上浮易于分辨,有利于旋切技术的进行,浸润钙化灶基底使其与皮肤分离,可减少真空辅助中负压使正常皮肤组织进入凹槽。局部麻醉药物中加入少量肾上腺素在手术局部血管,减少出血的同时对心率、血压明显影响。高频超声在真空辅助旋切活检中的应用,可在术前对乳腺钙化灶定位,根据钙化灶性质、数量、分布选择最佳穿刺点减少穿刺点数目,降低多余创伤减少感染及气胸的发生,若钙化灶不处于同一象限应再选穿刺点进行旋切活检[19-20]。本研究在高频超声引导下真空辅助旋切活检均一次成功,在完成钙化灶活检取样的同时可切除完整可疑病灶,避免二次手术,操作过程在高频超声图像下可视进行,定位准确、病灶切除完全。而且真空辅助活检系统可在治疗中吸取术区的出血,降低术中出血过多导致超声影像对残留肿物识别不清,导致病灶残留。术后6月复查复查随访62例患者(107例病灶),创面小愈合良好无明显瘢痕,提示应用高频超声真空辅助旋切系统可准确切除乳腺肿物,具有较好的微创性、舒适性及美容性。
综上所述,高频超声引导下应用真空辅助活检系统对乳腺钙化灶行旋切活检具有较好的临床效果,术后创伤小、并发症发生率低。因此瘢痕体质或对美容要求较高的患者。高频超声引导下应用真空辅助旋切活检或可作为治疗乳腺疾病的重要方式,待后续进行更进一步的临床研究。

