Bcl-6对滤泡辅助性T细胞的调控作用及机制进展
何 岚, 王 猛, 姜 浩
(1.湖南大学生命医学交叉研究院, 医学病毒学湖南省重点实验室, 长沙 410012;2.中国科学院上海巴斯德研究所, 上海 200031; 3.中南大学生命科学学院, 长沙 410006)
Bcl-6属于Bcl(B cell lymphoma, B细胞淋巴瘤)家族蛋白,作为人类非霍奇金淋巴瘤中染色体易位最频繁基因之一首次被克隆,对细胞活化、分化、细胞周期调控和DNA损伤修复等多个生命过程起调控作用.近年来的研究发现Bcl-6是Tfh细胞(follicular helper T cell, 滤泡辅助性T细胞)的亚群决定因子,对Tfh细胞分化和功能调节起关键作用[1].
1 Bcl-6概述
Bcl-6蛋白由706个氨基酸组成,属于BTB-POZ(bric-a-brac, tramtrack, broad complex/poxvirus zinc finger)转录因子家族,是一种含锌指结构的序列特异性转录共抑制因子.Bcl-6 N端为BTB/POZ结构域,可进行蛋白质—蛋白质相互作用;中间区域含3个PEST结构域,参与蛋白的稳定性和活性调节;C端含6个C2H2锌指结构,是特异性DNA结合位点.Bcl-6可通过BTB/POZ结构域招募其他转录共抑制因子,或与其他锌指结构蛋白相互作用,然后结合特异性DNA序列,发挥转录抑制作用.Bcl-6在生发中心B细胞分化和发育过程中十分重要,是生发中心B细胞的亚群决定因子,近年来的研究发现其对Tfh细胞的分化中也起核心作用,是Tfh细胞的亚群决定因子[2].
2 Bcl-6在Tfh细胞分化过程中发挥核心作用
CD4+T细胞,又称Th细胞(T helper cell, 辅助性T细胞),是一类在体内发挥辅助性功能的T细胞,在机体适应性免疫反应中占据中心位置.幼稚型CD4+T细胞可以分化为多种亚群,包括Th1,Th2,iTreg(induced regulatory T cells, 诱导性调节性T细胞),Th17和Tfh等,这些亚群分别调控了不同的免疫反应.Tfh细胞是一类以辅助B细胞作为专职功能的CD4+T细胞亚群,其定位在B细胞滤泡中,参与B细胞亲和力成熟、抗体同型转换、浆细胞分化、记忆B细胞产生和生发中心形成等一系列重要生物过程的调控,对于由抗体介导的体液免疫十分重要[1].自2009年发现Bcl6是Tfh细胞亚群决定因子后,Tfh细胞被鉴定为除Th1、Th2、Th17和iTreg以外的一类独立的CD4+T细胞亚群,成为较为公认的第五类独立CD4+T细胞亚群.
Tfh细胞分化受到精细调控,多种转录因子通过正向调节或负向调节的方式参与这一过程,如Bcl-6,Blimp1,c-MAF, BATF, IRF4, STAT家族蛋白,ASCL2,Klf2等.Bcl-6与Blimp1是一对相互拮抗的转录因子,Bcl-6驱动Tfh细胞分化程序,Blimp1抑制Tfh细胞分化,促进其它CD4+T细胞亚群的分化.c-MAF受ICOS(inducible T cell costimulator,诱导共刺激因子)信号诱导表达并促进IL-21的产生.BATF在Th17和Tfh细胞的分化过程中重要,在Tfh细胞中能够诱导Bcl-6和c-MAF的表达.STAT3,STAT1,STAT4可接收细胞因子信号,在Tfh细胞分化过程中发挥重要作用.ASCL2通过调控CXCR5的上调、PSGL1和CCR7的下调调节Tfh细胞的早期分化.Klf2是一个对Tfh细胞其负向调节作用的转录因子,其促进T细胞向T细胞区而非B细胞滤泡区迁移.Klf2还可通过上调Blimp1、T-bet和Gata3等转录因子的表达抑制Tfh细胞分化[1].
2.1 Bcl-6发现与Tfh细胞分化调控
Tfh细胞的命名在2000年被首次提出,用来描述表达CXCR5的CD4+T细胞群,使它们能够迁移到富含CXCR5的配体CXCL13的生发中心[3-4].通过对Th1、Th2和Tfh亚群的整体基因表达分析,初步认为Tfh可能代表一个独特的效应细胞谱系.接着,IL-21在Tfh中的重要性被发现,使用IL-21或IL-21R缺陷小鼠进行的实验均证实IL-21在Tfh发育和生发中心形成中的关键作用[5-6].根据CD4+T细胞独立亚群鉴定的研究范式,接下来的问题是确定驱动Tfh细胞命运的专一性转录因子.2009年,董晨课题组、Carola Vinuesa课题组和Shane Crotty课题组的三个独立研究均鉴定出Bcl-6为Tfh细胞的亚群决定因子,通过功能获得和功能缺失方法,这些研究人员得出了相同的结论,即Bcl-6是驱动Tfh细胞分化所必需和充分的[7-9].在Bcl-6缺陷的情况下,Tfh分化几乎被完全抑制,而其它的CD4+T细胞亚群的分化基本不受影响;在小鼠体内实验中过表达Bcl-6能够驱动Tfh分化.自此,Tfh细胞作为一类独立的CD4+T细胞亚群的地位得到确立[10].
2.2 Tfh细胞中Bcl-6的功能
Bcl-6参与Tfh分化的多个过程,起到调控整个分化程序的作用.Bcl-6对有利于向Th1、Th2、Th17方向分化的基因具有抑制作用,驱动幼稚型CD4+T细胞往Tfh细胞方向分化[11].例如,Bcl-6和Blimp1在B细胞和CD8+、CD4+T细胞分化过程中互相抑制,进而影响细胞分化.Blimp1可以有效抑制Tfh分化,且其在Tfh细胞之外的其它亚群均表达较强,这暗示在Tfh分化过程中Bcl-6通过抑制Blimp1的表达发挥调控功能.Bcl-6还可以通过抑制T-bet和RORγt的表达,负向调控Τh1和Τh17的分化[1].TCR下游分子AP1通过调控免疫反应初期T细胞的信号传导,促进Th1、Th2和Th17细胞分化,但研究显示Bcl6可以被AP1招募,抑制AP1信号,进而抑制上述细胞分化[12].同时,在各亚群分化相关基因的调节区域均存在Bcl-6结合序列,这提示Bcl-6对其它亚群的分化具有抑制作用.IL-6和IL-21受体的表达可以被Bcl-6调控,暗示了在免疫反应早期Bcl-6可以通过提升Tfh细胞分化信号的响应性起始分化.有研究发现Bcl-6-Tfh细胞存在于生发中心内,其CCR7、KLF2、S1P1等迁移相关蛋白显著高于Bcl-6+的Tfh细胞,这提示Bcl-6+Tfh细胞可能离开生发中心.另外,Bcl-6还可能参与记忆Tfh细胞的形成[10].
虽然Bcl-6对于Tfh细胞的分化、发育及功能至关重要且受到广泛研究,但对于其具体的作用机制仍有很多不清楚的地方.其中一个问题是Bcl-6作为功能抑制性的转录因子是如何促进Tfh细胞中基因上调.为了解释这一问题,Shane Crotty课题组进行了一系列的实验,发现Bcl-6通过“双重抑制回路”来调控Tfh细胞,即Bcl-6通过双重抑制的作用模式对Tfh细胞转录谱进行调节,它关闭了Tfh细胞中发挥抑制作用的重要基因的表达,最终实现Tfh细胞分化和维持过程中关键基因的上调[13].此外,清华大学祁海课题组对Bcl-6对Tfh细胞和生发中心的调控机制方面提供了新的见解,其最新研究发现Bcl-6可通过调控Tfh细胞中的钙信号传递,调节Tfh与B细胞之间的突触黏附相互作用,并可通过非T细胞自主的方式维持Tfh细胞特征[14].
3 Tfh细胞中调控Bcl-6表达的分子机制
由于Bcl-6在Tfh分化和功能过程中的核心作用,其表达受到精密的调控.在Tfh细胞中,多种因子参与Bcl-6的表达调控,包括细胞因子、共刺激分子、转录因子等(图1).
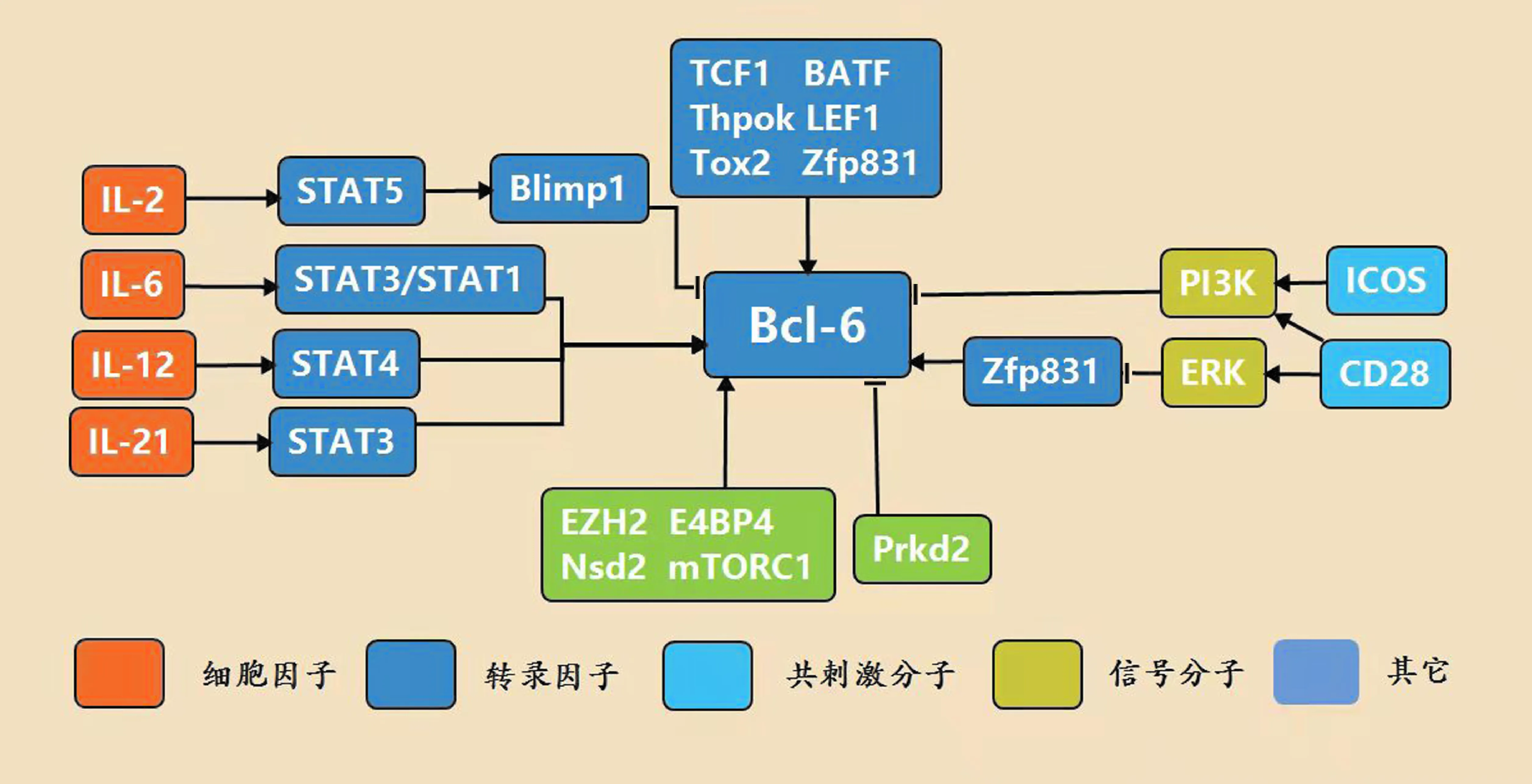
图1 Bcl-6在Tfh细胞中的分子调控网络
3.1 细胞因子
参与调节Bcl-6的细胞因子主要包括IL-6,IL-21,IL-12,IL-2,分别通过IL-6-STAT3/STAT1信号通路,IL-21-STAT3信号通路,IL-12-STAT4信号通路,IL-2-STAT5-Blimp1信号通路介导.IL-6和IL-21是刺激Tfh分化的关键细胞因子,IL-6在体外分化的条件下诱导Tfh的标志基因,在体内实验条件下也能促进Tfh分化[15].在Tfh分化早期如果缺乏IL-6信号刺激,Tfh分化会发生缺陷.STAT3是经典的IL-6下游STAT家族分子,在Tfh中STAT1能与STAT3共同调节Bcl-6.IL-21同样能促进Tfh.关于IL-21在Tfh中的作用目前仍存在争议,有的研究发现IL-21对于Tfh的作用是T细胞内在性的,而另一些研究证明IL-21对于Tfh的影响是依赖B细胞的.最近的研究发现,IL-21能够抑制Tfr (follicular regulatory T cells, 滤泡调节性细胞),使GC中Tfh对Tfr的比例增高.由于在之前的研究中研究者们并未区分Tfh和Tfr,因此这一研究的发现可能对IL-21在Tfh中作用机制的进一步研究提供了新的方向[16].
IL-12也能促进Bcl-6的表达.研究表明,IL-12能够依赖STAT4诱导Bcl-6的表达,增强小鼠体内PD-1highCXCR5+Tfh细胞的分化.然而小鼠中STAT4的缺陷不会引起Tfh的缺陷,暗示着STAT4信号通路的缺陷可以被其它信号通路补偿.IL-12介导的STAT3激活可能补偿STAT4的缺陷,或者IL-6介导的STAT1和STAT3提供了STAT4缺陷后的所需的Tfh分化信号[17].与小鼠Tfh分化中IL-12所起的相对较弱的作用不同,人类Tfh细胞的分化主要由IL-12-STAT4信号通路调控.
IL-2在T细胞增殖、存活、分化和凋亡等过程中都起着重要作用,研究发现在Tfh细胞中IL-2抑制Bcl-6表达.早期的研究认为IL-2是免疫系统中重要的保护性细胞因子,然而随着IL-2在Treg中功能的发现,越来越多的研究认为IL-2作为机体免疫稳态的维持者发挥作用.在Tfh中,IL-2Rα的缺失或减少导致T细胞内在性的Tfh增多,而过量IL-2能够抑制Tfh的分化.与Tfh高量表达Bcl-6类比,非Tfh细胞表达高量的Blimp1,Bcl-6和Blimp1能够相互拮抗,导致CD4+T细胞向Tfh或非Tfh方向分化.过量的IL-2信号通路能够通过激活STAT5增强Blimp1的表达,同时抑制Bcl-6的表达.此外,激活的STAT5可通过替代STAT3在Bcl-6基因位点上的结合抑制Tfh细胞的分化.最近的研究发现,IL-6/IL-21-STAT3信号通路可诱导ECM1(extracellular matrix protein 1, 细胞外基质蛋白1)在Tfh细胞中的高量表达,再通过ECM1对IL-2-STAT5信号通路的抑制作用最终促进Bcl-6的表达[18].
3.2 转录因子
与Tfh分化相关的其他转录因子也参与Bcl-6的调控,如TCF1、BATF、Thpok和LEF1等.研究发现,BATF直接与Bcl-6的启动子结合[19].LEF1和TCF1不仅能直接与Blimp1和Bcl-6的启动子结合,调控Tfh发育,而且能提升ICOS和IL-6的表达,通过放大其在免疫反应早期介导的Tfh发育信号以进一步诱导Bcl-6表达.此外,TCF1的亚基P33可以与Bcl-6互作来解除Bcl-6对其自身的抑制[9, 20-21].Thpok是最近发现的调控Bcl-6的转录因子,其与Bcl-6第一个内含子结合,促进Bcl-6转录,进而调节Tfh分化[22].
3.3 共刺激信号
Tfh分化是一个多步骤、多种细胞参与的复杂过程,需要不同的共刺激信号参与,其中CD28和ICOS尤为重要.CD28在Tfh 的早期发育和后期的维持中均起重要作用[23].而另一项在器官移植中的研究发现,中止CD28信号可以有效的抑制移植受体针对供体器官产生Tfh细胞和抗体,说明CD28在Tfh分化中的重要作用[24].ICOS和CD28均可以刺激PI3K通路,而PI3K信号通路介导了ICOS信号通路对于Bcl-6的诱导.因此,CD28可能是Tfh发育中Bcl-6的诱导信号.在OVA蛋白介导OT-II细胞免疫反应的初期,CD28或ICOS信号的缺失会影响早期Tfh的发育,但可能只有CD28会影响Bcl-6的诱导表达,而ICOS只是略微影响了CXCR5的水平,但对于Tfh的维持重要[25].然而,另一项利用LCMV急性病毒感染模型的研究却发现早期Bcl-6的诱导严重依赖ICOS信号[26].这种矛盾可能是由于不同免疫模型中对于“发育早期”的具体时间定义不一致导致的.另外一项研究发现,ICOS不仅参与Bcl-6的诱导,还可以通过其下游蛋白影响Bcl-6的翻译后修饰.研究者们发现由ICOS信号诱导的骨桥蛋白通过与Bcl-6相互结合抑制Bcl-6的降解[27].另外,董晨课题组的最新研究发现共刺激分子可通过差异性地调节ERK-Zfp831轴来塑造T滤泡辅助细胞的分化.与CD28相比,ICOS缺乏激活ERK的能力,而Zfp831是一个受ERK通路抑制表达的转录因子,通过直接上调Bcl-6和TCF7的表达来促进Tfh细胞分化[28].
4 Bcl-6的其它分子调控机制
4.1 表观遗传学调控
近年来的研究发现,组蛋白甲基转移酶EZH2可受到转录因子TCF1的招募,降低包括Bcl-6在内的与Tfh发育相关的多个基因的甲基化水平,进而提高它们的转录活性[29].在另一项研究中,陆军军医大学叶丽林课题组同样发现了EZH2通过促进Tfh细胞维持其亚群特异性的染色质模式,在Tfh细胞早期命运决定中发挥关键作用[30].董晨课题组发现转录因子Tox2通过调节染色质可及性驱动Tfh发育[31].另外,H3K36me2甲基转移酶Nsd2被发现是Tfh分化的关键表观遗传调节剂.Nsd2的表达在早期被CD28信号迅速诱导,并在后期受到ICOS信号调节,以维持其持续表达并对Tfh细胞进行调控[32].中南大学湘雅二医院陆前进课题组发现E4BP4通过招募抑制性表观遗传修饰因子组蛋白去乙酰化酶HDAC1和组蛋白甲基转移酶EZH2来调控Bcl-6的转录.在系统性红斑狼疮的病人中E4BP4磷酸化受损,且这种受损的转录因子引起的Tfh细胞功能受损与系统性红斑狼疮中不受控的自身免疫反应正相关[33].
4.2 代谢调控
最近的研究发现在Tfh细胞中mTORC1通过mTORC1-4E-BP-eIF4E信号通路参与Bcl-6的表达调控[34].另外值得注意的是,在Tfr细胞(follicular regulatory T cell,滤泡调节性T细胞)中mTORC1-STAT3-TCF1信号通路调控了Bcl-6表达[35].
4.3 激酶分子
最近的研究发现,Prkd2(serine/threonine-protein kinase D2,丝氨酸/苏氨酸激酶蛋白激酶D2)可直接与Bcl-6结合,Prkd2使Bcl-6磷酸化并抑制Bcl-6进入细胞质,进而抑制Tfh细胞分化.然而Bcl-6也可抑制Prkd2的表达,因此Prkd2和Bcl-6形成一个相互抑制的正反馈回路,调控Tfh分化[36].
5 总结与展望
Tfh细胞作为一群最新鉴定的独立CD4+T细胞亚群,参与多种疾病的发病过程,如自身免疫性疾病、感染性疾病、过敏、动脉粥样硬化、器官移植和癌症等,并与疫苗的有效性密切相关[37-38].在最近发生的新型冠状病毒肺炎中,也发现病人脾脏和淋巴结中表达Bcl-6的Tfh细胞和生发中心的明显缺失,为冠状病毒感染后产生的有限中和抗体反应提供了一种机制解释[39].Bcl-6是Tfh细胞的亚群决定因子,在Tfh细胞分化、发育和发挥功能的各方各面都起到关键性的调控作用.因此,Tfh细胞中存在多种因子参与Bcl-6的分子调控,包括细胞因子、共刺激分子、转录因子和表观遗传修饰酶等,而这些分子通过影响Bcl-6进一步调节了Tfh细胞.通过Bcl-6调节Tfh相关的免疫反应已在小鼠模型中被证明能够控制流感引起的疾病反应[18],针对Bcl-6分子调控更深入的理解将帮助更好地通过开启或关闭Bcl-6控制免疫反应,进而应用于疾病预防和治疗.
除了在Tfh细胞和生发中心B细胞中作为亚群决定因子发挥重要作用外,Bcl-6在适应性免疫系统还扮演多个角色.例如,Bcl-6可促进CD4+记忆T细胞和中央记忆CD8+T细胞产生[2].另外,Bcl-6在其它CD4+T细胞亚群中也可发挥独特功能.在Th1细胞中,Bcl-6与Th1细胞亚群决定因子T-bet协作,共同调控Th1细胞中多种基因的表达[40].
长期以来,Bcl-6作为抑制性转录分子如何控制Tfh细胞中基因谱表达一直是个谜题,最近这一问题已经基本得到解决,即Bcl-6通过“双重抑制回路”调控Tfh细胞[13].除本文中主要阐述的Bcl-6的转录调控外,翻译后修饰对于Bcl-6的表达调控也起重要作用.例如,研究表明广谱去泛素化酶抑制剂处理可引起CD4+T细胞中Bcl-6蛋白量升高[27],暗示泛素化修饰在Bcl-6调控过程中发挥作用.针对Bcl-6的转录后和翻译后水平调控的研究目前还比较缺乏,是一个未来值得探讨的方向.

