乙型肝炎肝硬化患者外周血IL⁃6 水平与肝功能、HBV⁃DNA 载量及感染幽门螺杆菌的相关性研究
白瑞,鲍中英,王硕,姜敏,郭杨志
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是肝脏疾病一大重要因素,可导致慢性肝病、肝硬化、肝细胞癌和与肝脏相关的死亡等,已成为重大的全球公共卫生问题。尽管HBV 疫苗已广泛接种,但其感染率仍然较高[1]。乙型肝炎病毒的脱氧核糖核酸(HBV⁃DNA)载量是反映HBV 活跃程度的指标,可作为HBV 感染的临床诊断依据及反映疗效程度。HBV⁃DNA 水平升高是慢性乙型肝炎患者发展为肝硬化的危险因素[2]。乙型肝炎被认为肝细胞存在炎症,而作为参与炎症反应的关键因子,白细胞介素⁃6(interleukin 6,IL⁃6)在乙型肝炎的发生发展中起着重要作用。HBV 感染患者机体内的T细胞亚群失衡产生并释放促炎细胞因子,诱导IL⁃6激活炎症信号通路,引起肝细胞损伤,促进慢性乙型肝炎进展,产生肝慢性纤维化,进而发展为肝硬化。国内外研究显示,IL⁃6 在不同肝脏疾病中的水平具有差异,在HBV 感染过程中扮演着重要作用,然而其感染机制尚不清楚[3-4]。幽门螺杆菌(Helico⁃bacter pylori,HP)常见于胃黏膜上皮细胞,是导致胃炎、胃溃疡、胃癌的主要原因之一。然而近些年研究报道称,HP 感染可能与肝脏疾病有关,与HBV共同促进乙型肝炎患者肝炎、肝硬化、肝癌的发生和发展[5-6]。本研究回顾性分析了乙型肝炎肝硬化患者IL⁃6 水平、HBV⁃DNA 载量及感染HP 的情况,探讨IL⁃6 参与乙型肝炎肝硬化的可能机制。报道如下。
1 对象与方法
1.1 研究对象 选取首都医科大学附属北京世纪坛医院2017 年6 月至2021 年6 月收治的126 例乙型肝炎肝硬化患者作为研究组,其中男性71 例,女性55 例,年龄21~72 岁[(48.62 ± 12.36)岁],Child⁃Pugh 分级[7]:A 级31 例、B 级60 例、C 级35 例。选取同期接受体检的60 例健康人作为对照组,其中男性33 例,女性27 例,年龄22~70 岁[(47.13±11.88)岁],2 组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究设计符合《赫尔辛基宣言》。纳入标准:(1)符合中华医学会制定的乙型肝炎诊断标准,经病理学确诊为肝硬化[8];(2)近1 个月内未使用抗菌、抗病毒治疗;(3)病历资料完整;(4)所有患者均知情同意。排除标准:(1)合并其他感染性疾病;(2)合并其他原因所致的肝硬化;(3)合并恶性肿瘤;(4)合并自身免疫系统疾病。
1.2 方法 (1)IL⁃6 水平检测。患者入院时采集空腹外周静脉血5 ml,以离心半径为10 cm、转速为3 000 r/min 离心15 min,收集上清液待测。采用酶联免疫吸附法检测血清IL⁃6 水平,试剂盒购于美国R&D systems 公司。(2)肝功能测定。患者入院时采集空腹外周静脉血5 ml,以离心半径为10 cm、转速为3 000 r/min 离心15 min,收集上清液待测。采用电化学发光法检测患者血清丙氨酸氨基转移酶(alanineaminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)水平,使用日本日立7600 型全自动生化分析仪检测。(3)HBV⁃DNA 载量检测。患者入院时采集空腹外周静脉血2 ml,以离心半径为10 cm、转速为3 000 r/min 离心15 min,收集上清液待测。采用实时荧光定量聚合酶链式反应方法检测血清中HBV⁃DNA 载量,所需引物:上游引物(CCTCCT⁃CATCCTGCTGCT)、下游引物(AACT⁃GAAAGCCAAACAGTG) 、探 针 序 列(TET ⁃TCCCATCCCATCATCCCTGGGCTTT⁃TAMRA),均由上海生工生物工程股份有限公司提供,试剂盒购于广州达安基因股份有限公司。(4)HP 感染检测。采用酶联免疫吸附测定法检测血清中HP-抗体水平,试剂盒购于华美生物工程公司。HP-抗体≥100 dpm/mmol 为阳性,<100 dpm/mmol 为阴性。
1.3 统计学处理 本研究所得数据均采取SPSS 22.0 统计软件展开分析。计数资料以百分比(%)表示,行χ2检验;计量资料以±s表示,行独立样本t检验。相关性采用Pearson 分析;多组间比较采用单因素方差分析,组间两两比较采用LSD⁃t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 肝功能、IL⁃6、HBV⁃DNA 及HP 感染情况 研究组患者ALT、AST 明显高于对照组(P<0.01),ALB 明显低于对照组(P<0.01);研究组患者IL⁃6明显高于对照组(P<0.01);研究组患者HBV⁃DNA明显高于对照组(P<0.01);研究组患者HP 阳性率明显高于对照组(P<0.01)。见表1。
表1 研究组和对照组肝功能、IL⁃6、HBV⁃DNA 及HP 感染情况(± s)
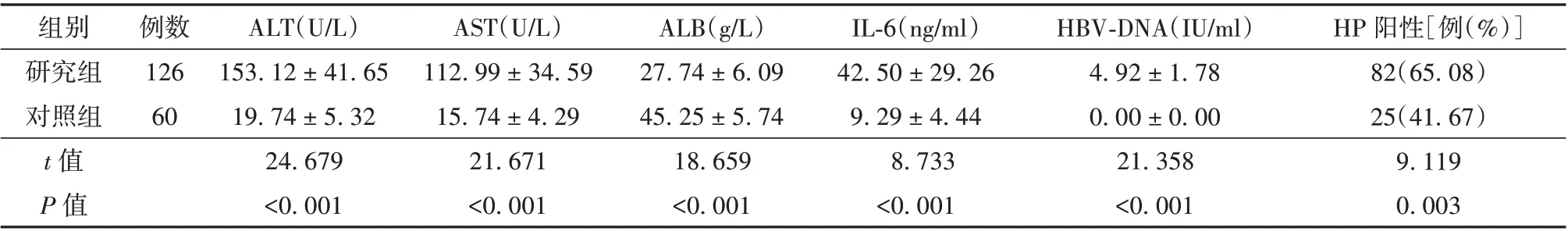
表1 研究组和对照组肝功能、IL⁃6、HBV⁃DNA 及HP 感染情况(± s)
注:ALT 为丙氨酸氨基转移酶,AST 为天冬氨酸氨基转移酶,ALB 为白蛋白,IL⁃6 为白细胞介素⁃6,HBV⁃DNA 为乙型肝炎病毒的脱氧核糖核酸,HP 为幽门螺杆菌
HP 阳性[例(%)]82(65.08)25(41.67)9.119 0.003组别研究组对照组t 值P 值例数126 60 ALT(U/L)153.12±41.65 19.74±5.32 24.679<0.001 AST(U/L)112.99±34.59 15.74±4.29 21.671<0.001 ALB(g/L)27.74±6.09 45.25±5.74 18.659<0.001 IL⁃6(ng/ml)42.50±29.26 9.29±4.44 8.733<0.001 HBV⁃DNA(IU/ml)4.92±1.78 0.00±0.00 21.358<0.001
2.2 不同Child⁃Pugh 分级患者肝功能、IL⁃6、HBV⁃DNA 载量及HP 感染比较 不同Child⁃Pugh 分级患者ALT、AST、ALB、IL⁃6、HBV⁃DNA 等比较,差异均具有统计学意义(P<0.01)。组间两两比较,C 级患者ALT、AST、IL⁃6、HBV⁃DNA 明显高于B 级,B级患者明显高于A 级(P<0.01);C 级患者ALB 明显低于B 级,B 级患者明显低于A 级(P<0.01)。不同Child⁃Pugh 分级患者HP 阳性率差异无统计学意义(P>0.05)。见表2。
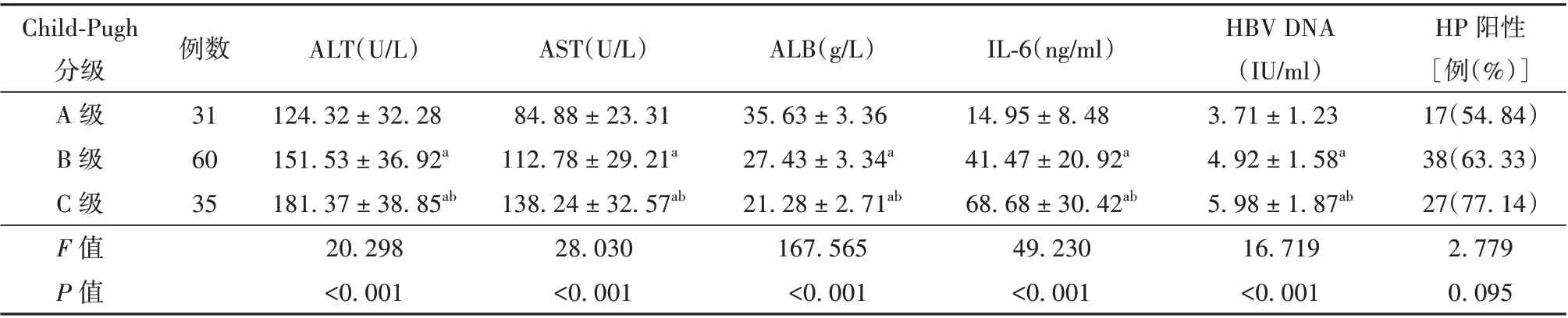
表2 不同Child⁃Pugh 分级患者肝功能、IL⁃6、HBV⁃DNA 及HP 感染比较
2.3 IL⁃6 与肝功能、HBV DNA、HP 感染的相关性 Pearson 分析结果显示,IL⁃6 与ALT、AST、HBV⁃DNA 等呈显著正相关(r=0.606、0.645、0.549,P<0.05);IL⁃6 与ALB 呈显著负相关(r=-0.446,P<0.05)。见图1。IL⁃6 与HP 阳性呈显著正相关(r=0.489,P<0.05)。
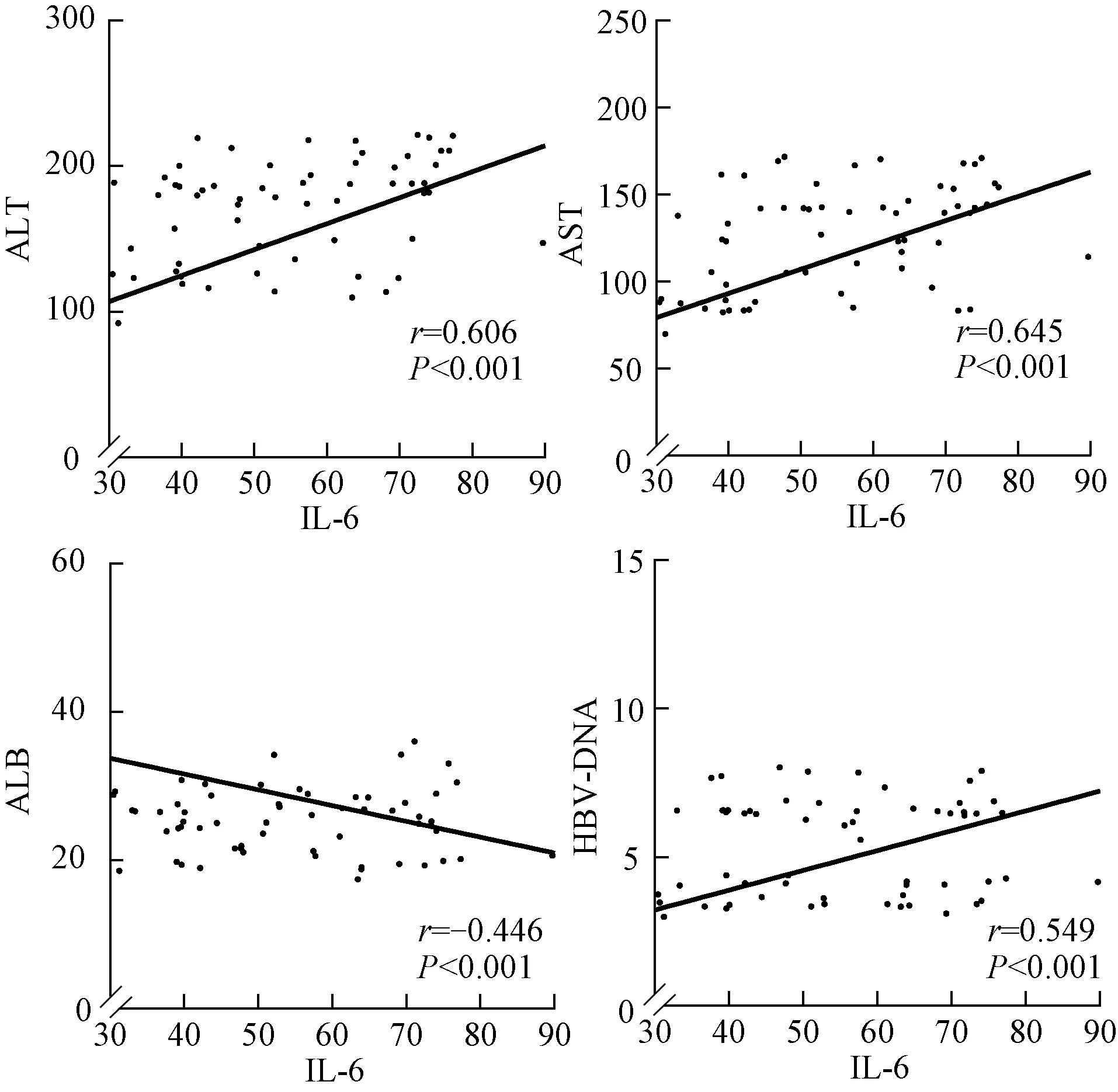
图1 IL⁃6 与肝功能、HBV DNA 的相关性
3 讨论
乙型肝炎是肝脏最常见的传染性疾病。据报道,全球估计有2.4 亿人患有慢性乙型肝炎,每年有2%~4%的患者发展为肝硬化,导致患者反复住院,生活质量下降,甚至引发死亡,严重危害人类生命健康[9]。因此,如何有效治疗、提高患者预后成为临床首要任务,其中研究乙型肝炎肝硬化的发生、发展机制有利于临床诊疗。
肝硬化是由复杂的细胞因子介导的信号通路网络调控造血干细胞的激活和纤维生成。肝纤维化是发展为肝硬化的必要途径,多见于不同病因的慢性肝脏疾病,其形态、生理特征主要是细胞外基质大量沉积于肝组织,降低肝功能,其中细胞因子、微小核糖核酸参与肝纤维化和肝硬化的发生、发展[10]。IL⁃6 是一种多生物学功能细胞因子,作为炎症介质在免疫反应、炎症、细胞分化和肿瘤发展中发挥重要作用。有学者发现IL⁃6 在损伤、创伤、应激、感染等因素引起的炎症反应中的表达量显著上调,作为重要因素诱发和促进慢性肝炎的发生、发展[11]。本研究结果显示,IL⁃6 在乙型肝炎肝硬化患者机体中的表达量明显高于正常人,且随着Child⁃Pugh 等级增加而增多,而有学者发现乙型肝炎肝硬化患者经治疗后IL⁃6 水平明显降低。相关性分析显示,IL⁃6 表达水平与肝功能呈明显的正相关,进一步说明IL⁃6 与肝硬化密切相关,原因在于IL⁃6 在肝细胞、中性粒细胞、单核细胞/巨噬细胞和淋巴细胞膜上与受体IL⁃6R 结合形成复合物,激活细胞NF⁃κB 信号传导和Ras⁃MAPK 通路,刺激T 细胞和B淋巴细胞,促进B 淋巴细胞成熟和分化,诱导机体产生C 反应蛋白和纤维蛋白原等炎症因子,诱发级联反应,介导肝细胞损伤[12]。
近年来研究证明,HBV 感染是肝病的主要原因,25%~30% 的HBV 感染患者最终发展为肝硬化。HBV 首先附着在肝细胞膜上,与包膜蛋白结合进入受体蛋白,随后HBV 包膜与病毒的内体膜内吞和融合[13]。本研究中乙型肝炎肝硬化患者检测出较高的HBV 载量,而对照组则无HBV 感染,提示乙型肝炎肝硬化与HBV 活性密切相关。本研究相关性分析显示,IL⁃6 与HBV 感染具有显著的正相关,原因在于当HBV 感染后,其在肝细胞内大量复制,导致肝细胞受损,引起机体免疫应答,激活巨噬细胞、淋巴细胞等免疫细胞,诱发免疫级联反应,分泌大量的IL⁃6,加重炎症反应,引起肝细胞坏死、肝功能下降,进而激活肝星状细胞,增加肝内胶原合成,导致肝硬化[14]。有学者报道IL⁃6 与HBV 的复制密切相关,通过体内、体外试验发现,在IL⁃6 存在的微环境中,HBV 感染性增强,IL⁃6 能促进HBV的感染[15]。也有学者发现,HBV 感染的患者IL⁃6表达水平增加,主要是因为HBV⁃X 蛋白通过与转录因子结合调控IL⁃6 基因的转录、翻译,从而促进肝炎的进展,导致肝硬化[16]。因此,IL⁃6 与HBV 感染、复制等机制还有待进一步研究。
HP 感染是临床常见的革兰氏阳性病原菌,主要感染部位在胃部,是导致各类胃部疾病的重要因素,同时也在脂肪性肝、肝炎、肝纤维化和肝硬化中发挥着重要的作用[17]。乙型肝炎肝硬化患者的肝脏组织存在HP 的DNA,影响脂质代谢紊乱,导致肝细胞脂肪积累、变性,使肝细胞纤维化,肝纤维化后患者免疫功能不全,肝内免疫细胞数量减少,因此可能通过门静脉流入肝脏的HP 不能被及时捕获和消除,导致HP 免疫逃逸[18]。HP 感染会引起机体体液免疫反应,产生特异性抗体,对肝细胞产生毒害作用,使肝细胞变形、增生、破坏,加速肝细胞凋亡,进一步加剧肝损伤,最终导致肝硬化[19]。本研究结果显示,乙型肝炎肝硬化患者的HP 感染阳性率明显高于对照组,不同Child⁃Pugh 分级之间虽有差异,但无统计学意义。IL⁃6 表达水平越高的患者其HP 感染阳性率越高,而相关性分析显示,IL⁃6 与HP 感染呈显著正相关,可能因为HP 感染刺激引起局部和全身促炎细胞因子的释放,导致局部炎症反应,促进IL⁃6 的释放[20]。此外,在中医学的学习中发现,中医学虽无关于“肝硬化”“HBV”及“HP”的直接论述,但从传染病角度看,无论HBV 还是HP,均有明确的传染源、传播途径和易感人群,符合《瘟疫论》中记载的“疫者感天地之厉气,此气之来,无论老幼强弱,触之即病”,属“疫毒邪气”范畴。而从临床表现看,二者导致的疾病多见肝脾不和、湿热中阻、湿毒内停等以中焦脾胃为核心、水液代谢异常的证候类型[21-22],故具有一定的脏腑发病相关性。这从中医证候角度解释了HP 与HBV 感染肝硬化的关联。
综上所述,IL⁃6 在乙型肝炎患者肝硬化发生、发展中发挥着重要的作用,与HBV 病毒的感染、复制密切相关,可作为HP 感染肝脏组织的重要标志物。本研究结果与国内外部分报道有差异,可能与本研究样本量较少有关。因此,有待进一步扩大研究的样本量及进行体外细胞试验、体内动物实验研究。

