SAH 对猪成纤维细胞体外增殖及甲基化水平的影响
谢颖瑜,曹嘉程,宋红兵,王 静,吴艳玲,肖天放,林瑞意
(福建农林大学动物科学学院(蜂学学院),福建福州 350002)
猪体细胞核移植技术对猪遗传改良、种质资源保护及生物医学研究等具有重要意义。然而,猪克隆胚胎发育效率低下,其主要原因之一是体细胞核重编程异常,这与表观遗传修饰密不可分。DNA 甲基化作为一种常见的表观遗传修饰,对哺乳动物的胚胎发育至关重要。供体细胞DNA 甲基化状态不完全重编程是影响克隆胚胎成功率的主要原因之一,使用高度甲基化的体细胞作为核供体,会降低克隆效率。研究发现,抑制DNA 甲基转移酶(DNMTs)的活性是一种有效可行的方法。因此,许多DNA 甲基转移酶抑制剂(DNMTis)被研究并应用于降低供体细胞的DNA 甲基化水平,提高克隆胚胎的成功率,如5-aza-dC、RG108、毛壳素、Zebularine等。S-腺苷高半胱氨酸(SAH)是一种无毒的DNMTi,研究表明,SAH 处理供体细胞可降低细胞的DNA 甲基化水平,提高供体核的重编程效率,促进克隆胚胎的早期发育,但其对猪供体细胞的最佳作用浓度与时间尚不清楚,缺乏SAH 对猪体细胞核移植效率的影响研究。本实验以猪成纤维细胞为供体细胞,通过使用不同浓度的SAH 处理猪成纤维细胞,检测其对细胞活力、周期、凋亡和甲基化水平等的影响,从而筛选SAH 的最佳作用浓度与时间,为后期探究SAH 对猪体细胞核移植的影响奠定研究基础。
1 材料与方法
1.1 实验材料 本实验所用成纤维细胞分离自官庄花猪保种场4 周龄母猪的耳组织。
1.1.1 主要试剂 DMEM 高糖培养基、胶原酶、胰酶、双抗青链霉素、PBS 缓冲液、FBS 胎牛血清(美国Hyclone 公司);无血清冻存液(苏州新赛美生物科技有限公司);CCK8 试剂盒、细胞凋亡检测试剂盒、细胞周期检测试剂盒(上海百赛生物技术股份有限公司);DAPI、BSA 封闭液、Triton X-100(北京索莱宝科技有限公司);多聚甲醛(上海碧云天生物技术有限公司);抗体通用稀释液、Alex Flour488 标记山羊抗兔IgG(H+L)、兔抗人Vimentin 抗体(杭州华安生物技术有限公司);MethylFlashGlobal DNA Methylation (5-mC) ELISA Easy Kit(武汉艾美捷科技有限公司);SAH(美国MedChemexpress 生物科技公司);总RNA 提取试剂盒(北京天漠科技开发有限公司);Vazyme R223-01 合成试剂盒(南京诺维赞生物技术有限公司);HieffTM qPCR SYBRGreen Master Mix(Low Rox Plus)(翊圣生物科技上海有限公司);DNA 提取试剂盒(天根生化科技有限公司)。
1.1.2 溶液配制 完全培养液的配制:44 mL DMEM高糖培养基+5 mL FBS 胎牛血清+1 mL 双抗青链霉素;SAH 储备液的配制:10 mg SAH 粉末+2.6014 mL DMSO,配置成10 mmol/L 的SAH 储备液,分装置于-80℃专用冰箱中冷冻保存。
1.1.3 实验设计 以0 mmol/L SAH 为对照组,每组3个重复,实验包括3 个部分,第1 部分:分别使用不同浓度的SAH(0、0.01、0.1、0.5、1 mmol/L)处理猪成纤维细胞12、24、48、72 h,对处理后各组的细胞活力进行检测,筛选SAH 的最佳作用时间。第2 部分:根据细胞活力的检测结果,使用不同浓度的SAH(0、0.01、0.1、0.5、1 mmol/L)处理猪成纤维细胞24 h,检测细胞形态、周期、凋亡及DNA 甲基化水平的变化,筛选SAH 的最佳作用浓度;第3 部分:根据前文实验结果,以0.1 mmol/L SAH 处理猪成纤维细胞24 h 为实验组,通过qRT-PCR 比较对照组与实验组中相关基因表达的差异。
1.2 实验方法
1.2.1 原代成纤维细胞的分离与培养 耳组织刮毛清洗干净后置于无菌环境中,使用眼科剪将耳组织剪碎成1 mm大小,转移至5 mL 离心管中,加入2 mL 胶原酶充分混匀,置于摇床中,37℃、220 rpm 消化2~4 h,加入完全培养基终止消化。1 000 rpm 离心3 min,弃上清,加入4 mL 完全培养基吹打混匀,转移至T-25 培养瓶中培养,每2 d 更换一次培养液。
1.2.2 成纤维细胞的传代培养 当细胞生长汇合至80%~90%,吸弃原培养液,加入适量PBS 清洗2 次;加入2 mL 胰酶消化1 min 左右,置于倒置显微镜(Nikon,TS100)下观察,若细胞开始回缩变圆,则终止消化并轻轻反复冲洗瓶底,使细胞脱落下来;移入5 mL 离心管中,1 000 rpm 离心3 min,弃上清,加入3 mL 完全培养液吹打重悬细胞,按1:3 的比例进行分瓶,后置于CO培养箱(赛默飞,Midi40 CO培养箱)中继续培养。
1.2.3 成纤维细胞的冻存与复苏 消化离心步骤同1.2.2,弃上清,加入1 mL 无血清冻存液吹打重悬细胞,转移至2 mL 冻存管后,梯度降温保存至-80℃冰箱中过夜后移入液氮罐中。取出冻存管,迅速放入37~39℃恒温水浴锅中解冻1~2 min,同时,轻轻晃动冻存管,至冻存液完全融化;将解冻后的细胞融液转移到2 mL离心管中,1 000 rpm 离心3 min;弃上清,加入2 mL完全培养液后轻轻吹打重悬细胞,吸取细胞悬液至T-25培养瓶中;加入3 mL 完全培养液,吹打混匀后放入CO培养箱中静置培养,每2 d 更换一次培养液。
1.2.4 成纤维细胞纯度检测 成纤维细胞属于间充质细胞,常使用Vimentin 细胞免疫荧光染色检测成纤维细胞纯度。将第4 代成纤维细胞铺至六孔细胞板(2×10/孔),待细胞贴壁生长汇合至70% 左右时,吸弃原培养基,加入PBS 重复清洗2 次;每孔中加入1 mL 4% 多聚甲醛溶液,室温固定20 min,使用PBS 洗涤细胞3 次;加入1 mL 0.5% TritonX-100 孵育15 min,PBS 洗涤3次;加1 mL 10%山羊血清室温封闭2 h,PBST 洗涤2次;加入1 mL 专用型抗体稀释液稀释的兔抗人Vimentin 抗体(1:200),室温孵育1 h,PBST 洗涤3 次;加入1 mL DAPI 复染5 min,PBST 洗涤3 次后,避光保存,荧光显微镜(Nikon,Ts2R-FL 倒置荧光显微镜)下观察细胞形态并计数Vimentin 阳性细胞。
1.2.5 细胞活力检测 当第4 代成纤维细胞生长汇合至80%~90%进行胰酶消化,消化完成的细胞制成悬液后接种于96 孔板中(100 μL/孔,细胞数量约为6 000 个);放入CO培养箱中预培养24 h;使用不同浓度的SAH处理供体细胞;加入10 μL CCK8 溶液,置于培养箱中避光孵育2 h,使用酶标仪(赛默飞,MK3 型酶标仪)在450 nm 波长下测定CCK8 的吸光度值。

1.2.6 细胞周期检测 参照百赛生物细胞周期检测试剂盒说明书进行细胞周期检测样品制备,24 h 内完成流式检测。
1.2.7 细胞凋亡检测 参照百赛生物细胞凋亡检测试剂盒说明书进行细胞凋亡检测样品制备,2 h 内通过流式细胞仪(BD AccuriC6 Plus 个人型流式细胞仪)检测细胞凋亡情况。
1.2.8 细胞整体DNA 甲基化水平检测 ①DNA 的提取:按照DNA 提取试剂盒操作说明书进行DNA 提取,使用NanoDrop分光光度计(赛默飞NanoDrop分光光度计)检测DNA 纯度和浓度;②整体DNA 甲基化水平检测:用5-mC ELISA Kit 检测各组的DNA整体甲基化水平,每组设3 个复孔,每孔加入100 ng DNA 样品,在酶标仪450 nm 波长下测定其吸光度。
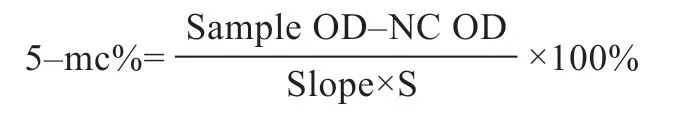
1.2.9 细胞相关基因表达 ①细胞中总RNA 的提取:运用1%琼脂糖凝胶电泳检测提取RNA 的完整性,并使用NanoDrop分光光度计测定总RNA 的浓度和纯度;②引物设计:采用NCBI 在线软件进行实时荧光定量PCR 引物设计,由生工生物工程(上海)股份有限公司合成,引物序列见表1;③cDNA 合成:反应条件依次为37℃2 min;55℃5 min;85℃5 min,反应体系为:RNA Template 5 μL,MonScrip5*RTIII AII-in-One mix 4 μL,MonScriptTMdsDNase 1 μL,Nuclease-Free Water 10 μL;④qRT-PCR 检测:反应体系为:cDNA 4 μL,HieffqPCR SYBR Green Master Mix 10 μL,Forward Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,RNase-free ddHO 5.2 μL;反应条件为:第1 阶段预变性95℃5 min;第2 阶段循环反应95℃10 s 与60℃30 s,进行40 个循环;第3 阶段溶解曲线阶段使用仪器(Lightcycler 480)默认设置,依照2计算相关基因表达量。

表1 qRT-PCR 引物
1.3 统计分析 使用Modfit LT 进行细胞周期分析,FlowJo_V10 进行细胞凋亡分析,SPSS 软件(21.0 版)进行统计学分析,GraphPad Prism 8.0.2 进行绘图,实验结果以“平均值±标准差”的形式表示。
2 结果
2.1 猪成纤维细胞的纯度检测 成纤维细胞传代培养至第4 代时铺6 孔板,待生长汇合至70% 左右,进行Vimentin 免疫荧光化学染色,在荧光显微镜下观察可发现Vimentin 阳性细胞发出绿色荧光(图1),同时DAPI 染色计算总细胞数,算出Vimentin 阳性细胞率>95%,说明第5 代成纤维细胞纯度较高,可用于进行后续实验。
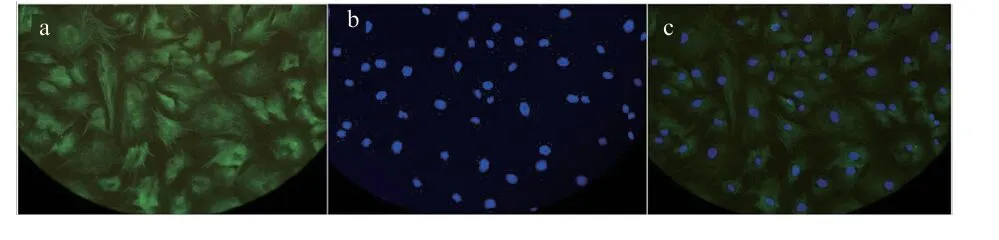
图1 猪成纤维细胞纯度检测结果
2.2 SAH 对猪成纤维细胞活力的影响 从不同浓度SAH 处理不同时间对猪成纤维细胞活力的影响可知(图2),细胞活力随着SAH 作用时间的增加而逐渐降低,作用时间越长细胞活力下降愈明显。12 h,各组的细胞活力无显著差异;24 h,与对照组相比,0.01 mmol/L及0.1 mmol/L SAH 处理对细胞活力无明显影响,但0.5 mmol/L 和1 mmol/L SAH 处理会导致细胞活力极显著下降;48 h 和72 h,各实验组呈现剂量依赖性,随着处理浓度的增加,细胞活力显著降低。

图2 SAH 对细胞活力的影响
2.3 SAH 对猪成纤维细胞形态学的影响 从不同浓度SAH 处理成纤维细胞24 h 对细胞形态学的影响可知(图3),与对照组相比,0.01 mmol/L 与0.1 mmol/L SAH 处理后细胞能正常生长,形态学无明显变化,但0.5 mmol/L 和1 mmol/L SAH 处理成纤维细胞会使细胞拉伸变长,并离壁悬浮,出现凋亡现象。
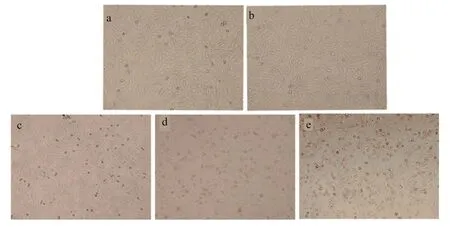
图3 SAH 对细胞生长的影响
2.4 SAH 对猪成纤维细胞周期的影响 依据细胞内DNA 含量,可将细胞分为3 个时期:G0/G1 期、S 期、G2/M 期,经PI 染色后,根据荧光强度可将处于不同细胞周期中的细胞区分开来,从而判断细胞所处的周期,结果如图4 与图5 所示。可见,与对照组(0 mmol/L)相比,0.1 mmol/L SAH 处理可显著提高细胞中G0/G1期的占比;不同浓度SAH 处理后细胞中G2/M 期的占比均显著高于对照组;当SAH 作用浓度≥0.1 mmol/L时,细胞中S 期的占比显著低于对照组。由此可见,添加浓度为0.1 mmol/L 的SAH 处理猪成纤维细胞24 h可诱导细胞阻滞在G0/G1 期和G2/M 期。

图4 SAH 对细胞周期图谱的影响

图5 SAH 对细胞周期分布的影响
2.5 SAH 对猪成纤维细胞凋亡的影响 使用不同浓度的SAH 处理猪成纤维细胞24 h,经流式细胞仪检测,结果如图6 与图7 所示。可见,0.01 mmol/L 和0.1 mmol/L 处理组的早期凋亡率、晚期凋亡率和总凋亡率与对照组(0 mmol/L)相比,均无显著变化,但0.5 mmol/L 和1 mmol/L SAH 处理后,细胞早期凋亡率、晚期凋亡率和总凋亡率均显著提高。
图6 SAH 对细胞凋亡图谱的影响
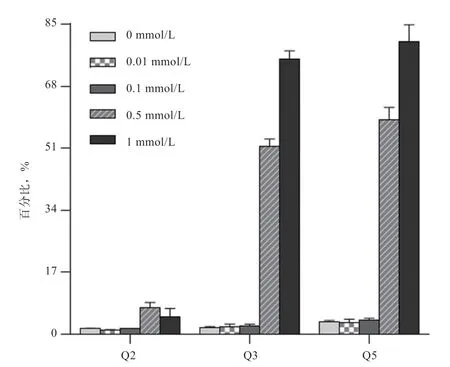
图7 SAH 对细胞凋亡的影响
2.6 SAH 对猪成纤维细胞整体DNA 甲基化水平的影响 从不同浓度SAH 处理24 h 后对猪成纤维细胞整体DNA 甲基化水平的影响可知(图8-a),与对照组相比,SAH 处理可极显著降低细胞整体DNA 甲基化水平,SAH 作用浓度越高,下降越明显。
2.7 SAH 对成纤维细胞相关基因表达的影响 对0.1 mmol/L SAH 处理24 h 后的猪成纤维细胞进行相关基因表达分析可知(图8-b),与对照组相比,0.1 mmol/L SAH 处理24 h 可显著上调和的表达,同时使的表达极显著降低,但对和的表达无显著影响。
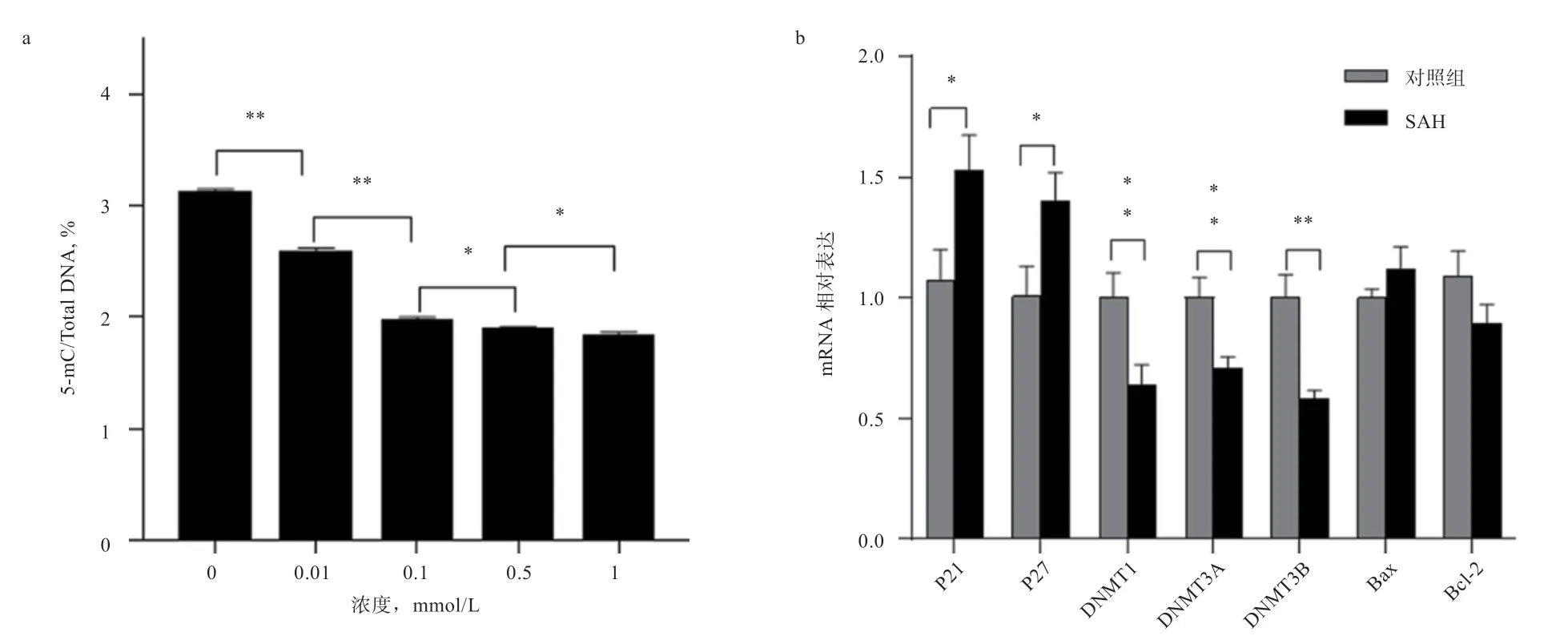
图8 SAH 对细胞整体甲基化水平及相关基因表达的影响
3 讨 论
3.1 SAH 处理对猪成纤维细胞周期的影响 SAH 是一种非细胞毒性的DNMTi,在体细胞核移植前使用SAH 处理供体细胞可以显著抑制DNMTs 的活性,促进克隆牛胚胎的体外发育。本研究结果表明,使用0.1 mmol/L SAH 处理猪成纤维细胞24 h 可将成纤维细胞阻滞在G0/G1 期,并显著提高细胞中基因和基因的相对表达量。研究表明,增强和的表达可诱导细胞周期阻滞在GO/G1 期,而使用或的siRNA 转染细胞,会导致和表达下调,同时诱导细胞G0/G1 期阻滞减弱。使用G0/G1 期阻滞的供体细胞进行体细胞核移植可提高克隆效率,供体细胞G0/G1 期的染色质被认为是影响克隆胚胎发育的最有效因素之一。有报道称,供体细胞周期同步化在G0/G1 期对胚胎发育至关重要,在克隆胚胎移植到代孕母体后,可以提高其存活率。
3.2 SAH 处理对猪成纤维细胞增殖和凋亡的影响 细胞增殖是细胞生命活动的重要特征,是生物繁育的基础。本研究发现各实验组呈现时间和剂量依赖性,随着SAH 作用时间和浓度的增加,成纤维细胞生长增殖受到抑制,细胞活力逐渐下降。该实验结果与王文璐的研究结论相似,高浓度的小分子化合物作用于供体细胞可导致细胞DNA 的损伤,激活相关凋亡基因的表达,抑制细胞生长,降低细胞增殖活力。
凋亡的发生受促凋亡蛋白和抗凋亡蛋白共同调控,二者比例决定了细胞对凋亡信号的敏感性。研究发现,使用DNA 甲基化转移酶抑制剂处理供体细胞,可增加细胞对凋亡信号的敏感度,且DNA 甲基化转移酶抑制剂对供体细胞凋亡的影响具有累加效应。本研究结果表明,使用0.5 mmol/L 和1 mmol/L SAH处理猪成纤维细胞24 h 会导致细胞出现大量凋亡,但0.1 mmol/L SAH 处理猪成纤维细胞24 h 对细胞凋亡率及凋亡相关基因()表达无明显影响。SAH作为一种DNA 甲基化转移酶抑制剂,可降低细胞中基因的表达,促使细胞对凋亡过程敏感。基因属于BCL2 蛋白家族,其编码的Bcl-xL蛋白被归类为凋亡抑制剂,通过阻断电压依赖性阴离子通道(VDAC),从而阻止细胞色素c1 的释放。
3.3 SAH 处理对猪成纤维细胞DNA 甲基化水平的影响 DNA 甲基化是一种重要的表观遗传标记,与染色质的状态密切相关,可抑制基因的活性。SAH 作为一种DNA 甲基转移酶抑制剂,通过与DNMTs 结合从而抑制其催化作用,调节生物体转甲基化反应。本研究发现,与对照组相比,SAH 处理猪成纤维细胞24 h可降低细胞整体DNA 甲基化水平和DNA 甲基转移酶相关基因的表达。该结果与Schumann 等人的研究结果一致,SAH 处理可降低基因的表达水平。主要以复制依赖的方式维持体细胞中的甲基化模式,而和可在DNA 上建立新的甲基化模式。其中,是早期发育过程中关键的从头DNA 甲基转移酶,对染色体和基因组结构至关重要。有研究表明,体细胞中的一种特定亚型会阻碍合子基因组激活和基因组甲基化重编程,导致克隆胚胎发育停止,而敲除可有效激活胚胎发育所需基因的表达,提高克隆效率。
SAH 处理成纤维细胞可在不影响细胞正常生长增殖和形态的基础上,降低DNMT 转录水平和整体DNA甲基化水平,说明SAH 具有诱导成纤维细胞进入低分化状态、改善克隆效率的潜能。
4 结 论
0.1mmol/L SAH 处理猪成纤维细胞24 h 可降低细胞整体DNA 甲基化水平和DNMT 相关基因的表达,对细胞损伤较小,且可提高细胞中周期调控关键基因的表达,将细胞阻滞在G0/G1 期,适合用于开展后续的猪体细胞核移植研究。

