猪单核/巨噬细胞吞噬能力的测定和遗传参数估计
李 航,马福平,韩 余,刘华涛,张丰霞,杨金艳,朱冉冉,连正兴,王楚端
(中国农业大学动物科学技术学院,农业农村部动物遗传育种与繁殖重点实验室,动物育种国家工程实验室,北京 100193)
2018 年中国首次暴发非洲猪瘟,由于防控不严,导致生猪频繁调运,病毒随之迅速扩散,造成更多的猪感染非洲猪瘟而死亡,给养猪业造成了巨大损失。其中,育种企业遭受的影响最大,不仅损失惨重,而且育种工作也停滞不前。疾病不但增加了养殖行业的生产成本和风险,降低遗传进展速度,也影响着食品安全问题。
在当代猪育种中,主要关注繁殖性状、生长性状、耗料增重比等,对抗病性状不够重视,但疾病是造成养猪业效率低下的第一大要素,抗病育种应得到足够重视。生产性能与抗病力相关的研究较少,如何平衡好一般抗病力和生产性能间的关系,在不降低生产性能的前提下选育一般抗病力强的新品种值得关注。抗病育种的研究较为复杂,选择合适的抗病指标成为关键,有研究发现在家禽中单核/巨噬细胞的吞噬积与体液免疫呈正相关,可以作为体液免疫应答的一个可靠指标;对高吞噬积个体的选择可以提高群体的体液免疫水平和抗病力。因此,本研究尝试通过测定大白猪单核/巨噬细胞吞噬能力估计其遗传参数,为猪的抗病育种研究提供参考。
1 材料与方法
1.1 实验动物及血样 本研究的实验动物是由北京市顺鑫农业股份有限公司鹏程食品分公司提供的具有系谱的277 头大白猪,采血后,轻轻混匀血液和抗凝剂,4℃保存,迅速带回实验室分离单核/巨噬细胞。
1.2 主要试剂及耗材 胰蛋白酶-EDTA 消化液(0.25%)含酚红、胎牛血清、RPMI 1640 培养基、D-PBS 缓冲液、DMSO、猪外周血淋巴细胞分离液、红细胞裂解液、D-Hanks 缓冲液、0.5%的MTT 溶液、瑞氏-姬姆萨复合染色试剂盒、5 mL 负压采血管、离心管、细胞培养皿、12 道可调式移液器、一次性加液槽、2 mL 96 孔深孔板、96 孔细胞培养板、封板膜。
1.3 细胞系的培养和染色 将HCT-8 细胞从液氮中取出,于37℃水浴锅中完全解冻后,转移到15 mL 离心管中再加入1 mL RPMI1640 完全培养液吹打混匀,用低速离心机1 000 r/min 离心5 min;离心后,向25T培养瓶中加入4 mL RPMI1640 完全培养液,取出离心管弃上清再加入1 mL RPMI1640 完全培养液混匀细胞,移至加好培养液的培养瓶中;放在37℃、5% CO的恒温培养箱中培养一段时间后,用显微镜观察并在培养基变黄之后换液。当100 mm 细胞培养皿中HCT-8 细胞的汇合度达到90%左右,在避光环境中加入2 mL 0.5%的MTT 溶液;放在37℃,5% CO的恒温培养箱中培养4 h 后,倒掉液体,向培养皿的边缘缓慢加入3 mL D-PBS 缓冲液洗涤2 次;向培养皿中加入 2 mL D-PBS,将被MTT 溶液染色的贴壁细胞吹打下来,用15 mL 离心管收集,再用铝箔纸包裹后放在4℃冰箱。
1.4 外周血单核/巨噬细胞的分离和培养 将猪外周血淋巴细胞分离液试剂盒中的稀释液0.5 mL,加入到一个2 mL 96 孔深孔板中,再加入等体积抗凝血混匀稀释;然后把淋巴细胞分离液1 mL,加入到另一个2 mL 96孔深孔板中,将稀释后的血液缓慢加入到分离液之上,贴上封板膜,用平板离心机2 500 r/min 离心5 min;离心后的液体分为4 层,将上面3 层吸取到新的2 mL 96孔深孔板中,用D-Hanks 缓冲液配平,2 000 r/min 离心5min;缓慢倒掉上清,向有红细胞的孔中加入1mL红细胞裂解液,混匀细胞,5 min 后,加入清洗液配平,2 000 r/min 离心5min;再缓慢倒掉上清,得到的细胞沉淀每孔用600 μL RPMI1640 完全培养液吹打混匀后,转移到96 孔细胞培养板,每个个体3 个处理,3 个对照,每孔100 μL;放在37℃,5% CO的恒温培养箱中培养1 d 后,用12 道可调式移液器吸走培养液,并用100 μL D-PBS 缓冲液洗涤1 次;每孔加入150 μL RPMI1640 完全培养液,放在培养箱中培养2 d;2 d 后,吸走培养液,用100 μL D-PBS 缓冲液洗涤1 次,加入100 μL RPMI1640 完全培养液继续培养;12 h 后得到所需要的单核/巨噬细胞。
1.5 瑞氏-姬姆萨染色单核/ 巨噬细胞 将需要染色的孔中培养液弃掉,用100 μL D-PBS 缓冲液洗涤一次,加入2~3 滴WG 染色液,等待3~5 min;滴加等量的WG 缓冲液,轻轻晃动培养板,相同时间后,吸出液体,用显微镜观察并拍照。
1.6 检测外周血单核/巨噬细胞的吞噬积 在避光条件下,将15 mL 离心管中MTT 处理的HCT-8 细胞摇匀后,吸入到一次性加液槽中,用12 道可调式移液器向每个个体3 个处理孔加入20 μL;放入培养箱6 h 后,在避光条件下,向每个个体3 个对照孔加入20 μL 的0.5%的MTT 溶液;再放入培养箱4 h 后,吸出每个孔中的液体,用100 μL D-PBS 缓冲液轻轻洗涤一次后,加入150 μL DMSO(不接触孔壁);用酶联免疫检测仪检测96 孔细胞培养板在570 nm 和630 nm 处的吸光值;吞噬积的计算方式为MTT(噻唑蓝)染色后的人回盲肠癌细胞(HCT-8)被吞噬的数量除以总的单核/巨噬细胞数量,即吞噬积=(OD 处理孔570nm-OD 处理孔630nm)/(OD 对照孔570nm-OD 对照孔630nm)。
1.7 生产性状的测定 大白猪屠宰后,依据《瘦肉型猪胴体性状测定技术规范》、《猪肌肉品质测定技术规范》测定胴体性状和肉质性状。胴体性状包括胴体重、胸腰长、胴体长、胴体直长、胴体斜长、最后肋骨处背膘厚、肋骨数、眼肌面积;肉质性状包括肌内脂肪含量、24 h滴水损失、48 h 滴水损失、pH、肉色亮度(L)、肉色红度(a)、肉色黄度(b)。
1.8 统计分析 用Excel 整理系谱和试验结果,对测定指标进行描述性统计,应用 SPSS 26.0 统计软件对数据进行正态性检验和性状间表型相关分析,发现大部分数据符合正态分布,其中吞噬积结果不符合正态分布,对其通过JMP 软件进行正态转换后再分析。整理好两个输入文件(记录数据文件、系谱文件)和一个参数文件,使用DMU 软件中dmuai 模块(约束性最大似然法估计方差组分)估计吞噬积、胴体性状和肉质性状的遗传参数。所使用的模型如下:
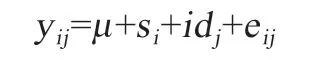
式中,y是吞噬积、胴体性状和肉质性状的测定值;是各测定值的群体均值;s是性别的固定效应;id是动物个体的加性遗传效应向量;e为随机残差向量。
2 结果
2.1 猪单核/ 巨噬细胞的吞噬能力 在100 mm 细胞培养皿传代培养4 h 后,有的细胞呈现圆形,有的细胞已经贴壁生长(图1-A),培养24 h HCT-8(人回盲肠癌细胞)的汇合度达到70% 左右(图1-B),培养48 h HCT-8 的汇合度达到90%左右(图1-C),用0.5%的MTT 溶液处理,HCT-8 细胞死亡并产生蓝紫色的结晶(图1-D)。
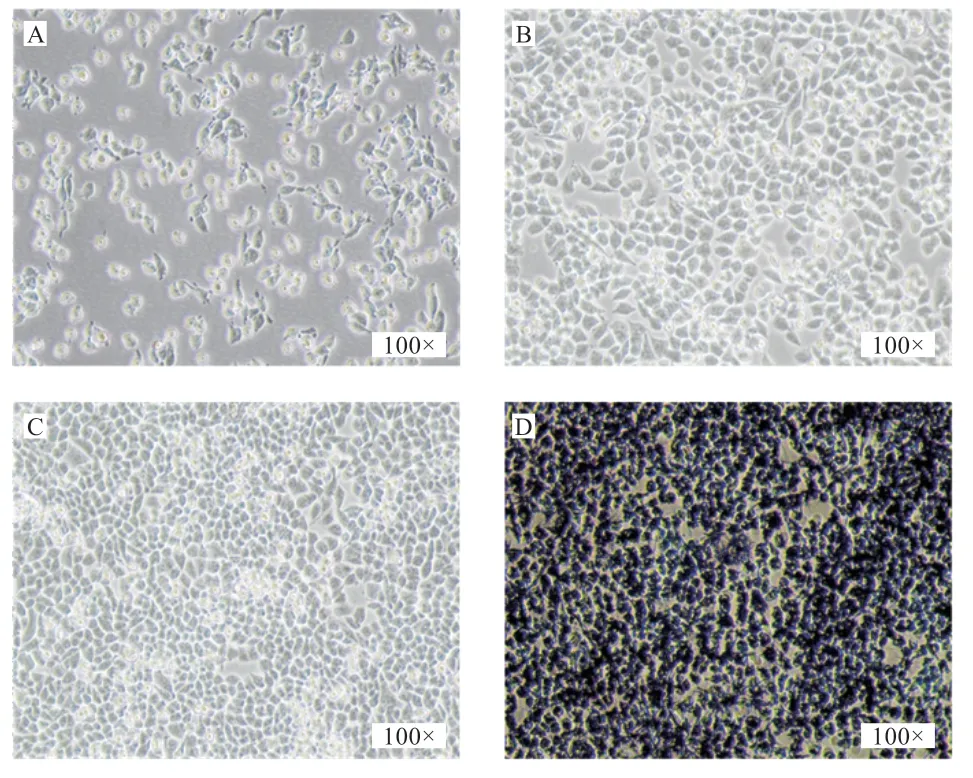
图1 HCT-8 细胞的数量和形态
图2-A 是分离培养84 h 后,在200 倍显微镜下观察的猪单核/巨噬细胞;图2-B 是用瑞氏-姬姆萨将其染色,可以看出细胞核处于细胞的一侧,较大且不规则,细胞冲洗后不脱落具有贴壁的性质;MTT 处理的HCT-8 细胞会在单核/巨噬细胞处聚集(图2-C);图2-D 是用MTT 处理的单核/巨噬细胞,单核/巨噬细胞与MTT 反应形成蓝紫色结晶。
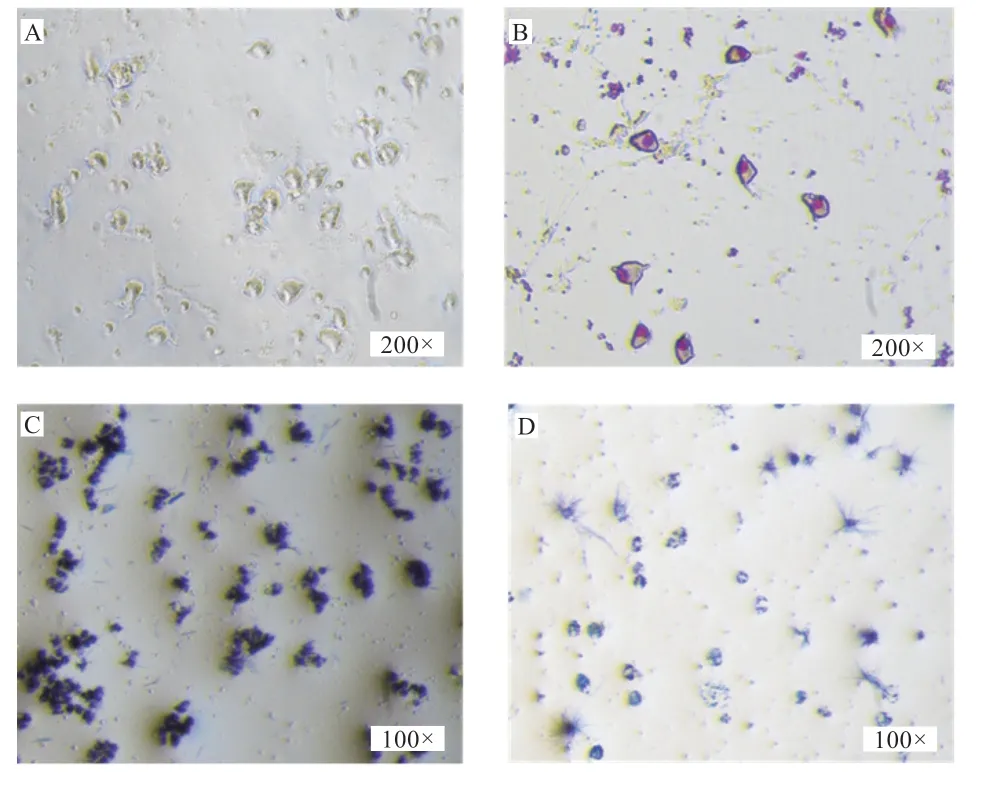
图2 单核/巨噬细胞的形态和处理
不同个体猪外周血单核/巨噬细胞数量和吞噬能力相差较大,在倒置显微镜下观察可以明显看到差别,蓝紫色的HCT-8 细胞聚集在单核/ 巨噬细胞的周围,图3-A 是单核/ 巨噬细胞数量和吞噬MTT-HCT-8 细胞多的个体,而图3-B 是单核/ 巨噬细胞数量和吞噬MTTHCT-8 细胞少的个体。用酶联免疫检测仪检测DMSO溶解MTT 染色细胞后的吸光度值可以反映出被吞噬细胞的数量。

图3 单核/巨噬细胞吞噬MTT-HCT-8 能力
2.2 各性状的基本统计量 如表1 所示,本实验中大白猪吞噬积的平均值为3.05,标准差为1.87,最大值为14.13,最小值为1.01,变异系数为0.61。

表1 吞噬积的基本描述性统计
胴体性状的测定结果如表2 所示,平均值的范围为14.23(肋骨数)到103.16(胴体长);标准差的范围为0.80(肋骨数)到8.20(胴体重);最大值的范围为17.00(肋骨数)到114.00(胴体长);最小值的范围为9.32(最后肋骨处背膘厚)到94.00(胴体长);变异系数的范围为0.03(胴体长)到0.23(最后肋骨处背膘厚)。

表2 胴体性状的基本描述性统计
肉质性状的测定结果如表3 所示,平均值的范围为1.83(24 h 滴水损失)到46.09(肉色L值);标准差的范围为0.25(pH)到2.02(48 h 滴水损失);最大值的范围为3.92(肌内脂肪含量)到52.87(肉色L值);最小值的范围为0.38(24h 滴水损失)到40.77(肉色L值);变异系数的范围为0.04(pH)到0.65(24 h滴水损失)。
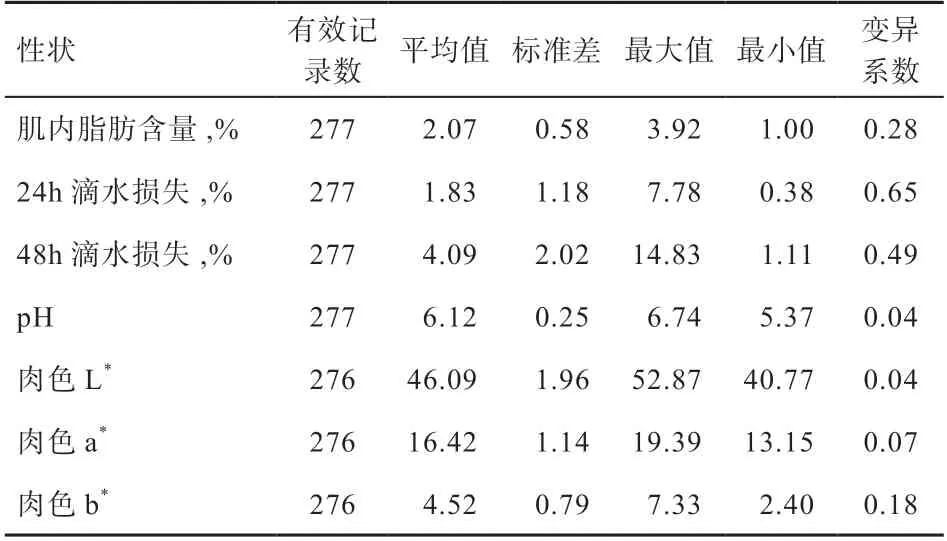
表3 肉质性状的基本描述性统计
生长性状的测定结果如表4 所示,日增重的平均值为0.60,标准差为0.06,最大值为0.76,最小值为0.46,变异系数为0.10。

表4 肉质性状的基本描述性统计
2.3 吞噬积的遗传参数估计 吞噬积遗传力的估计值如表5 所示,遗传力为0.13,加性遗传方差为0.47,表型方差为3.55,标准误为0.12,属于低遗传力。
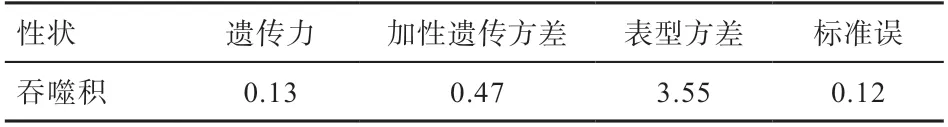
表5 吞噬积遗传力估计值
2.4 吞噬积与不同性状的相关性分析 大白猪吞噬积与胴体性状间的表型相关和遗传相关见表6,表型相关的范围为-0.22~0.015,其中吞噬积与胴体重表型相关为-0.15(<0.05),与胸腰长表型相关为-0.22(<0.01);遗传相关的范围为-0.82~0.047,绝大部分都呈负遗传相关。
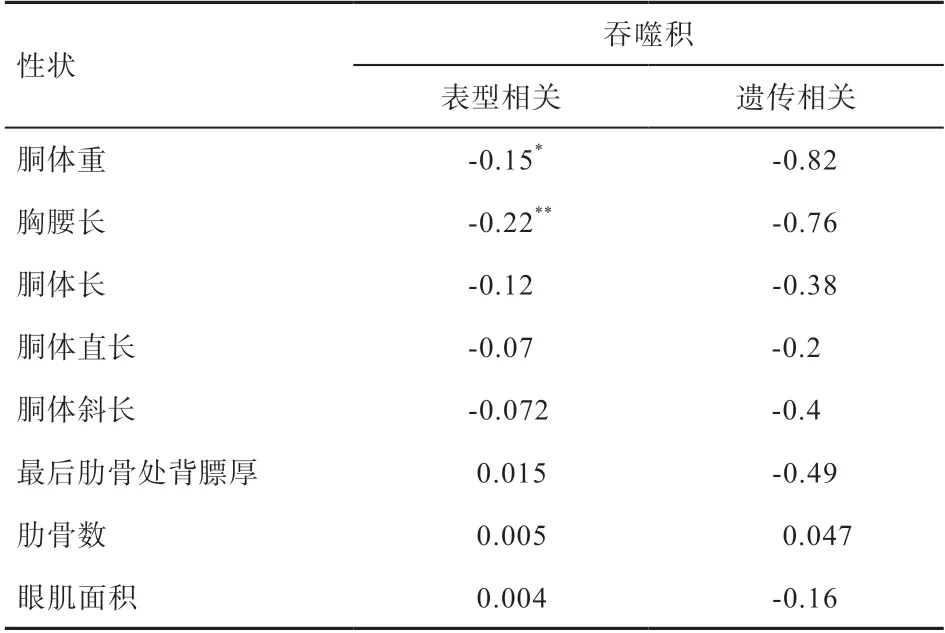
表6 吞噬积与胴体性状间的表型相关和遗传相关
由表7 可知,吞噬积与肉质性状间的表型相关的范围为-0.08~0.038(>0.05);遗传相关的范围为-0.87~0.3,大部分表型相关和遗传相关都呈负相关。

表7 吞噬积与肉质性状间的表型相关和遗传相关
如表8 所示,吞噬积与日增重的表型相关为-0.047(>0.05),遗传相关为0.21。
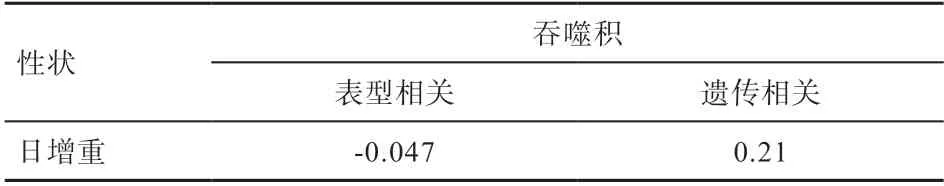
表8 吞噬积与日增重间的表型相关和遗传相关
3 讨 论
在猪育种中纳入与健康相关的性状或遗传标记,可能有助于培育出更具抗病能力的品种。先天免疫系统是宿主抵御感染性病原体的第一道防线,血液学性状和应激参数也是家畜生理健康状况的重要指标。在过去的几年里,一些研究已经报道了猪的某些免疫和血液学性状具有中到高的遗传力,表明这些性状的表型变异有重要的遗传贡献。
在不同研究中,对抗病性状遗传力估计值也不同,有些抗病性状属于低遗传力,而有些抗病性状具有中高遗传力。麻慧利用单性状动物模型估计矮小鸡外周血单核细胞吞噬积的遗传力为0.31±0.06,加性遗传方差为0.46,表型方差为1.50,残差方差为1.03,指出应用单核/ 巨噬细胞吞噬能力作为抗病育种的选育指标从而培育抗病品系成为可能。欧阳解秀用MTDFREML 法求得大白猪和中畜黑猪中性粒细胞吞噬力的遗传力分别为0.422 和0.385。Ballester 等估计杜洛克血液单核细胞遗传力为0.767,但与吞噬作用相关的表型属于低到中等遗传力,在0.118~0.495。本实验中估计猪外周血单核/巨噬细胞吞噬积的遗传力为0.13,相比与其他研究较低,可能是由于采样限制,实验个体较少,对吞噬积遗传力估计误差较大。
与生产性状研究相比,生猪抗病性状的研究较少。由于抗病力的研究较为复杂,抗病力与生产性状的关系还不是十分清楚,相关报道结果也有所差异,有的研究表明抗病性能与生产性能呈负相关,而另一些研究表明选育抗病性能不会降低生产性能。如原一桐测定了不同周龄高吞噬积个体和低吞噬积个体的体重和胫长,结果显示它们之间并没有显著差异,对吞噬积的选择并未影响个体的体型和发育;但高吞噬积个体产蛋初期的产蛋率和平均蛋重比低吞噬积个体小,对于卵泡发育和排卵能力,低吞噬积个体也强于高吞噬积个体;在繁殖性能方面,低吞噬积个体孵化率和受精率显著高于高吞噬积个体,表明某些抗病性能与生产性能呈负相关。麻慧对单核/ 巨噬细胞吞噬能力的选育,发现高吞噬能力个体的后代抗病力强,不会降低个体增重,可以提高母鸡的孵化性能和后代的健雏率。有研究表明,减少疾病给动物造成的损失后,也能提高其生产性能。Mallard等通过选育得到了高和低两种免疫应答品系的猪,发现高免疫应答品系的猪增重率显著高于低免疫应答品系和对照组,能较早达到上市体重。刘榜等研究了161 头猪部分免疫指标和生产性状间的关系,得到免疫指标与肉质性状呈有利相关,而与生长性状和胴体性状呈不利相关。魏国生等测定结果显示哈白、杜洛克猪的生产性状和免疫性状相关较小。本研究分析大白猪吞噬积与胴体性状和肉质性状的表型相关,结果表明性状间相关较小,与上述的研究结果相似。
平衡好抗病性能和生产性能需知道两者间的遗传关系。Wilkie等分析猪易感疾病和生产性状的遗传相关,结果显示它们并没有显著的相关,但是患病的个体具有生长速度慢,体型偏小和眼肌面积减小的趋势。欧阳解秀对312 头大白猪的免疫指标与生产性状做了相关性分析,得到两性状遗传相关较小,范围在-0.22~0.239,遗传相关与表型相关接近,说明遗传因素对表型值贡献较大,所以对免疫性能的选择不会对生产性状产生大的影响。与之前研究结果不同,本研究表明吞噬积与胴体性状和肉质性状中某些指标呈现较高的负遗传相关,遗传相关与表型相关相差较大,分析原因可能是由于计算模型导致。
4 结 论
本研究采用MTT-HCT-8 法检测大白猪单核/巨噬细胞的吞噬积,使用DMU 软件单性状模型估计其遗传力为0.13,为低遗传力;吞噬积与胴体性状、肉质性状的指标表型相关较弱,遗传相关较强,大多呈负相关,遗传相关与表型相关相差较大。

