基于EST-SSR标记的花楸树和少叶花楸杂交F1代群体的杂种鉴定及遗传关系分析
谷艳鹏,张泽人,孙 涛,韩庆军,栗宁宁,鲁仪增,窦德泉,①,郑 健,①
(1.北京农学院园林学院,北京 102206;2.山东省林草种质资源中心,山东 济南 250102)
种间杂交可以将不同亲本的优良性状集中到杂交子代[1],是获得具有丰富表型变异及高抗性优良杂种的有效途径[2,3]。大部分植物从人工授粉、杂交子代繁育、良种选育到产业化研究和应用,均需经过漫长的时间,制约了植物杂交育种和新品种选育的效率和进程。杂交子代早期鉴定能够缩短育种年限,加快育种进程[4],因而杂种鉴定是杂交育种进程中十分重要的步骤[5,6]。传统的杂种鉴定主要依赖于植株的外部形态特征,例如株高、叶片形状和大小、花形和花色、果形和果色、生长习性等,但是植株的发育状况及外部环境因子均可能会影响杂种鉴定的准确性[7]。随着分子生物学技术的发展,分子标记技术已被广泛应用于植物的杂种鉴定。SSR(simple sequence repeat)标记技术是杂种鉴定中最常用的分子标记技术之一,已应用于梅树(PrunusmumeSieb.et Zucc.)[8]、紫薇(LagerstroemiaindicaLinn.)[9]和青榨槭(AcerdavidiiFranch.)[10]等园林植物以及大豆〔Glycinemax(Linn.)Merr.〕[11]、落花生(ArachishypogaeaLinn.)[12]、糯玉米(Zeamaysvar.ceratinaKulesh)[13]和甘薯〔Ipomoeabatatas(Linn.)Lam.〕[14]等农作物的杂种鉴定和遗传多样性分析工作。
花楸树〔Sorbuspohuashanensis(Hance)Hedl.〕和少叶花楸〔S.hupehensisvar.paucijuga(D.K.Zang et P.C.Huang)L.T.Lu〕均为蔷薇科(Rosaceae)花楸属(SorbusLinn.)落叶乔木。花楸树的叶、花和果观赏价值均较高,其体内富含蛋白质、可溶性糖、黄酮类和酚类等多种成分[15-17],应用前景广阔。然而,由于野生花楸树原分布于中国北方海拔900~2 500 m的区域,在低海拔区域栽培时易受到夏季高温胁迫[18],导致植株在越夏时叶片出现“日灼”现象,目前已从分子层面对花楸树响应高温胁迫及叶片“日灼”机制开展了系列研究[19-21]。少叶花楸为山东特有的濒危树种[22],生于海拔300~1 000 m的山坡沟边及林缘,在低海拔区域生长良好,并表现出较强的耐热性,目前针对少叶花楸的研究主要集中在地理分布[23]、形态特征[24]、光合特性[25]、染色体核型[26]等方面。通过杂交育种的方法,将少叶花楸的耐热特性引入花楸树,可提高花楸树的耐热性能,这对选育耐热或适应低海拔地区种植的花楸树新品种有重要意义。
为此,作者采用实生苗杂交育种方法,对花楸树和少叶花楸进行种间杂交,并利用EST-SSR标记技术对杂交F1代群体进行杂种鉴定及遗传多样性和遗传关系分析,以期筛选出适宜于花楸树和少叶花楸杂交后代早期杂种鉴定的分子标记,进而为花楸属植物遗传图谱构建以及耐热品种中耐热基因的QTL定位提供基础研究资料。
1 材料和方法
1.1 材料
以花楸树为母本(SP)、少叶花楸(SH)为父本,于2020年4月采用常规人工控制授粉方法进行杂交;同年10月采集果实,经种实调制后获得纯净、饱满的杂交种子;同年11月将获得的杂交种子经低温春化处理后,于2021年1月在温室播种于装有育苗基质〔V(草炭)∶V(蛭石)=3∶1〕的营养钵(直径12 cm、高12 cm)中;2021年4月将幼苗移栽至花盆(直径27.5 cm、高31 cm)中,统一水肥管理。有22株子代在育苗过程中死亡,最终获得184株成活的杂交F1代植株(编号为PH1至PH184),栽植于北京农学院花楸种质资源圃中。
1.2 方法
1.2.1 基因组DNA的提取及检测 于2021年4月采集杂交亲本及子代幼嫩叶片(每株约100 mg),利用新型快速植物基因组DNA提取(离心柱型)试剂盒(型号DP3112,北京百泰克生物技术有限公司)提取每个单株叶片基因组DNA;用质量分数1%的琼脂糖凝胶电泳检测DNA质量,并置于-20 ℃冰箱中保存、备用。
1.2.2 引物筛选 使用本课题组开发的55对EST-SSR引物[27],委托北京睿博兴科生物技术有限公司,在正向引物的5′端分别添加HEX、FAM、TAMRA和ROX荧光染料接头,合成荧光引物。以2个亲本及随机选取的4株F1代单株的基因组DNA为模板进行引物筛选。
使用S1000 PCR仪(美国Bio-Rad公司)进行PCR扩增。扩增体系总体积25.0 μL,包含2×TaqPCR MasterMix(北京爱博森生物科技有限公司)12.5 μL、100.0 ng·μL-1基因组DNA 0.5 μL以及10.0 μmol·L-1正向和反向引物各1.0 μL,并用无菌双蒸水补足体积。扩增程序为:95 ℃预变性5 min;95 ℃变性30 s、相应温度退火30 s、72 ℃延伸45 s,30个循环;最后于72 ℃延伸7 min。
用ABI 3730xl DNA分析仪(美国Applied Biosystems公司)对扩增产物进行毛细管电泳。取1.0 μL 扩增产物,加入8.5 μL去离子甲酰胺和0.5 μL Liz-500分子量内标,依次于95 ℃变性5 min、4 ℃保温10 min后,于4 ℃条件下3 000 r·min-1离心1 min后进行毛细管电泳分析;毛细管电泳条件为13 kV预电泳3 min;1.5 kV进样10 s;10 kV电泳40 min。根据毛细管电泳结果筛选出9对在亲本中具有多态性的特异性EST-SSR引物用于杂种鉴定。各引物的基本信息见表1。

表1 用于花楸树和少叶花楸杂交F1代群体EST-SSR标记分析的9对多态性引物信息
1.2.3 杂种鉴定 以184株杂交F1代单株的基因组DNA为模板,按照前述扩增体系和程序进行PCR扩增和毛细管电泳。对扩增结果进行分析,具有双亲特异位点的杂交后代为真杂种,而双亲位点缺失的杂交后代则需进行重复验证。
1.3 数据统计分析
使用GeneMarker 2.2.0软件对毛细管电泳数据进行统计分析,将每个峰值的位置与泳道中的GeneScan500LIZ分子质量内标进行比较,读取扩增片段长度,记录等位基因。
使用POPGENE 32软件计算杂交F1代群体的观测等位基因数、有效等位基因数、Shannon’s信息指数、期望杂合度、观测杂合度和遗传距离;使用CERVUS 3.0软件统计每个EST-SSR位点的多态性信息含量;基于遗传距离,使用MEGA 7.0软件对双亲和杂交F1代群体进行UPGMA聚类分析。
用a、b、c、d对不同等位基因进行标记,利用SPSS 26.0软件中的卡方(χ2)拟合优度检验对杂交F1代群体的基因型分离情况进行分析[28],以确定基因型分离情况与孟德尔分离定律的符合程度。
2 结果和分析
2.1 杂交F1代单株的杂种鉴定结果
根据9对EST-SSR引物的扩增结果获得花楸树和少叶花楸及其杂交F1代的基因型。在184株F1代单株中,有9株F1代单株分别在3~7个位点上出现异常基因型,占F1代单株总数的4.9%;有175株单株在9个EST-SSR位点上均扩增出双亲条带,这些单株均可认为是真杂种后代,杂种率达95.1%。
由9对EST-SSR引物在亲本和9株异常F1代单株中的扩增结果(表2)可见:在出现异常基因型的F1代单株中,PH1有6个位点出现母本或父本条带的缺失,其中3个位点扩增出新条带;PH4有6个位点出现母本或父本条带缺失,其中3个位点扩增出新条带;PH6有5个位点出现母本或父本条带缺失,除sors51外,另4个位点均扩增出新条带;PH7有4个位点出现母本或父本条带缺失,其中2个位点扩增出新条带;PH8有3个位点出现母本条带缺失,其中2个位点扩增出新条带;PH9有4个位点出现母本或父本条带缺失,其中2个位点扩增出新条带;PH10有7个位点出现母本或父本条带缺失,除sors51位点外,其他6个位点均扩增出新条带;PH19有6个位点出现母本或父本条带缺失,这6个位点均扩增出新条带;PH26有6个位点出现母本或父本条带缺失,除sors51位点外,其他5个位点均扩增出新条带。
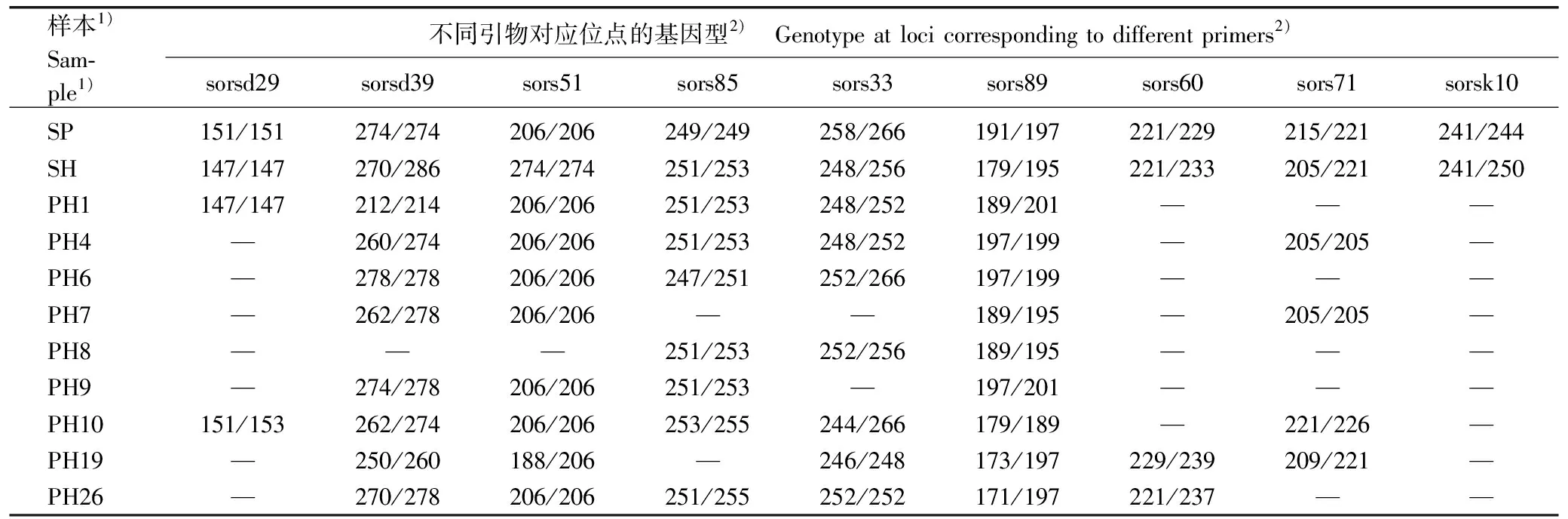
表2 9对EST-SSR引物在亲本及9株异常F1代中的扩增结果
2.2 杂交F1代中真杂种单株的基因分离规律
依据9对EST-SSR引物的扩增结果对花楸树和少叶花楸杂交F1代175株真杂种的基因分离规律进行分析,结果见表3。
由表3可见:引物sorsd29在亲本中的扩增结果为aa×bb型,即纯合互补型;引物sorsd39、sors51和sors85在亲本中的扩增结果为aa×bc型,即父本型;引物sors33和sors89在亲本中的扩增结果为ab×cd型,即双亲互补型;引物sors60、sors71和sorsk10在亲本中的扩增结果为ab×ac型,即杂合互补型[28]。
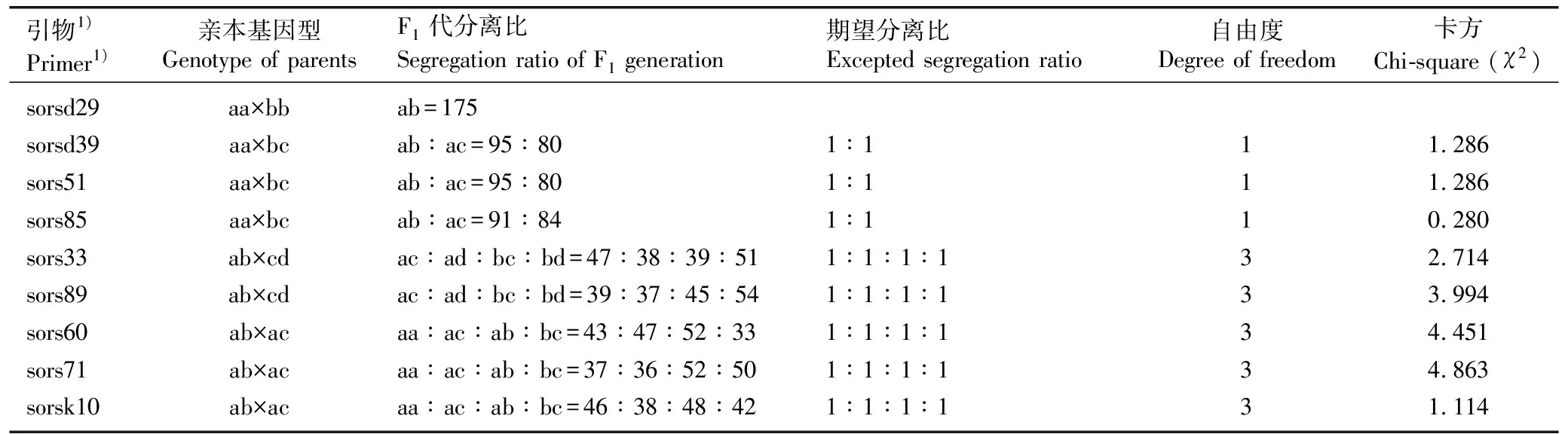
表3 基于9对EST-SSR引物扩增结果的花楸树和少叶花楸杂交F1代中175株真杂种的基因分离规律
由表3还可见:由于引物sorsd29在亲本中的扩增结果为纯合互补型,因而,其F1代175株真杂种均未出现基因分离现象,基因型均为ab型。另8对引物在这175株F1代真杂种中的扩增结果均出现基因分离现象,其中,引物sorsd39、sors51和sors85在F1代中的扩增结果呈现2种基因型,即ab和ac,分离比略有不同,但均接近1∶1,经χ2检验,与期望分离比无显著(P>0.05)差异;引物sors33和sors89在F1代中的扩增结果呈现4种基因型,即ac、ad、bc和bd;引物sors60、sors71和sorsk10在F1代中的扩增结果也呈现4种基因型,即aa、ac、ab和bc,这5对引物扩增结果呈现的4种基因型在F1代群体中的分离比存在一定差异,但经χ2检验,与期望分离比(1∶1∶1∶1)均无显著差异,表明在花楸树和少叶花楸的杂交F1代中,上述8对EST-SSR引物对应位点的基因型均符合孟德尔分离定律。
2.3 杂交F1代中真杂种的遗传多样性
依据9对EST-SSR引物的扩增结果对花楸树和少叶花楸杂交F1代中175株真杂种的遗传多样性进行分析,结果见表4。
由表4可见:9个EST-SSR位点共包含28个等位基因,均值为3.1;有效等位基因数为2.0~4.0,均值为2.9;多态性信息含量和Shannon’s信息指数分别为0.375~0.705和0.693~1.386,均值分别为0.566和1.076;观测杂合度和期望杂合度分别为0.737~1.000和0.501~0.752,均值分别为0.920和0.640。总体上看,sors33和sors89 位点的各项遗传多样性指数均较大,sorsd29位点的各项遗传多样性指数均最小。
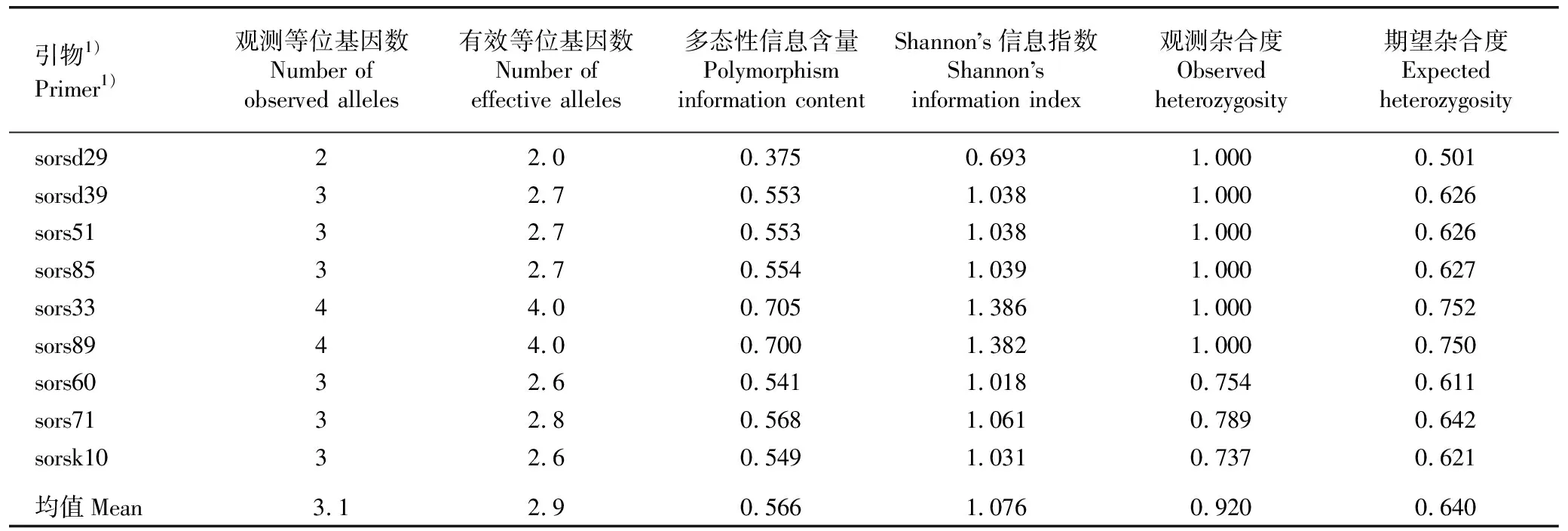
表4 基于9对EST-SSR引物扩增结果的花楸树和少叶花楸杂交F1代175株真杂种的遗传多样性
2.4 亲本与杂交F1代真杂种的聚类分析
依据花楸树和少叶花楸及其杂交F1代175株真杂种的Nei’s遗传距离,采用UPGMA法构建系统聚类图,结果见图1。
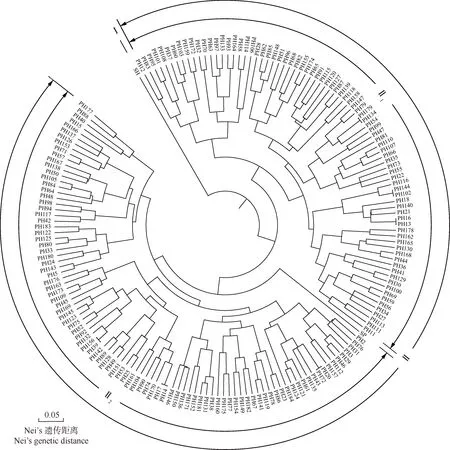
SP: 花楸树(母本)Sorbus pohuashanensis(Hance)Hedl.(female parent); SH: 少叶花楸(父本)S.hupehensis var.paucijuga(D.K.Zang et P.C.Huang)L.T.Lu(male parent); PH: 杂交F1代单株Hybrid individuals of F1 generation.
由图1可见:在Nei’s遗传距离0.28处,供试样本分为2组,其中少叶花楸单独为组Ⅰ,花楸树和175株F1代单株聚为组Ⅱ。在Nei’s遗传距离0.24处,组Ⅱ分为2个亚组,其中81株F1代单株聚为亚组Ⅱ1,占F1代真杂种总数的46.3%;另94株F1代单株与花楸树聚为亚组Ⅱ2,占F1代真杂种总数的53.7%。总体上看,175株F1代单株与花楸树有较近的遗传关系。
3 讨论和结论
在植物杂种鉴定方面,分子标记可从基因组水平上揭示杂交种与亲本之间的遗传差异,且不受环境条件和生长发育状况的影响,能够在幼苗早期进行鉴定[29]。本研究使用9对EST-SSR引物对花楸树和少叶花楸的184株杂交F1代进行了杂种鉴定,其中175株被鉴定为真杂种,杂种率达95.1%,其余9株单株的扩增结果中存在缺失双亲条带或出现新条带的现象,在F1代单株中出现新条带的原因可能有2个:一是在减数分裂过程中发生基因重组或突变[30],二是在花粉采集和去雄或人工授粉过程中出现花粉污染的情况。
当杂交群体受到选择、突变、遗传漂变等影响时,子代的基因型比例会偏离孟德尔遗传定律,这种现象被称为偏分离[31];基因偏分离现象会影响标记间的重组率,从而影响植物的遗传作图[32]。周宁宁等[33]对月季(RosachinensisJacq.)杂交F1代基因型的分离情况进行了分析,发现在20个SSR标记中有9个标记产生了偏分离;汪国云等[34]对杨梅(MyricarubraSieb.et Zucc.)杂交群体的研究结果表明,8个SSR标记中有2个标记产生了偏分离。本研究中,除9株F1代单株出现异常基因型外,175株杂交F1代真杂种中有8个位点的分离比符合孟德尔分离定律,未发生显著的杂种偏分离现象,说明亲本间的基因兼容性较高[35],也进一步支持了“在花楸属种类中花楸树与少叶花楸的遗传距离相对较近”[36]的研究结果。然而,花楸树与少叶花楸在分布区域、生长习性、表型性状(特别是小叶数量)及抗热性上有较大差异,通过种间杂交可以选育综合双亲优良性状的杂种后代。此外,本研究中所有的标记均未发生偏分离,进一步表明所选的9对EST-SSR引物均可用于构建花楸树与少叶花楸杂交F1群体的遗传图谱。
SSR标记具有数量大、多态性高、共显性、可靠性高和多等位基因检测等优点[37]。本研究使用的9对EST-SSR引物在175株F1代真杂种中共扩增出28个等位基因,平均每个位点3.1个等位基因,平均有效等位基因数为2.9。多态性信息含量是评价引物的多态性的重要指标,多态性信息含量大于0.50,说明引物的多态性水平高;多态性信息含量小于0.25,则说明引物的多态性水平低[38]。本研究中,9对EST-SSR引物的平均多态性信息含量为0.566,除引物sorsd29的多态性信息含量小于0.5外,其他8对EST-SSR引物的多态性信息含量均大于0.5,表明本研究筛选出来的EST-SSR引物具有较高的多态性。
SSR标记多用于植物天然群体遗传多样性分析[39,40],但在人工杂交群体的遗传多样性研究中应用尚不广泛,目前已应用于茶树〔Camelliasinensis(Linn.)O.Ktze.〕[41]、牡丹(Paeonia×suffruticosaAndr.)[42]和紫薇[43]等栽培植物的杂交群体遗传多样性研究和遗传变异分析。本研究采用EST-SSR标记研究了花楸树和少叶花楸杂交F1代群体的遗传多样性参数,结果显示该杂交F1代群体的Shannon’s信息指数、观测杂合度和期望杂合度等遗传多样性参数均略高于茶树、牡丹和紫薇等树种的杂交F1代群体,表明花楸树和少叶花楸的杂交F1代群体遗传变异显著、遗传多样性丰富,说明EST-SSR标记可应用于花楸属种类杂交后代群体的遗传多样性研究和杂种鉴定。
花楸树和少叶花楸杂交F1代真杂种群体具有丰富的遗传变异,但聚类分析结果显示F1代群体与母本聚为一组,而父本则独立成组,说明花楸树和少叶花楸杂交F1代真杂种群体与母本的遗传关系较近,这一现象也存在于甘蔗(Saccharumspp.)和蔗茅(ErianthusfluvusNess)[44]、枣(ZiziphusjujubaMill.)和酸枣(Z.acidojujubaCheng et Liu)[45]以及菊花脑(ChrysanthemumnankingenseHand.-Mazt.)和甘菊〔C.lavandulifolium(Fisch.ex Trautv.)Makino〕[46]的杂交F1代群体与亲本的遗传关系中。这一现象一方面可能与亲本的遗传物质传递直接相关,另一方面也与所用引物数量及引物特征间接相关[45]。虽然本研究使用的9个EST-SSR标记能鉴定出花楸树和少叶花楸杂交F1代的真杂种,并分析其遗传多样性,但是总体来看,使用的EST-SSR标记数量相对较少,且并未发现这9个标记与叶片“日灼”现象有关,故本研究中所有F1代单株与母本聚为一类,并不能确定这些F1代单株是否与母本同样表现出在越夏时叶片出现“日灼”现象,因此,后续需对这些杂交F1代群体的表型性状变异进行深入研究,特别是叶片“日灼”等与抗热性有关的性状,或者开发与抗热性状相关联的EST-SSR标记。
总之,本研究以花楸树为母本、少叶花楸为父本,成功进行了种间杂交并获得了175个杂种单株构成的杂交F1代群体,且杂交群体具有丰富的遗传多样性。筛选出的9对EST-SSR引物多态性较高,且在杂交群体中未出现明显偏分离,可用于后续遗传图谱的构建及QTL定位。
——致秋天的花楸树

