南方红豆杉内生真菌多样性及内生真菌对紫杉醇和中间产物含量的影响
徐玲霞,柳 巧,王景仪,董蒙蒙,蒋继宏, 曹小迎
(江苏师范大学生命科学学院 江苏省药用植物生物技术重点实验室,江苏 徐州 221116)
红豆杉属(TaxusLinn.)植物为常绿乔木或灌木,全世界共有11种,中国有4种1变种1杂交种,即红豆杉〔T.chinensis(Pilger)Rehd.〕、东北红豆杉(T.cuspidataSieb.et Zucc.)、西藏红豆杉(T.wallichianaZucc.)、云南红豆杉(T.yunnanensisW.C.Cheng et L.K.Fu)、南方红豆杉〔T.wallichianavar.mairei(Lemée et H.Lév.)L.K.Fu et N.Li〕和曼地亚红豆杉(T.×mediaRehd.)[1]。红豆杉(Taxussp.)是珍贵的用材树种,不但具有较高的观赏价值,还具有很高的药用价值[2,3]。红豆杉中的紫杉醇是一种抗癌活性成分,能够有效抑制癌细胞的生长和繁殖[4]。然而,在自然条件下红豆杉生长缓慢,体内的紫杉醇和中间产物〔如巴卡亭Ⅲ和10-去乙酰基巴卡亭Ⅲ(10-DAB)[5]〕的含量均极低,因此,利用现代生物技术手段提高红豆杉体内紫杉醇和中间产物含量具有重要意义。
研究发现,植物体内存在丰富的内生菌资源[6-8],这些内生菌能够促进宿主植物生长,与宿主植物和谐共生、协同进化[9,10]。部分内生菌可产生一些特殊的生物活性成分[11],这些生物活性成分可以成为内生菌诱导子[12]。植物的细胞膜或细胞质中含有可识别内生菌诱导子的受体,当受体与内生菌诱导子结合后,植物细胞中的受体激酶被激活,从而改变下游基因的表达,产生特定的次生代谢产物[13],因此,内生菌诱导子对宿主植物的生长发育和次生代谢产物积累具有一定的促进作用[14-16]。例如:内生真菌AL4的粗诱导子对茅苍术〔Atractylodeslancea(Thunb.)DC.〕悬浮细胞中的挥发油成分苍术酮、苍术醇、β-桉叶醇和苍术素的积累均有一定的促进作用[17];Hemmati等[18]从长春花〔Catharanthusroseus(Linn.)G.Don〕品种‘冰粉’(‘Icy Pink’)中分离到2株内生真菌,这2株内生真菌既可以促进长春花愈伤组织的生长,还可以提高长春花愈伤组织中次生代谢产物秋水仙碱和长春碱的含量。
南方红豆杉为国家一级重点保护野生植物,主要分布于长江流域以南地区,在多数省份常生于海拔1 000~1 200 m以下的山林中。目前,关于南方红豆杉内生真菌的多样性、群落结构、促生能力及产紫杉醇能力等的研究报道较多[19-23],而关于南方红豆杉内生真菌对南方红豆杉体内紫杉醇等药效成分的合成和积累的影响尚不清楚。为此,本研究利用不同分离培养基从南方红豆杉的根、枝和叶中分离内生真菌,并对这些内生真菌进行了分子鉴定;随后,将这些内生真菌制成诱导子并均匀喷洒到3年生南方红豆杉植株上,采用HPLC技术分析不同内生真菌处理组南方红豆杉叶中紫杉醇、巴卡亭Ⅲ和10-DAB的含量差异,以期为使用内生真菌调控南方红豆杉药效成分的积累提供研究基础。
1 材料和方法
1.1 材料
选取湖北星斗山国家级自然保护区(东经109°00′06″、北纬29°59′49″)内5株健康的野生南方红豆杉植株,利用样株上的新鲜根、枝和叶分离内生真菌。采集样株周围0~5 cm土层中的侧根;在样株冠层的高、中、低位置各随机采1个枝条,并将枝和叶分开。将采摘的根、枝和叶分别蜡封于自封袋内,放入液氮中带回实验室立即进行实验。
内生真菌诱导子处理的样株为3年生南方红豆杉植株,盆栽于江苏师范大学生命科学学院重点实验室温室中。栽培基质为原生态土壤(由江苏省无锡市红豆集团红豆杉生物技术有限公司提供)和营养土(由棉籽壳、玉米芯、米糠、豆粕、麦麸、珍珠岩经高温发酵、消毒、杀虫加工制作而成)等质量比混合基质,培养条件为温度22 ℃、空气相对湿度60%~80%、光照时间16 h·d-1、光照度6 000 lx。
1.2 方法
1.2.1 内生真菌的分离、纯化和保种 用流水将采集的南方红豆杉根、枝和叶冲洗2 h,室温条件下超声(功率500 W)清洗3次,每次2~3 min;参照臧威等[21]的方法对根、枝和叶进行消毒。将最后一次冲洗根、枝和叶的无菌蒸馏水分别涂布在察氏培养基、马丁培养基、PDA培养基、Wickerham培养基和沙氏培养基5种分离培养基上,置于28 ℃条件下暗培养7 d。若无菌落长出,说明消毒效果较好,可认定分离的真菌均来自南方红豆杉体内。将消毒过的根、枝和叶置于无菌研钵中研磨,将磨好的粉末分别涂布在前述的5种分离培养基上,每个器官每种培养基10个平板,置于28 ℃条件下暗培养14 d。
待菌落长出后,将每个菌落分别接种到新的纯化培养基(PDA培养基)中,置于28 ℃条件下暗培养。经过反复纯化,直至形成单个菌落,即纯化的内生真菌菌株。
根据菌落形态和颜色去除重复菌株,取面积约5 mm×5 mm的菌块,接种到PDA斜面培养基中,置于4 ℃冰箱中保种。
1.2.2 内生真菌的分子鉴定 取面积约5 mm×5 mm的内生真菌保种菌块,接种到PDA固体培养基中,置于28 ℃条件下暗培养。培养5 d后记录菌落的生长情况,如菌落的形状、大小、颜色、菌丝致密程度和色素产生情况等。
将菌体收集到1.5 mL离心管中,置于-20 ℃冰箱中冷冻30 min;加入200 μL质量体积分数2%的CTAB和适量石英砂,置于65 ℃水浴中保温30 min;加入苯酚-三氯甲烷混合液〔V(苯酚)∶V(三氯甲烷)=2∶1〕200 μL,震荡2 min后,室温条件下10 000 r·min-1离心10 min;取上清,加入等体积异丙醇后,置于-20 ℃冰箱中冷冻30 min;室温条件下10 000 r·min-1离心10 min,去上清;加入体积分数70%乙醇200 μL并吹打数次;室温条件下10 000 r·min-1离心10 min,弃乙醇,沉淀自然风干后加入30 μL无菌蒸馏水,即内生真菌基因组DNA粗提液,置于-20 ℃冰箱中保存。
将内生真菌基因组DNA粗提液涡旋震荡30 min后,用无菌蒸馏水稀释5~10倍;使用通用引物NL1(序列为5′-GCATATCAATAGCGGAGGAAAAG-3′)和NL4(序列为5′-GGTCCGTGTTTCAAGACGG-3′)进行扩增反应。反应体系总体积30.0 μL,包括PremixTaqTMVersion 2.0〔宝生物工程(大连)有限公司〕15.0 μL、引物NL1 0.5 μL、引物NL4 0.5 μL、基因组DNA粗提液1.0 μL,ddH2O补足剩余体积。反应程序为:95 ℃预变性3 min;95 ℃变性20 s、55 ℃退火20 s、72 ℃延伸1 min,共35个循环;72 ℃延伸5 min。使用质量体积分数1%琼脂糖凝胶电泳检测扩增产物,并将扩增产物交生工生物工程(上海)股份有限公司测序。将测序结果与NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)中的相关菌株序列进行比对,从而确定各内生真菌菌株的种类。
1.2.3 内生真菌诱导子溶液的制备及处理方法 将纯化的内生真菌接种到PDA培养基上,置于28 ℃条件下暗培养;菌株活化后,取面积约5 mm×5 mm菌块,接种到装有PDB培养基的锥形瓶中,于28 ℃黑暗条件下200 r·min-1震荡培养7 d;用无菌滤纸过滤,滤液即内生真菌诱导子溶液。
用小喷壶将内生真菌诱导子溶液均匀喷洒在南方红豆杉植株上,每株喷洒内生真菌诱导子溶液40 mL。对照组仅喷洒等体积的无菌蒸馏水。每组3株南方红豆杉植株。处理7 d后,剪取植株从上往下第4和第5个枝上的所有叶,置于-80 ℃冰箱中保存、待用。
1.2.4 紫杉醇和中间产物含量的测定
1.2.4.1 标准品溶液的制备 称取购自美国Sigma公司的紫杉醇(纯度在97%及以上)、巴卡亭Ⅲ(纯度在99%及以上)、10-DAB(纯度在99%及以上)标准品各1 mg,精密称量后,分别使用甲醇(色谱纯)配制成质量浓度1 mg·mL-1的标准品溶液,置于4 ℃冰箱中保存、待用。
1.2.4.2 样品溶液的制备 取南方红豆杉的叶,使用RV8冷冻干燥机(英国EDWAROS)冷冻干燥后研磨成粉末;精密称取1.0 g叶粉末,置于50 mL离心管中,按照料液比(m∶V)1∶20添加酸化甲醇溶液(含体积分数0.01%乙酸的甲醇溶液),室温条件下超声(功率500 W)处理1 h;用双层滤纸过滤,保留滤液,滤渣重复提取2次;合并滤液,用SB-1100旋转蒸发仪(上海爱朗仪器有限公司)在低于40 ℃的条件下进行减压蒸干;用甲醇将析出物溶解并定容至1 mL,室温条件下超声(功率500 W)处理30 min;室温条件下10 000 r·min-1离心10 min,取上清液,用孔径0.45 μm的有机相滤膜过滤,滤液即样品溶液。
1.2.4.3 HPLC分析条件 采用Aglient 1260高效液相色谱仪(美国Agilent公司)进行HPLC分析。色谱柱为Hypersil ODS2色谱柱(4.6 mm×250 mm,5 μm,美国Thermo Fisher公司)。以乙腈(色谱纯)为流动相A、体积分数0.1%甲酸溶液为流动相B进行线性梯度洗脱,洗脱程序为:0 min,5%A;25 min,100%A;30 min,100%A;35 min,5%A。流速1.0 mL·min-1;柱温25 ℃;检测波长227 nm;进样量10 μL。
每个处理组随机选取1株植株的样品溶液,按照上述分析条件进样检测。选取紫杉醇含量最高的内生真菌处理组,利用该处理组和对照组各3个样品溶液的检测结果进行验证。
1.3 数据处理及统计分析
采用EXCEL 2007软件对相关数据进行统计和分析。
2 结果和分析
2.1 南方红豆杉不同器官内生真菌多样性分析
统计结果(表1)表明:本研究从南方红豆杉的根、枝和叶中共分离到69株内生真菌。其中,叶中内生真菌菌株数量最多,有46株,占分离的内生真菌菌株总数的66.7%;枝中内生真菌的菌株数量次之,有14株,占分离的内生真菌菌株总数的20.3%;根中内生真菌的菌株数量最少,仅9株,占分离的内生真菌菌株总数的13.0%。

表1 南方红豆杉根、枝和叶中内生真菌的菌株数量
鉴定结果表明:分离到的69株内生真菌隶属于26属36种,在这些内生真菌中,ConiothyriumCorda、MuyocopronSpeg.和PhyllostictaPers.3个属的菌株数量较多。其中,Muyocopron属的菌株数量最多,有15株,占分离的内生真菌菌株总数的21.7%,远高于其他属菌株数量,说明该属为南方红豆杉内生真菌的优势属。值得注意的是,不同种类内生真菌在南方红豆杉根、枝和叶中的分布存在明显差异,许多内生真菌仅局限于南方红豆杉的特定器官中,如AlternariaNees和ColletotrichumCorda属菌株仅分布在南方红豆杉的叶中,AporosporaJ.C.Krug et Jeng 属菌株仅分布在南方红豆杉的枝中,而ClonostachysCorda属菌株仅分布在南方红豆杉的根中。Muyocopronatromaculans(Bills et Polishook)Hern.-Restr., J.D.P.Bezerra et Crous菌株在南方红豆杉的枝和叶中分别有4和11株,为南方红豆杉枝和叶中最常见的内生真菌,而FusariumoxysporumSchltdl.和Talaromycesverruculosus(Peyronel)Samson, N.Yilmaz, Frisvad et Seifert菌株在南方红豆杉的根中均有2株,为南方红豆杉根中最常见的内生真菌。
2.2 内生真菌对南方红豆杉叶中紫杉醇及中间产物含量的影响
经HPLC检测分析,在19种内生真菌处理组的南方红豆杉叶中可同时检测到紫杉醇及中间产物巴卡亭Ⅲ和10-DAB。统计结果(表2)表明:在检测到紫杉醇的19个内生真菌处理组中,南方红豆杉叶中巴卡亭Ⅲ和10-DAB的含量均低于对照组(未喷洒内生真菌诱导子溶液);Coniochaetahoffmannii(J.F.H.Beyma)Z.U.Khan, Gené et Guarro、GlomerellaacutataGuerber et J.C.Correll、Gymnopilusluteofolius(Peck)Singer、NeopestalotiopsisaotearoaMaharachch., K.D.Hyde et Crous、ParaconiothyriumarchidendriVerkley, Göker et Stielow、Paraconiothyriumfuscomaculans(Sacc.)Verkley et Gruyter、Phyllostictafoliorum(Sacc.)Wikee et Crous、Phyllostictaphiloprina(Berk.et M.A.Curtis)Wikee et Crous、PseudodidymocyrtislobariellaeFlakus, Rodr.Flakus et Etayo和TrichodermacaribbaeumSamuels et Schroers处理组南方红豆杉叶中的紫杉醇含量均高于对照组,其余9个内生真菌处理组南方红豆杉叶中的紫杉醇含量均低于对照组。在紫杉醇含量高于对照组的10个内生真菌处理组中,P.lobariellae处理组南方红豆杉叶中的紫杉醇含量较对照组升高幅度最大,升高了286.44%,但该组的巴卡亭Ⅲ和10-DAB含量却较对照组明显下降,分别降低了89.21%和70.64%;G.luteofolius和C.hoffmannii处理组南方红豆杉叶中紫杉醇含量也明显高于对照组,分别升高了205.08%和135.59%,这2组的巴卡亭Ⅲ和10-DAB含量也较对照组明显下降。

表2 不同内生真菌处理组南方红豆杉叶中紫杉醇和中间产物的含量1)
为了验证上述结果的可信度,对内生真菌P.lobariellae处理组和对照组的南方红豆杉叶中紫杉醇及中间产物巴卡亭Ⅲ和10-DAB的含量进行了3次重复检测,结果见表3。由表3可见:经内生真菌P.lobariellae处理后,南方红豆杉叶中巴卡亭Ⅲ和10-DAB的含量确实较对照组下降,而紫杉醇含量却较对照组明显升高。
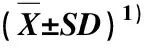
表3 内生真菌Pseudodidymocyrtis lobariellae Flakus, Rodr.Flakus et Etayo对南方红豆杉叶中紫杉醇和中间产物含量的影响
3 讨论和结论
内生真菌普遍存在于各种植物中,并且广泛分布于植物的各个组织中,但研究者在不同植物种类中分离到的内生真菌菌株数量和菌种数量均存在较大差异,少则十几种,多则近百种[8,21]。1993年,Stierle等[24]从短叶红豆杉(TaxusbrevifoliaNutt.)韧皮部中分离到第1个产紫杉醇的内生真菌TaxomycesandreanaeStrobel, A.Stierle, D.Stierle et W.M.Hess;迄今为止,研究者已经分离出大量的红豆杉内生真菌,并发现多种内生真菌能产生紫杉醇[25-28]。本研究从南方红豆杉中分离到的DiaporthediscoidisporaF.Huang, K.D.Hyde et Hong Y.Li、F.oxysporum、TrichodermatheobromicolaSamuels et H.C.Evans和Coniothyriumpyrinum(Sacc.)J.Sheld.会降低南方红豆杉叶中紫杉醇含量,而Trichodermacaribbaeum会提高南方红豆杉叶中紫杉醇含量。有研究者发现,红豆杉内生真菌可以促进植物体内紫杉醇的积累,如ChaetomiumglobosumKunze和ParaconiothyriumbrasilienseVerkley可促进欧洲榛(CorylusavellanaLinn.)细胞中紫杉醇的积累[29]。本研究结果表明:在南方红豆杉中分离到P.brasiliense的同属种类P.archidendri,且经该菌种处理后南方红豆杉叶中的紫杉醇含量高于对照组(未喷洒内生真菌诱导子溶液),据此推测P.archidendri可能具有促进紫杉醇积累的功能。红豆杉内生真菌还可促进紫杉醇合成过程中中间代谢物向终产物的转化,如从云南红豆杉中分离到的Microsphaeropsisonychiuri(Punith.)Morgan-Jones、Mucorsp.和Alternariaalternata(Fr.)Keissl.可以羟基化和环化2个紫杉烷类中间产物,生成下游代谢物[30]。然而,本研究虽然分离到A.alternata的同属种类A.doliconidiumJ.F.Li, Camporesi et K.D.Hyde,但是未在该菌种处理的南方红豆杉叶中检测到紫杉醇,推测该菌种可能抑制南方红豆杉叶中紫杉醇的合成,致使紫杉醇含量低于检测极限,从而无法检出。
本研究中,P.lobariellae处理组南方红豆杉叶中紫杉醇含量较对照组升高幅度最大,值得一提的是,该菌种是Flakus等[31]在地衣中首次分离并命名的一个新菌种,关于其生物功能尚未见研究报道,在后续研究中可对该菌种进行系统研究。G.luteofolius处理组南方红豆杉叶中的紫杉醇含量较对照组升高幅度仅次于P.lobariellae,该菌种也是近年来发现的新菌种,具有药品废物的生物降解功能[32]。C.hoffmannii处理组南方红豆杉叶中的紫杉醇含量较对照组升高幅度也较大,该菌种为丝状子囊菌,是一种兼性植物病原菌,可用于生产生物柴油[33]。与对照组相比,上述3种内生真菌处理组南方红豆杉叶中的10-DAB和巴卡亭Ⅲ含量明显降低,而紫杉醇含量却明显升高,说明这3种内生真菌能促进紫杉醇的生物合成,推测可能是这3种内生真菌的发酵液中含有某种活性因子,激发了紫杉醇生物合成过程中某些代谢酶的活性,催化巴卡亭Ⅲ和10-DAB转化为紫杉醇。
作者在实验过程中发现,将内生真菌诱导子溶液喷洒在南方红豆杉植株上7 d后,南方红豆杉的叶未出现明显的微生物侵染症状,这可能是因为内生真菌诱导子的处理时间较短,尚未发挥出明显效应。检测发现,经内生真菌诱导子溶液处理7 d后,在半数处理组南方红豆杉的叶中未检出紫杉醇,这可能是因为紫杉醇含量太低,超出了高效液相色谱仪的检测极限。重复验证结果显示:P.lobariellae处理组南方红豆杉叶中的紫杉醇含量虽然存在较大波动,但该组的紫杉醇含量与对照组间差异显著,再次证明P.lobariellae可提高南方红豆杉叶中的紫杉醇含量。
综合上述研究结果,南方红豆杉的内生真菌多样性较高,在其根、枝和叶中共分离到69株内生真菌,隶属于26属36种;其中10种内生真菌能够促进南方红豆杉叶中紫杉醇的合成,以P.lobariellae的促进作用最显著,G.luteofolius和C.hoffmannii的促进作用也较明显,这3种内生真菌可作为调控南方红豆杉紫杉醇积累的候选菌。

