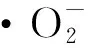Bi4O5Br2/Ti3C2-Ru复合光催化剂的合成及其对磺胺甲噁唑药物废水降解性能研究
张 雷,李 瑞,樊彩梅
(太原理工大学化学工程与技术学院,太原 030024)
0 引 言
近年来,半导体光催化技术作为一种新型的高级氧化技术,由于其低成本、低能耗、无二次污染等优点,在解决日益严重的环境和能源问题上展现了巨大的应用前景,特别在处理有机药物废水方面表现出了优异的光降解能力,被认为是最具发展前景的绿色环保技术之一[1]。其中非化学计量比溴氧铋光催化剂(BixOyBrz)由于其独特的二维层状结构和光生电子间接跃迁模式,使得其在本质属性上拥有相较于其他半导体更高的光生载流子分离效率,同时又兼具能带结构合适、化学稳定性较好及环境友好等优点,因此获得研究者的广泛关注[2-3]。如三峡大学Chen等[4]利用Bi4O5Br2在可见光下降解头孢哌酮钠,120 min内头孢哌酮钠去除率达到78%且降解产物毒性较低。然而在实际应用中,单一BixOyBrz光催化剂仍然存在表面光生电荷复合率较高的问题,严重限制了其在光催化降解有机药物废水中的应用[5]。因此,如何提升光生电荷的分离效率成为了目前研究人员的关注重点。
原位负载助催化剂可以在催化剂表面形成接触紧密且作用力较强的界面,从而为光生电荷的分离和转移提供新的路径,是提升半导体催化活性的一种常用改性手段[6]。同时通过在助催化剂表面原位沉积具有较大功函数的Pt、Pd、Ru等贵金属,不仅可以进一步促进电子由助催化剂向贵金属表面聚集,实现光生载流子的有效分离[7],而且贵金属可以作为光催化反应的活性位点,有效实现电子在反应位点的聚集,进而加大光催化反应速率[8]。因此在催化剂表面原位负载沉积有贵金属的助催化剂是抑制光生电子-空穴复合、提升光催化效率的有效途径。
MXene作为一类具有多种表面基团,良好导电性、亲水性和水稳定性的类石墨烯二维材料,能够有效促进半导体表面的光生电子转移,在储能、电催化和水处理方面表现出了良好的应用前景[9-10]。2019年清华大学陈晨团队利用MXene(Ti3C2Tx)表面丰富的Ti缺陷空位及其高还原能力,在没有任何其他还原剂的情况下,将单原子Pt稳定在Ti缺陷空位,实现了MXene对金属的限域,从而有效提升了电子利用率[11]。此外2018年武汉理工大学余家国教授提出,MXene表面—O和—OH等基团的存在使得MXene带负电,从而可以与Bi3+以离子键形式结合,实现铋基材料在MXene表面的原位生长,进而在两者之间形成新的电子传输通道,缩短电子的扩散路径[12]。基于以上研究可以得出,以MXene为助催化剂利用其表面Ti缺陷空位和高还原能力表面沉积贵金属,进而通过离子键合力与BixOyBrz复合是一种值得深入研究的改性方法。
本文选用MXene中应用最为广泛的Ti3C2为助催化剂,通过在其表面沉积费米能级在0 eV左右的贵金属Ru,使其成为具有电子陷阱作用的Ti3C2-Ru助催化剂,接着采用醇解法在其表面原位生长Bi4O5Br2晶体,成功制备Bi4O5Br2/Ti3C2-Ru复合催化剂,并以磺胺甲噁唑(sulfamethoxazole, SMX)为模拟药物污染物,在可见光下进行光催化测试。结果表明,不仅成功制备出了Bi4O5Br2/Ti3C2-Ru复合光催化剂,而且与纯Bi4O5Br2和Bi4O5Br2/Ti3C2相比,Bi4O5Br2/Ti3C2-Ru表现出更优异的光催化降解SMX能力,这归因于其较强的光生电子-空穴对分离效率。最后,基于催化剂能带结构和自由基捕获实验,提出了Bi4O5Br2/Ti3C2-Ru的光催化降解机理。
1 实 验
1.1 主要试剂与材料
碳钛化铝(Ti3AlC2,分析纯,≥98.0%,吉林一一科技有限公司);氟化锂(LiF,分析纯,≥99.0%,上海阿拉丁生化科技股份有限公司);三氯化钌(RuCl3·xH2O,分析纯≥99.0%,上海阿拉丁生化科技股份有限公司);五水硝酸铋(Bi(NO3)3·5H2O,分析纯,≥99.0%,国药集团化学试剂责任有限公司);溴化钾(KBr,分析纯,≥99.0%,国药集团化学试剂责任有限公司);乙二醇(EG,分析纯,国药集团化学试剂责任有限公司);氨水(NH3·H2O,分析纯,≥99.7%,天津市科密欧化学试剂有限公司);磺胺甲噁唑(SMX,分析纯,≥98.0%,上海阿拉丁生化科技股份有限公司)。所有化学试剂未经进一步纯化。
1.2 催化剂的制备
Ti3C2-Ru的制备:首先将2 g LiF加入到40 mL 9 mol/L的HCl中搅拌30 min,接着加入2 g Ti3AlC2在35 ℃下连续搅拌刻蚀24 h。刻蚀产物以3 500 r/min的速度离心,并洗涤至上清液的pH值为6,洗涤后的样品加入40 mL乙醇溶液超声1 h。超声后的样品经10 000 r/min离心收集固体加入到20 mL去离子水中继续超声20 min,再以3 500 r/min离心收取悬浮液即为Ti3C2溶液。量取10 mL Ti3C2溶液在-80 ℃下冷冻干燥,称量确定其浓度为3.2 mg/mL。最后将不同体积(40 μL、60 μL、80 μL、100 μL)的RuCl3·xH2O(10 mg/mL)缓慢滴加至5 mL、3.2 mg/mL的Ti3C2悬浮液中,并在Ar气氛下搅拌12 h,即可得到负载不同Ru含量的Ti3C2-Ru助催化剂,记为Ti3C2-Ru(x%)(x%代表Ru所占Ti3C2的质量百分比),加入40 μL、60 μL、80 μL、100 μL的RuCl3·xH2O后所制样品分别标记为Ti3C2-Ru(1%)、Ti3C2-Ru(1.5%)、Ti3C2-Ru(2%)和Ti3C2-Ru(2.5%)。
Bi4O5Br2/Ti3C2-Ru的制备:在此过程中首先探究了Ti3C2负载量(质量分数分别为0.16%、0.32%、0.48%)对Bi4O5Br2/Ti3C2光催化降解SMX活性的影响,得出Ti3C2的最佳引入量为0.32%,故在本研究中将Ti3C2-Ru(x%)的加入量定为2.7 mL,且若无特殊说明,所有复合催化剂中Ti3C2含量均为Bi4O5Br2质量的0.32%。在此基础上Bi4O5Br2/Ti3C2-Ru具体制备步骤为:首先,将4.85 g(0.01 mol)Bi(NO3)3·5H2O加入到40 mL乙二醇中搅拌1 h,然后在上述溶液中加入1.19 g(0.01 mol)KBr搅拌至溶液澄清,记为A溶液。其次,将2.7 mL Ti3C2-Ru(x%)与4 mL NH3·H2O混合后加入蒸馏水稀释至16 mL,记为溶液B。最后,将溶液B缓慢加入溶液A后在20 ℃下搅拌反应4 h,所得产物经过滤洗涤后置于60 ℃的真空烘箱中干燥12 h。制备的催化剂记为Bi4O5Br2/Ti3C2-Ru(x%)(x%代表Ru所占Ti3C2的质量百分比)。Bi4O5Br2、Bi4O5Br2/Ti3C2的制备过程与Bi4O5Br2/Ti3C2-Ru的合成方法类似,只是Bi4O5Br2在制备过程中不加入Ti3C2-Ru,Bi4O5Br2/Ti3C2在制备过程中不加入Ru。
1.3 催化剂表征与光电性能测试
利用X射线衍射仪(RigakuD/Max 2500,日本)对催化剂样品进行物相表征。利用透射电子显微镜(JEM-2100F,日本)对催化剂样品的尺寸、形貌和分布进行表征。样品表面元素化学态采用X射线光电子能谱(XPS,VG MultiLab2000,美国)进行分析。样品的吸光特性采用紫外可见分光光度计(UV-Vis DRS,UV-2450,日本)进行表征。样品的光生电荷分离效率采用光致发光光谱仪(PL,Cary-300,美国)进行分析。
样品的电化学阻抗谱(electrochemical impedance spectroscopy, EIS)和Mott-Schottky谱采用电化学工作站CHI-660E以及三电极体系进行测量。三电极体系为:催化剂分散至1 cm×1 cm氧化铟锡(indium tin oxides,ITO)玻璃薄膜表面作为工作电极,Pt网和Ag/AgCl电极分别作为对电极和参比电极。光源为300 W氙灯,1 mol/L NaSO4作为电解质溶液。
1.4 光催化剂活性评价
样品的光催化性能通过在可见光照射下(λ≥420 nm)对溶液中SMX的降解率来评定。具体操作步骤为:首先称量0.05 g催化剂样品分散至100 mL SMX(10 mg/L)溶液中,所得溶液在黑暗条件下连续搅拌30 min达到吸附-脱附平衡。之后将悬浮液转移至可见光下进行降解测试,每隔15 min取4 mL溶液离心后采用UV-Vis光度计测量溶液在254 nm处的吸光度,SMX的降解率(D)应用公式D=(1-Ct/C0)×100%计算得到,其中C0为SMX的初始浓度,Ct为反应进行一段时间后SMX的浓度。反应过程中,光源与反应器之间的距离设置为20 cm,所有实验均在25 ℃恒温水浴锅中进行。
2 结果与讨论
2.1 光催化剂的表征
通过XRD对所制样品的组成和晶型结构进行分析,结果如图1所示。从图中可以看出,位于6.6°左右的峰对应于Ti3C2的(002)晶面,表明Ti3C2的成功制备[6]。样品Bi4O5Br2在9.4°、26.5°、29.6°、32.4°和45.8°出现衍射峰,与PDF卡片(PDF#37-0699)标准衍射图谱一致,分别对应于Bi4O5Br2的(101)、(310)、(411)、(020)、(422)晶面,表明成功制备了单斜相晶体结构的Bi4O5Br2[13]。此外,Bi4O5Br2/Ti3C2和Bi4O5Br2/Ti3C2-Ru(2%)的衍射峰与Bi4O5Br2相比没有明显变化,表明Ti3C2与Ti3C2-Ru的引入不会影响Bi4O5Br2的结构。同时,在Bi4O5Br2/Ti3C2和Bi4O5Br2/Ti3C2-Ru(2%)中没有观察到Ti3C2与Ru的衍射峰,这可能是因为Ti3C2和Ti3C2-Ru负载量过低的缘故[14]。
图2为所制催化剂的TEM照片。图2(a)和2(b)为Ti3C2-Ru(2%)纳米片的TEM照片和能量色散X射线光谱仪图谱,从中可以看出在复合材料中存在Ti、C、O、F、Ru等元素,且分布均匀,证明Ru成功负载至Ti3C2表面。图2(c)和2(d)为Bi4O5Br2/Ti3C2-Ru(2%)的TEM和HRTEM照片。从图2(c)中可以看出,Bi4O5Br2均匀附着在Ti3C2-Ru纳米片表面。从图2(d)中可以观察到0.321 nm和0.250 nm两个不同的晶格条纹,分别对应于Bi4O5Br2的(212)面和Ti3C2(006)面[15-16]。
为了进一步确定Ru的成功负载以及Ru在复合材料表面所处的化学态,对样品Ti3C2、Ti3C2-Ru(2%)、Bi4O5Br2/Ti3C2-Ru(2%)进行了XPS分析。如图3(a)所示,所制样品主要由Bi、O、Br、C、Ti和Ru组成。图3(b)、3(c)分别为Ti3C2、Ti3C2-Ru(2%)的C 1s和Ti 2p高分辨图谱,从中可以看出样品Ti3C2-Ru(2%)在280.80 eV和284.75 eV处出现两个额外谱峰,分别对应于Ru 3d5/2与Ru 3d3/2[17]。此外Ti3C2-Ru(2%)的Ti 2p轨道在463.90 eV处同样出现了Ru 3p信号,表明Ti3C2-Ru(2%)助催化剂中Ru3+被成功还原为零价并负载于Ti3C2表面[13]。此外由样品Bi4O5Br2和Bi4O5Br2/Ti3C2-Ru(2%)的Bi 4f和Br 3d高分辨率图谱(见图3(e)和3(f))可知Bi4O5Br2/Ti3C2-Ru(2%)中Bi 4f5/2(164.46 eV)、Bi 4f7/2(159.17 eV)以及Br 3d3/2(69.58 eV)、Br 3d5/2(68.41 eV)的结合能对比Bi4O5Br2均出现了不同程度的正移,同时由图3(g)可以看出Bi4O5Br2/Ti3C2-Ru(2%)与Ti3C2的Ti 2p结合能相比出现了负移,表明Bi4O5Br2与Ti3C2界面之间存在有强烈的相互作用,且电子从Bi4O5Br2转移至了Ti3C2表面[18]。更重要的是在Bi4O5Br2/Ti3C2-Ru(2%)催化剂光谱中(见图3(d))Ru的结合能(3d5/2和3d3/2分别为280.40 eV和284.35 eV)负移说明Bi4O5Br2晶体在Ti3C2-Ru表面生长过程中,电子由Ti3C2更多地转移至Ru纳米颗粒表面[13]。结合上述TEM和XPS分析结果,可以得出在Bi4O5Br2/Ti3C2-Ru(2%)催化剂中Ti3C2纳米片与Bi4O5Br2之间存在作用力较强的界面,且形成了电子定向转移的特殊通道,能实现电子由Bi4O5Br2到Ti3C2再到反应活性位点Ru的定向传递。
图4(a)为所制催化剂样品的UV-Vis DRS光谱。从图中可以看出,Bi4O5Br2吸收带边约为489 nm,随着Ti3C2、Ti3C2-Ru的负载,催化剂的吸收带边出现明显的红移,表明其可见光响应能力增强,且Bi4O5Br2/Ti3C2、Bi4O5Br2/Ti3C2-Ru(2%)的吸收带边分别为511 nm和559 nm。根据方程αhν=A(hν-Eg)n/2,计算得到Bi4O5Br2、Bi4O5Br2/Ti3C2、Bi4O5Br2/Ti3C2-Ru(2%)的带隙能量Eg分别为2.32 eV、2.20 eV、2.05 eV(见图4(b))。同时,Bi4O5Br2/Ti3C2-Ru(2%)样品在500 nm处可观察到额外的吸收峰,这一特征可以归因于Ru纳米颗粒表面等离子体共振峰,进一步证实了Ru在Ti3C2表面的成功负载[19]。
为了进一步确定Bi4O5Br2的半导体类型、能带结构以及Ti3C2的平带电位(EFB),本文测试了所制样品的价带XPS光谱(VB-XPS)和Mott-schottky谱。如图4(c)所示,Mott-schottky分析结果表明,Bi4O5Br2和Ti3C2的EFB分别为-0.81 V和-0.56 V versus Ag/AgCl,即-0.59 V和-0.34 V versus NHE。且Bi4O5Br2的1/C2和电势的比值为正斜率,表明其为n型半导体,所以Ef=EFB[20],因此Bi4O5Br2与Ti3C2的Ef分别为-0.59 V和-0.34 V[21-22]。此外,如图4(d)所示,利用VB-XPS测量得到Bi4O5Br2的费米能级(Ef)和价带电势(EVB)之间的能隙(Evf)为1.90 eV[23]。根据EVB=Evf+EFB,ECB=EVB-Eg,得出Bi4O5Br2的EVB、ECB分别为1.31 V和-1.01 V。由于Ti3C2的Ef=-0.34 V比Bi4O5Br2的导带电势(ECB)更正,因此更有利于电子由Bi4O5Br2导带转移至Ti3C2表面并进一步被Ru纳米颗粒捕获。
通过光致发光光谱、EIS对所制催化剂的电子-空穴分离效率以及电子转移阻力进行分析[24],如图5所示。图5(a)表示在320 nm的光激发波长下,Bi4O5Br2/Ti3C2-Ru(2%)在430 nm处的峰最弱,表明其光生载流子的复合率低于Bi4O5Br2和Bi4O5Br2/Ti3C2。通过EIS光谱进一步比较了Bi4O5Br2、Bi4O5Br2/Ti3C2、Bi4O5Br2/Ti3C2-Ru(2%)的光致电荷转移阻力,图5(b)表示,Bi4O5Br2/Ti3C2-Ru(2%)展现出更小的Nyquist曲线半径,表明其具有更低的界面电荷转移电阻以及更高的光生载流子分离效率。结合EIS和PL光谱分析,进一步证实了Ti3C2-Ru助催化剂的存在可以有效促进表面电子转移和分离,抑制光生电荷的复合。
2.2 光催化活性测试
图6(a)显示了所制样品在可见光下降解SMX的效果。从中可以看出,在Bi4O5Br2/Ti3C2光催化剂中,Ti3C2负载量为0.32%时,样品的催化性能达到最佳,光照75 min后SMX的降解率达到69.8%,以此催化剂为标准,探究了Ru加入量对催化剂活性的影响。结果表明随着Ti3C2表面Ru含量的增加,Bi4O5Br2/Ti3C2-Ru对SMX的降解率呈现先提高后降低的趋势,在Ru的负载量为2%时,催化活性达到最佳,光照75 min对SMX的降解率为95.1%,与Bi4O5Br和Bi4O5Br/Ti3C2相比,降解率分别提升了36.9个百分点和25.3个百分点。提高的原因主要在于Ru纳米颗粒的沉积导致Ti3C2表面金属活性位点增加,光生电子成功实现了由Bi4O5Br2到Ti3C2再到反应活性位点Ru的定向传递,从而使催化剂具有了更强的光生载流子分离率,加之较低的界面电荷转移电阻,有效抑制了光生电子-空穴对的复合[13]。然而当负载Ru的质量分数超过2%时,Ti3C2表面Ru纳米颗粒可能会发生部分聚集,从而导致催化活性下降[7]。
通过SMX的循环降解实验进一步考察了所制Bi4O5Br2/Ti3C2-Ru(2%)光催化剂的循环稳定性[25],如图6(b)所示。经过四次循环后,Bi4O5Br2/Ti3C2-Ru(2%)对SMX的降解率仍能够达到80.4%,表明其稳定性较好。同时反应前后样品的XRD图谱(见图6(c))和XPS图谱(见图3(d)、图6(d))均未发生明显变化,表明Bi4O5Br2/Ti3C2-Ru(2%)具有良好的结构、表面化学态稳定性。
2.3 光催化机理分析
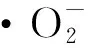
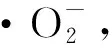
3 结 论
(1)本文通过醇解法成功制备出了Bi4O5Br2/Ti3C2-Ru复合光催化剂。所制催化剂表现出良好的光催化降解活性,在可见光照射75 min后,对磺胺甲噁唑的降解率达到95.1%,比Bi4O5Br2、Bi4O5Br2/Ti3C2的降解率分别提升了36.9个百分点和25.3个百分点。
(2)结合XRD、TEM、XPS、DRS、EIS、PL和降解机理分析表明,Bi4O5Br2/Ti3C2-Ru良好的光催化活性主要归因于Bi4O5Br2与Ti3C2-Ru界面之间的密切接触以及强烈的相互作用,为光生电荷的快速转移和分离提供了良好界面,有效地促进了电子向Ru的转移,从而提高了光生载流子的分离效率,同时Ru的存在提供了高质量的反应位点。