重组小鼠源MANF 对LPS 诱导的脓毒症急性肺损伤小鼠转归的作用#
汪建文 曾涛 王欣 于洋 万莉红 周琰
(1. 四川大学华西医院重症医学科,四川 成都 610041;2. 四川大学华西基础医学与法医学院药理学教研室,四川 成都 610041)
脓毒症是由各种感染(病毒、细菌)引起的全身炎症反应综合征,目前尚无特异性治疗药物,因而病死率高达30%-70%,是重症监护室患者的主要死因之一[1]。据统计,全球每天约有1.4 万人死于脓毒症并发症,其中脓毒症急性肺损伤(Acute lung injury,ALI)是最常见的并发症之一[2],超过50%的脓毒症患者出现ALI,且发生ALI后患者死亡率明显增高。
内质网应激(Endoplasmic reticulum stress,ERS)是机体的一种自我保护机制,然而持续的ERS 则会激活凋亡等途径引起细胞损伤,因此抑制内质网应激可有效减轻脓毒症患者的病情[3]。中脑星形胶质细胞源性神经营养因子( Mesencephalic astrocyte-derived neurotrophic factor,MANF)是一种新型保守的神经营养因子,主要位于内质网腔[4],其基因上游启动子区域中含有内质网应激反应组件-Ⅱ(ER stress response element-Ⅱ,ERSE-Ⅱ),可接受内质网应激相关蛋白ATF6 和XBP-1 的转录调节,属于内质网应激反应基因。研究表明,MANF 在内质网应激时上调或分泌增加,以对抗细胞凋亡发挥细胞保护作用,在脓毒症心肌细胞凋亡以及肾损伤中均发挥了明显的保护作用[5-6]。为此,本文拟将MANF 应用于脓毒症急性肺损伤小鼠探究其保护作用及潜在机制。
1 材料与方法
1.1 材料
1.1.1 试剂
脂多糖(Lipopolysaccharide,LPS)(Sigma,美国),重组小鼠源MANF(义翘神州科技有限公司,北京),还原型谷胱甘肽(Glutathione,GSH)、丙二醛(Malondialdehyde,MDA)试剂盒(Elabscience)。
1.1.2 动物
6-8 周龄SPF 级C57BL/6 雄性小鼠(体重20~25 g)购自成都达硕实验动物有限公司(中国,成都)。所有小鼠饲养于无病原菌的环境(温度:22~25℃,湿度:55%,光暗循环12:12),可自由摄取食物和水,该动物实验获四川大学华西基础医学与法医学院动物伦理审批。
1.2 方法
1.2.1 生存曲线
选取6-8 周龄SPF 级C57BL/6 雄性小鼠50只,随机均分为对照组、模型组、MANF 治疗组(n=10),适应性喂养3 d 后,模型组和MANF 治疗组小鼠以LPS(15 mg•kg-1,i.p.)建立急性肺损伤模型;对照组小鼠腹腔注射等量生理盐水。MANF 治疗组小鼠于LPS 注射后6 h 经尾静脉注射重组小鼠源MANF(250、500、750 μg•kg-1),其余组尾静脉注射等量生理盐水;记录72 h 内小鼠的生存情况,绘制生存曲线。
1.2.2 肺组织病理检测
选取6-8 周C57BL/6 雄性小鼠24 只,随机均分为对照组、模型组、MANF 治疗组(n=8),适应性喂养3 d 后,采用1.2.1 中方法建立小鼠急性肺损伤模型。MANF 治疗组小鼠于LPS 注射后6 h 经尾静脉注射重组小鼠源MANF(1.2.1 中所得最佳剂量),其余组尾静脉注射等量生理盐水。所有小鼠造模24 h 后,腹腔注射戊巴比妥50 mg•kg-1麻醉、心脏穿刺灌注后取左肺组织用4%多聚甲醛4℃固定过夜、包埋并切片,经HE 染色后,在光学显微镜下观察各组小鼠肺组织的病理形态并比较肺组织损伤情况。
1.2.3 TUNEL ( TdT-mediated dUTP Nick-End Labeling)染色
取包埋后的肺组织切片,采用TUNEL 细胞凋亡检测试剂盒(FITC)观察并比较小鼠肺组织凋亡发生情况,使用Hoechst 33258 染料和共聚焦激光荧光显微镜对肺组织进行核染色及拍照。
1.2.4 肺组织氧化应激水平测定
取新鲜右肺组织漂洗后加入PBS 进行匀浆,在4℃条件下以10000×g 离心制备组织匀浆,取0.1 mL 待测样品用PBS 稀释两倍后依次按照试剂盒说明加入不同试剂,采用酶标仪分别在405 nm、532 nm 波长测定吸光度并计算还原型谷胱甘肽及丙二醛含量。
1.3 统计学分析
所有数据通过GraphPad Prism 8.0 进行分析,计量资料以均数±标准差(±SD)表示,采用oneway ANOVA 方差分析检验;计量资料以率(%)表示,采用卡方检验,其中P<0.05 表示差异具有统计学差异。
2 结果
2.1 重组小鼠源MANF 对LPS 脓毒症小鼠生存时间的影响
LPS(15 mg•kg-1, i.p.)诱导的脓毒症急性肺损伤小鼠在LPS 注射后24 h 内死亡明显,存活率约70%;之后死亡继续增加,在LPS 注射后72 h仅存活20%;而尾静脉注射重组小鼠源MANF 750 μg•kg-1后,脓毒症小鼠24 h 内的病死率明显降低(P<0.05),但对长期存活率未见明显改善(P>0.05),见图1。
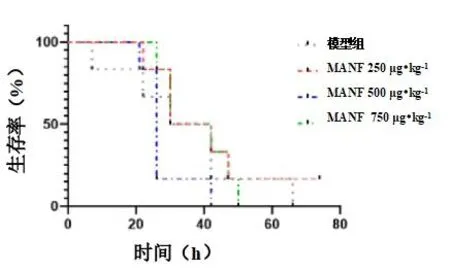
图1 生存曲线
2.2 重组小鼠源MANF 对LPS 脓毒症小鼠肺损伤的保护作用
对照组小鼠肺组织结构完整、排列紧密且无明显炎性细胞浸润;LPS(15 mg•kg-1)单次腹腔注射诱导的脓毒症小鼠出现明显的肺损伤,表现为:肺泡结构损伤、肺泡壁显著增厚、大量的炎细胞浸润、可见肺泡内出血;MANF 治疗组小鼠肺组织病理变化较LPS 模型组明显减轻,多数肺泡结构完整、肺泡间隔变窄、炎性细胞浸润减少,见图2。

图2 肺组织病理改变(HE,×200)
2.3 重组小鼠源MANF 对LPS 脓毒症小鼠肺组织凋亡的影响
与对照组小鼠肺组织相比,LPS(15 mg•kg-1)单次腹腔注射诱导的脓毒症小鼠肺组织TUNEL 阳性细胞占比明显增加;而与LPS 模型小鼠相比,MANF 治疗组小鼠肺组织TUNEL 阳性细胞占比显著减少,见图3。

图3 肺组织凋亡情况(TUNEL 染色,×200)
2.4 重组小鼠源MANF 对LPS 脓毒症小鼠肺组织氧化应激反应的影响
与对照组小鼠肺组织相比,LPS(15 mg•kg-1)单次腹腔注射诱导的脓毒症小鼠肺组织GSH水平明显下降,MANF 治疗组小鼠肺组织GSH 水平明显增加(P<0.05);而MDA 水平未见明显统计学差异(P>0.05),见图4。
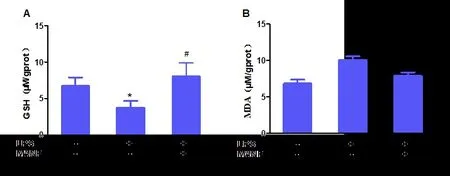
图4 肺组织氧化应激水平(A-GSH;B-MDA)
3 讨论
目前大量研究证实MANF 作为一种内质网应激调节蛋白对多种疾病具有保护作用,包括脑缺血、心肌梗塞、视网膜变性等。
本文以脓毒症肺损伤小鼠为研究对象,采用重组小鼠源MANF 尾静脉注射的方式,首先观察了MANF 对脓毒症病死率的影响,结果发现重组小鼠源MANF(750 μg/kg,尾静脉注射)对急性期(24 h 内)病死率具有显著降低作用;然而对长期存活率未见明显改善。这可能由于我们采用的给药方式为静脉注射,而重组MANF 的半衰期较短,单次注射难以长时间维持其恒定的血药浓度所致。但是,MANF 在脓毒症急性期内的保护作用是确切的,而急性期正是脓毒症治疗的关键时期。
肺是脓毒症最易受损的靶器官,因此ALI 是脓毒症最早发生的器官损伤,发生率也较高[7],早期干预将对脓毒症患者的肺损伤具有积极的防治价值。本研究选用生存曲线中效果最佳的MANF剂量750 μg/kg 进行试验,结果通过HE 染色发现MANF 尾静脉注射对LPS 诱导的脓毒症急性肺损伤具有显著的改善作用,不仅明显减轻了炎性细胞浸润,同时肺组织结构损伤也有显著减轻。由于内质网应激在肺损伤中扮演重要的角色,抑制内质网应激可有效减轻脓毒症患者的病情[3]。在持续的ERS 作用下,肺组织结构细胞在IRE1α 激活X盒结合蛋白1(X-box binding protein 1,XBP1)转录,从而活化下游凋亡蛋白CHOP 的作用下发生凋亡[8]。本文采用TUNEL 染色对肺组织的凋亡情况进行研究,发现MANF 尾静脉注射可明显减少LPS 诱导的凋亡,表现为TUNEL 阳性细胞的减少。
另外,持续的内质网应激可调节活性氧(Reactive oxygen species,ROS)激活氧化应激反应,从而消耗细胞内的抗氧化物质谷胱甘肽(Glutathione,GSH)引起细胞内丙二醛(Malondialdehyde,MDA)含量增加[9]。为此,本文通过测定GSH 和MDA 水平间接反映MANF对小鼠肺组织氧化应激反应的影响,结果显示MANF 治疗后明显增加抗氧化物质GSH 的含量,对MDA 有一定的减轻作用,但缺乏统计学差异,这可能和MANF 半衰期短有关,后期需要进一步加大样本量以及改变MANF 给药途径来进行研究。由于GSH 是肺泡上皮衬液中最主要的小分子抗氧化物质,研究表明GSH 治疗后的脓毒症肺损伤大鼠外周血淋巴细胞凋亡率明显降低[10]。因此,MANF 治疗显著增加GSH 含量在提高抗氧化应激作用上效果明确。
综上所述,重组小鼠源MANF 可明显降低LPS 脓毒症小鼠急性期病死率;同时对脓毒症导致的急性肺损伤具有明显的保护作用,可抑制肺组织凋亡、减轻氧化应激反应。

