清解化攻方调节重症急性胰腺炎模型大鼠肠道菌群及对肠黏膜屏障的影响Δ
秦百君,唐曦平,杨昕,杨蕾,冯敏超,张驰,洪晓华,蓝艳梅,陈国忠(1.广西中医药大学第一附属医院脾胃科,南宁 500;.广西中医药大学第一临床医学院,南宁 50001;.广西医科大学附属肿瘤医院胰腺内科,南宁 5001;.仁寿县中医院内科,四川 眉山 60500)
重症急性胰腺炎(severe acute pancreatitis,SAP)是由胰蛋白酶异常激活、炎症因子大量释放入血而引发的胰腺水肿坏死及胰周组织液积聚。该病可并发肠梗阻、胃肠功能衰竭等疾病,严重者会出现全身炎症反应综合征和多器官功能障碍等急危重症[1]。SAP在亚洲国家的发病率为0.036%~0.125%,病死率为6.5%~26%,且进展迅速,预后凶险[2-3]。肠道是SAP早期受损的功能器官之一,生理状态下,肠道菌群与肠黏膜屏障相互作用,共同维持肠道稳态并促进组织代谢、调节免疫等;疾病状态下,肠道屏障功能障碍及肠道菌群失衡是SAP的重要病理机制之一,菌群的结构、相对丰度、位置变化均可能破坏肠黏膜屏障的完整性,从而进一步诱发菌群移位,加重炎症水平,损害靶器官[4-5]。因此,在SAP早期修复肠黏膜屏障功能,并及时抑制菌群移位,对降低全身炎症水平、遏制病情进展具有重要意义。清解化攻方(Qingjie huagong decoction,QJHGD)是广西中医药大学第一附属医院脾胃科治疗SAP的院内制剂,临床应用多年,已获国家发明专利(专利号ZL201811021893.2)。本课题组前期研究表明,QJHGD联合化学药治疗早期SAP的临床疗效较好,可抑制炎症因子表达,降低胰腺组织坏死程度,保护肠黏膜屏障,但具体机制未完全阐明[6-8]。
本研究采用雨蛙素联合脂多糖腹腔注射法复制SAP大鼠模型,采用酶联免疫吸附测定(enzyme-linked immunoadsordent assay,ELISA)法和Western blot法观察QJHGD对SAP模型大鼠炎症水平及肠黏膜屏障调节蛋白的影响;并基于16S rRNA高通量测序,初步探究该药对SAP模型大鼠肠黏膜屏障的保护作用及调节肠道菌群、修复肠黏膜屏障的分子机制。
1 材料
1.1 主要仪器
本研究所用主要仪器有Centrifuge5804R型离心机(德国Eppendorf公司),CKX41型倒置相差显微镜(日本Olympus公司),RM2016型病理切片机(德国Leica公司),Thermo HistoStar型组织包埋机(江苏维林科生物技术有限公司),Qubit 3.0 Fluromete型荧光定量仪、Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司),Amersham Imager 600型超灵敏多功能成像仪(美国GE公司),Agilent 2100 Bioanalyzer型生物芯片分析系统(美国Agilent公司)。
1.2 主要药品与试剂
QJHGD药材饮片均购自广西仙茱中药科技有限公司,分别为柴胡(批号17010267)、大黄(批号17010163)、厚朴(批号16060431)、黄芩(批号16060117)、木香(批号16080375)、桃仁(批号16282049)、枳实(批号16182144),经广西中医药大学中药真伪鉴定技术中心鉴定为真品,符合《中国药典》相关规定[9]。将上述药材加10倍蒸馏水浸泡24 h后,武火煮沸,再以文火煮30 min,过滤;药渣继续加水煎煮3次,合并3次滤液,以旋转蒸发仪浓缩,制成质量浓度为1 g/mL的药液(以生药量计)。
其他药品与试剂有注射用乌司他丁(广东天普生化医药股份有限公司,批号032005103,规格10×104U/支),雨蛙素、脂多糖(上海源叶生物科技有限公司,批号分别为S62702、S11060),苏木素-伊红染色试剂盒、兔闭合蛋白(Occludin)多克隆抗体(北京索莱宝科技有限公司,批号分别为G1120、K106466P),血清淀粉酶试剂盒(北京冬歌博业生物科技有限公司,批号DG96286Q),白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(上海酶联生物科技有限公司,批号ER008-96),IL-18 ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号EEL-R0567c),IL-10 ELISA试剂盒(深圳欣博盛生物科技有限公司,批号211070825),兔高迁移率族蛋白B1(HMGB1)多克隆抗体(武汉贝茵莱生物科技有限公司,批号PAB46173),兔闭锁连接蛋白1(ZO-1)多克隆抗体、兔GAPDH多克隆抗体、HRP标记的山羊抗兔免疫球蛋白G抗体、ECL发光试剂盒(美国Affinity公司,批号分别为 AF5145、AF7021、S0001、KF003),RIPA 裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号分别为P0013B、P0010S)。
1.3 动物
本研究所用动物为SPF级SD大鼠,8周龄,雄性,体质量为(200±20)g,购于湖南斯莱克景达实验动物有限公司,动物生产许可合格证号为SCXK(湘)2019-0004。大鼠饲养于广西中医药大学第一附属医院医学分子生物学实验中心SPF级实验室,动物使用许可证号为SYXK(桂)2019-0001。实验室环境湿度为55%~65%,温度为(24±2)℃,光暗循环12 h/12 h,实验前适应性喂养1周,期间自由饮水和进食。本研究符合动物实验伦理要求。
2 方法
2.1 分组、造模与给药
将60只SD大鼠随机分为空白对照组、模型组、阳性药对照组、QJHGD治疗组,每组15只。造模前24 h大鼠禁食不禁水,采用雨蛙素联合脂多糖腹腔注射法[10],并参考《药理实验方法学(第4版)》[11]造模。模型组、阳性药对照组、QJHGD治疗组大鼠腹腔注射雨蛙素(50 μg/kg),每小时1次,连续6次,第7次注射脂多糖(10 mg/kg)以复制SAP模型。末次注射后,各组取3只大鼠,剖取大鼠胰腺组织,当胰腺发生水肿渗出、局部呈暗红色且被膜下有出血点时,表明造模成功[12]。造模成功后,QJHGD治疗组大鼠灌胃QJHGD药液(7 g/kg,剂量根据临床等效剂量换算而得),阳性药对照组大鼠腹腔注射乌司他丁(5 U/kg,剂量根据临床等效剂量换算而得),空白对照组、模型组大鼠灌胃与QJHGD治疗组腹腔注射等体积的生理盐水,每天2次,连续3 d。
2.2 生存状态观察及指标检测
2.2.1 大鼠生存状态的观察 观察并记录各组大鼠造模及给药后的精神状态、呼吸、活动、饮食、腹部膨胀情况等方面的变化,统计大鼠3 d内的死亡情况,然后从各组剩余大鼠中分别抽取10只进行后续实验。
2.2.2 大鼠血清中血清淀粉酶及炎症因子水平的检测 大鼠末次给药后1 h,腹主动脉取血约5 mL,室温静置2 h,以3 000 r/min离心10 min,取上清液分装于试管中,采用全自动生化检测仪检测大鼠血清中血清淀粉酶水平,采用ELISA法检测大鼠血清中IL10、IL-18、IL-1β水平。
2.2.3 大鼠胰腺及小肠组织的病理学观察 采用苏木素-伊红染色法进行观察。各组大鼠取血完成后,腹腔注射戊巴比妥钠(50 mg/kg)进行麻醉,处死。取大鼠胰头组织及距回盲部2 cm左右的小肠组织(并收集其小肠内容物,备用),部分固定于4%多聚甲醛溶液中(另外部分用无酶、无菌管收集后于-80℃冰箱中保存),再进行梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚度4µm)。切片以苏木素染色5 min,依次洗涤、分化后,再以伊红染色30 s,然后进行脱水、透明,用中性树胶密封,置于显微镜下观察胰腺及小肠组织的病理变化。采用Schmidt法进行胰腺组织病理评分[13],采用Chiu等[14]报告的标准化评分方法进行小肠组织病理评分。病理切片由广西中医药大学第一附属医院和广西医科大学附属肿瘤医院病理科2位主任医师进行双盲观察,综合两者意见得到最终评分。
2.2.4 大鼠小肠组织中HMGB1、Occludin、ZO-1蛋白表达水平的检测 取“2.2.3”项下保存于-80℃冰箱的小肠组织适量,加入600 μL RIPA裂解液研磨,于4℃下以12 000 r/min离心15 min,取上清液,采用BCA试剂盒测定蛋白浓度。将上清液加入适量蛋白上样缓冲液煮沸15 min后,进行十二烷基硫酸钠-聚丙烯酰胺电泳,转膜;以脱脂奶粉封闭2 h,加入HMGB1、Occludin、ZO-1一抗(稀释度均为1∶1 000)和GAPDH一抗(稀释度为1∶3 000),4℃孵育过夜;以TBST洗涤重复3次,每次5 min,加入二抗(稀释度为1∶5 000),常温孵育1 h;以ECL发光液显影曝光,并用凝胶成像系统成像。采用Image J软件进行条带定量分析,以目的蛋白与内参的灰度值比值表示其表达水平。
2.3 肠道菌群分析
2.3.1 肠道菌群16S rRNA测序 取“2.2.3”项下各组大鼠的小肠内容物至对应编号的无菌冻存管中,置于-80℃冰箱冻存后,送至上海中科新生命生物科技有限公司进行16S rRNA高通量测序。由于取材时阳性药对照组大鼠小肠内容物污染严重,故未进行测序。
2.3.2 肠道菌群多样性分析 将“2.3.1”项下测序得到的原始数据用FLASH软件进行序列拼接、过滤及去嵌合体,得到有效数据。基于有效数据进行分类操作单元聚类(operational taxonomic units,OTUs)和物种分类:采用UPARSE软件包结合UPARSE-otu和UPARSE-oturef算法分析α多样性(样本内)和β多样性(样本间),将相似性≥97%的序列归为相同OTUs;采用Shannon、Simpson、Ace、Coverage、Chao1 指数表征菌群多样性。对OTUs多样性指数进行分析,并基于Bray-Curtis算法对微生物结构组间差异进行分析。
2.4 统计学方法
3 结果
3.1 QJHGD对SAP模型大鼠生存状态的影响
空白对照组大鼠精神较佳,饮食规律,活动自如;模型组大鼠造模后状态较差,出现精神萎靡、呼吸急促、嗜睡、食欲差、蜷缩颤抖、腹部膨胀等症状;阳性药对照组和QJHGD治疗组较模型组大鼠腹部膨胀症状明显减轻,饮食及活动增加,精神状态恢复较好。空白对照组大鼠无死亡现象;模型组大鼠造模24 h后开始死亡,造模后共死亡6只大鼠(模型组最后死亡的1只大鼠在造模后第3天,为保证后续实验各组大鼠数量一致、基线可比,笔者在其濒临死亡时,立即麻醉取材);阳性药对照组大鼠共死亡4只;QJHGD治疗组大鼠共死亡3只。综上,QJHGD可改善SAP模型大鼠的生存状态,降低其死亡率。
3.2 QJHGD对SAP模型大鼠血清中血清淀粉酶和炎症因子水平的影响
与空白对照组比较,模型组大鼠血清中血清淀粉酶、IL-10、IL-18、IL-1β水平均显著升高(P<0.05);与模型组比较,阳性药对照组和QJHGD治疗组大鼠血清中血清淀粉酶、IL-18、IL-1β(QJHGD治疗组除外)水平均显著降低(P<0.05),IL-10水平显著升高(P<0.05)。结果见表1。
表1 各组大鼠血清中血清淀粉酶和炎症因子水平的检测结果(±s,n=10)

表1 各组大鼠血清中血清淀粉酶和炎症因子水平的检测结果(±s,n=10)
a:与空白对照组比较,P<0.05;b:与模型组比较,P<0.05
组别空白对照组模型组阳性药对照组QJHGD治疗组IL-1β/(pg/mL)24.81±9.39 115.38±34.23a 93.13±13.95b 108.42±8.33血清淀粉酶/(U/L)2 094.21±341.07 9 062.05±2 497.23a 3 394.00±456.93b 3 079.81±834.62b IL-10/(ng/L)14.15±2.11 37.34±14.25a 59.34±9.23b 55.47±11.84b IL-18/(pg/mL)89.59±31.06 567.19±42.19a 189.65±34.69b 193.28±85.13b
3.3 QJHGD对SAP模型大鼠胰腺及小肠组织病理的影响
苏木素-伊红染色结果显示,空白对照组大鼠胰腺组织排列紧密、结构完整,胰管走形正常,未见小叶间隙增宽,无出血坏死;肠上皮细胞无水肿,肠黏膜无脱落。模型组大鼠胰腺结构弥漫性破坏,细胞肿胀,实质性出血明显,并伴有炎症细胞浸润;肠上皮细胞结构紊乱,间隔稀疏,水肿增加,肠黏膜上皮脱落,并伴有炎症细胞浸润。阳性药对照组、QJHGD治疗组大鼠的胰腺组织坏死区域、炎症细胞浸润较模型组减少,胰腺小叶水肿减轻、出血坏死灶减少;肠上皮细胞结构稍紊乱,可见炎症细胞浸润,少许肠黏膜上皮脱落。组织病理学损伤评分结果显示,与空白对照组比较,模型组大鼠胰腺及小肠组织的病理评分均显著升高;与模型组比较,阳性药对照组大鼠小肠组织的病理评分和QJHGD治疗组大鼠胰腺及小肠组织的病理评分均显著降低(P<0.05)。结果见表2、图1。

图1 各组大鼠胰腺及小肠组织的病理学观察显微图(苏木素-伊红染色,×200)
表2 各组大鼠胰腺及小肠组织的病理评分结果(±s,n=10)

表2 各组大鼠胰腺及小肠组织的病理评分结果(±s,n=10)
a:与空白对照组比较,P<0.05;b:与模型组比较,P<0.05
组别空白对照组模型组阳性药对照组QJHGD治疗组小肠组织0.63±0.14 5.24±1.81a 3.84±0.33b 2.55±0.21b胰腺组织0.62±0.23 10.29±3.45a 8.12±2.95 7.57±2.31b
3.4 QJHGD对SAP模型大鼠小肠组织中HMGB1、Occludin、ZO-1蛋白表达的影响
与空白对照组比较,模型组大鼠小肠组织中HMGB1蛋白表达水平显著升高(P<0.05),Occludin、ZO-1蛋白表达水平均显著降低(P<0.05);与模型组比较,阳性药对照组、QJHGD治疗组大鼠小肠组织中HMGB1蛋白表达水平均显著降低(P<0.05),Occludin、ZO-1蛋白表达水平均显著升高(P<0.05)。结果见图2。
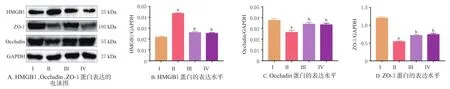
图2 QJHGD对SAP模型大鼠小肠组织中HMGB1、Occludin、ZO-1蛋白表达的影响
3.5 肠道菌群测序及分析结果
3.5.1 测序样本合理性考察结果 稀释曲线是评估OTUs数量是否趋近于饱和以及样品物种丰富程度的重要指标,Shannon曲线是根据各样本测序量在不同测序深度时的微生物多样性指数所绘制的曲线[15]。本研究收集了空白对照组、模型组、QJHGD治疗组共30只大鼠的小肠内容物样本,通过微生物稀释曲线图、Shannon曲线图考察测序样本的合理性,结果见图3。由图3可见,稀释曲线和Shannon曲线均逐渐趋向平坦,各样本有效序列大于70 000,观测到的OTUs数量约为1 000,这表明本研究测序数据量足够大,可以反映样本中绝大多数的微生物信息。

图3 测序数据量合理性评估图
3.5.2 组间群落结构差异检验 基于Bray-Curtis算法对微生物结构组间差异进行Anosim非参数检验,结果表明,空白对照组、模型组、QJHGD治疗组大鼠小肠内容物样本两两比较,P值均小于0.01,相关变量系数R2分别为0.546(空白对照组vs.模型组)、0.681(模型组vs.QJHGD治疗组)、0.898(空白对照组vs.QJHGD治疗组),均大于0,提示这3组样本组间差异明显,分组合理有意义。
3.5.3 OTUs分析和菌群组成分析 对30个小肠内容物样本进行高通量测序分析,得到2 361 942条测序数据,每个样品平均78 731条,共聚类得到2 620个OTUs。其中,空白对照组和模型组共有的OTUs数量为1 377个,模型组和QJHGD治疗组共有的OTUs数量为675个。经鉴定,小肠内容物样本中的肠道菌群涉及16个门、211个属。根据物种注释结果,选取各组在门水平和属水平上相对丰度排名前10位的菌群,得到菌群相对丰度堆积柱形图,具体见图4。

图4 各组样本在门水平和属水平上的物种组成分布
在门水平上,样本肠道菌群涉及厚壁菌门Firmicutes、变形菌门Proteobacteria、拟杆菌门Bacteroidetes、放线菌门Actinobacteria、软壁菌门Tenericutes、ε-变形菌门ε-Proteobacteria、蓝藻门Cyanophyta、髌骨菌门Patescibacteria、脱铁杆菌门 Deferribacteres、螺旋体门Spirochaetes等。其中,厚壁菌门、变形菌门、拟杆菌门和放线菌门是各组大鼠肠道菌群门水平的主要构成物种。在空白对照组、模型组、QJHGD治疗组中,厚壁菌门的相对丰度分别为56.2%、55.1%、50.2%,变形菌门的相对丰度分别为33.3%、20.5%、2.3%,拟杆菌门的相对丰度分别为4.4%、17.2%、40.2%,放线菌门的相对丰度分别为4.8%、3.9%、6.9%。
在属水平上,各组样本相对丰度较高的菌属为拟杆菌属Bacteroides、真杆菌属Eubacteriumprévot、普雷沃氏菌属PrevotellaShanandCollins、乳酸杆菌属Lactobacillus、瘤胃球菌属Ruminococcus、埃希氏-志贺氏菌属Escherichia-Shigella、梭状芽孢杆菌属Clostridium、罗斯氏菌属Rothia、毛螺菌科NK4A136组Lachnospiraceae_NK4A136group等。其中,真杆菌属、普雷沃氏菌属、乳酸杆菌属和瘤胃球菌属是各组大鼠肠道菌群属水平的主要构成物种。在空白对照组、模型组、QJHGD治疗组中,真杆菌属的相对丰度分别为28.5%、40.2%、36.1%,普雷沃氏菌属的相对丰度分别为6.3%、19.5%、33.7%,乳酸杆菌属的相对丰度分别为9.4%、10.1%、21.3%,瘤胃球菌属的相对丰度分别为14.1%、4.6%、0.9%。
3.5.4 肠道菌群的α多样性分析 对各组大鼠肠道菌群的整体群落结构差异进行α多样性分析,结果如表3所示。3组样本的测序深度指数Coverage均达到0.996±0.001,这表明本研究测序深度足够深,绝大多数细菌能得到有效检测和覆盖。菌群丰度指数Ace和Chao1是表征菌群相对丰度的指标[16]。本研究结果显示,与空白对照组比较,模型组Ace指数显著降低(P<0.05);与模型组比较,QJHGD治疗组Ace、Chao1指数显著降低(P<0.05),这表明大鼠肠道菌群整体结构发生了变化。Shannon、Simpson是可以反映α多样性的指数,可表征微生物多样性的丰富程度;二者值越大,表明群落中微生物多样性越高,反之,表明微生物多样性越低[17]。本研究结果显示,与空白对照组比较,模型组Shannon指数显著升高(P<0.05);与模型组比较,QJHGD治疗组Shannon、Simpson指数均显著降低(P<0.05)。
表3 各组样本α多样性分析的相关指数统计结果(±s,n=10)

表3 各组样本α多样性分析的相关指数统计结果(±s,n=10)
a:与空白对照组比较,P<0.05;b:与模型组比较,P<0.05
组别空白对照组模型组QJHGD治疗组Simpson 0.949±0.026 0.925±0.120 0.693±0.251b Coverage 0.996±0.001 0.996±0.001 0.996±0.001 Ace 995.131±87.267 972.319±184.121a 385.374±90.838b Chao1 963.937±80.068 950.334±186.453 390.509±95.783b Shannon 5.447±0.506 6.166±1.523a 3.245±1.503b
3.5.5 肠道菌群β多样性分析 肠道菌群β多样性分析结果显示(图5),各组组内聚集性良好,表明同组样本内部菌群结构的相似性较强。空白对照组和模型组之间的菌群结构有一定差异;QJHGD治疗组与模型组呈现出明显的分离趋势,且给药后菌属分布的离散程度大于给药前,这表明经QJHGD干预后,组间样本菌群结构差异较大,这也与“3.5.2”项下分析结果一致。

图5 各组样本β多样性分析结果
4 讨论
SAP是多种病因影响下由急性胰腺炎发展来的临床急危重症,也是胃肠道疾病患者住院的主要原因之一,目前无特效治疗药物。根据2021年中国急性胰腺炎指南推荐,SAP早期治疗策略之一是使用质子泵抑制剂来抑制胃酸分泌,减少胰腺分泌[17]。胃酸屏障是维持胃肠道微生物稳态的关键,抑酸剂及其他药物的频繁使用会改变消化道内腔环境,使得肠道菌群失调和固有免疫系统失衡,从而加重炎症级联反应,导致胰腺坏死、肠黏膜损伤加重[18]。有研究表明,肠道菌群失调与SAP明显相关,其机制之一是肠道菌群紊乱引起肠黏膜的过度免疫反应和持续炎症,使得肠黏膜屏障破坏、肠内细菌移位,继而导致胰腺、胰周感染及脓毒血症等,引起SAP患者“第2个死亡高峰”,因此及时有效地维持肠道屏障生理功能、纠正肠道菌群失衡对于防治SAP极为关键[19]。中医药全程干预不仅可以抑制炎症因子过度释放,遏制瀑布样级联效应,还可在改善SAP肠梗阻、修复肠屏障、抑制肠道菌群移位等方面发挥有益作用[20]。中医理论认为,SAP属湿热瘀浊绞结于中焦,腑气不通,耗气伤阴,日久成毒;针对早期SAP的“热、毒、湿、瘀”浊邪,治疗当“清热化湿解毒、化瘀攻下存阴”并举[21]。QJHGD是遵从上述治则、长期广泛使用且确有疗效的临床协定处方,由柴胡、大黄、厚朴、黄芩、木香、桃仁、枳实等组合而成,具有清热化湿、解毒化瘀的功效。
本研究结果显示,与空白对照组比较,模型组大鼠血清中促炎因子血清淀粉酶、IL-10、IL-18、IL-1β水平显著升高,胰腺和小肠组织结构破坏、水肿分裂,表明造模成功;经QJHGD干预后,治疗组大鼠血清中血清淀粉酶、IL-18水平较模型组显著降低,胰腺和小肠组织病理形态得到改善。
肠黏膜屏障是肠道防止肠内有害物质如细菌和毒素穿过肠黏膜进入体内组织、器官和血液循环的统称,由生物屏障、化学屏障、机械屏障和免疫屏障构成[22]。肠上皮细胞是维持肠黏膜机械屏障的结构基础,包含了Occludin、ZO-1及黏附连接分子等组成的紧密连接复合体。Occludin是内皮细胞屏障功能正常的象征性蛋白,主要参与肠壁通透性的调节;ZO-1属于膜结合鸟苷酸激酶家族,在维持肠屏障紧密连接体系中发挥关键作用,是评价肠道通透性的重要指标[23]。HMGB1是高迁移率蛋白家族成员之一,是组织激发炎症反应的主要因子,与晚期糖基化终产物受体、Toll样受体结合后,可激活下游炎症信号通路参与病情进展,可作为急性胰腺炎病情严重程度的标志性反应因子,同时也是肠黏膜屏障损害的重要参考指标[24]。本研究结果显示,与空白对照组比较,模型组大鼠小肠组织中HMGB1蛋白表达水平显著升高,Occludin、ZO-1蛋白表达水平显著降低,这表明模型组大鼠肠黏膜紧密连接完整性和屏障功能受损;经QJHGD干预后,大鼠小肠组织中HMGB1蛋白表达水平显著降低,Occludin、ZO-1蛋白表达水平均显著升高,这表明QJHGD可有效恢复肠黏膜屏障损伤。
作为肠道菌群中的两大优势微生物,厚壁菌和拟杆菌参与了机体能量代谢、脂肪存储等过程,厚壁菌/拟杆菌的比值(F/B)反映了机体能量吸收与贮存的能力,是肠道稳态的生理性指标之一,该比值越低则肠道菌群越稳定[25]。本研究结果显示,QJHGD治疗组厚壁菌相对丰度较模型组降低,而拟杆菌相对丰度较模型组升高,由此可知QJHGD治疗组F/B数值降低,这说明QJHGD可调节肠道菌群紊乱,改善肠道微生态失衡。拟杆菌作为革兰氏阴性菌之一,其死亡后会裂解脱落形成脂多糖,脂多糖与结合蛋白、细胞表面CD14结合后,可激活以核因子κB为代表的癌症信号转导通路,促进多种促炎因子的释放,进而导致内毒素血症及全身炎症级联反应[26]。变形菌包含了很多潜在的致病菌,其相对丰度升高可增加肠道对炎症的敏感性,该类菌群相对丰度升高也是肠道菌群失调的标志[27]。但本研究却发现,相比于空白对照组,模型组变形菌相对丰度明显降低,这与理论情况不一致。笔者推测可能是样本量较少而引起的测序误差,后续可重复实验进一步考察该菌群结果的可靠性。普雷沃氏菌能够利用富含纤维的碳水化合物产生短链脂肪酸,从而发挥抗炎作用;乳酸杆菌可参与机体的免疫调节,其繁殖过程可产生低能脂肪酸,从而有效降低肠道pH值,抑制大肠杆菌、产气荚膜菌等有害菌群的生长[28-29]。乳酸杆菌还可通过刺激免疫相关Toll样受体、T细胞转录因子等的活化,抑制促炎因子如IL-6、IL-1β的释放,进而保护肠黏膜屏障的完整性,影响黏膜免疫功能[30]。本研究结果显示,QJHGD可上调SAP模型大鼠肠道普雷沃氏菌属、乳酸杆菌属等菌落结构;在ELISA实验中也得出,QJHGD可下调促炎因子血清淀粉酶、IL-18、IL-1β水平,并上调抑炎因子IL-10水平,这与胡炜等[31]研究结果一致,表明QJHGD可增加益生菌群的相对丰度,减少有害菌群定植,减少炎症因子释放,从而维护肠稳态。在菌群α多样性分析中,与空白对照组比较,模型组Simpson反而降低,基于菌群真实世界测序结果,我们推测这种反差可能是由样本抽样误差和群落内部菌群分布不均匀引起,后续本课题组将加大测序样本量,以验证该结果。综上,QJHGD对SAP模型大鼠菌群的相对丰度和多样性均有一定的调节作用,能够改善肠道菌群结构,优化物种多样性。
总之,QJHGD可有效抑制SAP模型大鼠胰腺及小肠组织的炎症反应,可通过上调小肠组织中ZO-1、Occludin的表达,下调HMGB1蛋白的表达,改善肠黏膜屏障损伤;并通过升高拟杆菌门、乳酸杆菌属等益生菌群的相对丰度,减少厚壁菌门等有害菌群的定植发挥保护肠道的作用。

