温阳化浊通络方含药血清抑制硬皮病患者Th17细胞增殖的作用机制研究Δ
郭克磊,李颖利,卞博,韩立,李凯,张红,卞华#(.南阳理工学院张仲景国医国药学院,河南 南阳 47004;2.南阳理工学院河南省张仲景方药与免疫调节重点实验室,河南 南阳 47004;.南阳市中心医院风湿免疫科,河南 南阳 47000)
硬皮病又名系统性硬化病,是以皮肤和内脏器官纤维化为主要特征的自身免疫性疾病,其发病机制主要包括纤维化、免疫炎症、血管损伤等,而免疫系统失调特别是辅助性 T 细胞 17(T helper lymphocytes 17,Th17)/调节性T细胞(T regulatory cell,Treg)失衡在硬皮病发病及病程进展中起着重要作用[1]。表观遗传学研究发现,转录因子RORγt(又名RORC或RORC2)基因启动子低甲基化水平会导致维甲酸相关孤核受体(retinoic acid related nuclear orphan receptor,RORγt)的高表达,进而促进Th17分化,如在硬皮病患者Th17细胞中就存在RORγt基因低甲基化、蛋白高表达的现象[2-3]。
中医学中无硬皮病这个病名,其应属皮痹等范畴。本课题组前期突破硬皮病的传统治疗观点,率先提出“肺脾肾-皮毛”相关理论。结合硬皮病的临床表现,本课题组认为硬皮病病性属本虚标实——本虚是肺脾肾三脏之阳气虚,标实是寒邪凝结、湿痰瘀等浊邪阻络,脉络不通;病位在络脉,与肺脾肾密切相关[4]。温阳化浊通络方是以黄芪桂枝五物汤、补肺汤、二仙汤等为基础创制而成,由黄芪、党参、桂枝、淫羊藿、积雪草、白芥子等10味药材组成。诸药相伍,通补并用,标本兼顾,具有补肺健脾益肾、化浊通络之效,共奏扶正祛邪之功,对硬皮病具有良好的疗效[5]。本课题组前期研究表明,温阳化浊通络方能够调节硬皮病患者外周血Th17/Treg失衡,降低Th17细胞数量及白细胞介素17(interleukin 17,IL-17)水平,同时其还可通过下调微小核糖核酸-155、IL-6及酪氨酸激酶2、信号转导和转录激活因子3等的表达,从而抑制Th17细胞增殖[6-8]。本研究拟在前期研究基础上,进一步采用血清药理学的方法,通过观察温阳化浊通络方含药血清对Th17细胞增殖、RORγt mRNA及其蛋白表达、RORγt基因甲基化的影响,探讨其治疗硬皮病的作用机制,为温阳化浊通络方防治硬皮病提供理论参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括ABI Veriti 96W型梯度聚合酶链式反应(PCR)仪、ABI ViiA7型实时荧光定量PCR仪、NanoDrop 2000型核酸蛋白浓度分析仪(美国Thermo Fisher Scientific公司),Synergy H1型全功能酶标仪(美国BioTek公司),GloMax 20/20型发光检测仪(美国Promega公司),Mini-PROTEAN 3型蛋白电泳仪、Gel Doc XR+型凝胶成像分析系统(美国Bio Rad公司),FACSCelesta型流式细胞仪(美国BD公司)。
1.2 主要药品与试剂
黄芪(批号180830,产地为山西)、党参(批号20180701,产地为山西)、山药(批号180601,产地为河南)、淫羊藿(批号181001,产地为四川)、熟地黄(批号180301,产地为河南)、桂枝(批号180901,产地为广西)、积雪草(批号180804,产地为云南)、白芥子(批号180802,产地为河南)等饮片均购自河南省张仲景大药房,经南阳理工学院张仲景国医国药学院张超云副教授鉴定均为真品。甲基化转移酶抑制剂地西他滨(decitabine,DCA)原料药(批号S1200,纯度>99.93%)购自美国Selleck公司;CCK-8试剂盒(批号C0038)、BCA蛋白定量试剂盒(批号P0012)购自上海碧云天生物技术有限公司;双荧光素酶检测试剂盒(批号E1960)购自美国Promega公司;第一链cDNA合成试剂盒(批号K1622)、LipofectamineTM3000转染试剂(批号1887047)购自美国Thermo Fisher Scientific公司;荧光定量PCR试剂SYBR Green(批号04913914001)购自德国Roche公司;DNA提取试剂盒(批号B618503)、DNA纯化试剂盒(批号B610367)、琼脂糖(批号A600014)、UNlQ-10柱式Trizol总RNA抽提试剂盒(批号B511321)均购自生工生物工程(上海)股份有限公司;人IL-17酶联免疫吸附测定(ELISA)试剂盒(批号E-EL-H0103c)购自武汉伊莱瑞特生物科技股份有限公司;RORγt兔多克隆抗体(批号DF3196)购自江苏亲科生物研究中心有限公司;甘油醛-3-磷酸脱氢酶(GAPDH)鼠单克隆抗体(批号AC002)购自武汉爱博泰克生物科技有限公司;辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白G(IgG)二抗(批号5220-0336)、HRP标记的羊抗鼠IgG二抗(批号074-1806)购自美国KPL公司;DNA甲基化修饰试剂盒(批号D5030)购自美国Zymo公司;热启动DNA聚合酶(批号M0490S)购自美国New England Biolabs公司;其余试剂均为分析纯,水为超纯水。
1.3 动物
本研究所用动物为健康SPF级Wistar雌性大鼠,共60只,7~8周龄,体质量为220~250 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2016-0011。大鼠饲养于温度为(24±2)℃、相对湿度为(50±10)%、昼夜交替(12 h/12 h)的环境中。饲养期间大鼠自由摄食、饮水。本研究动物实验经南阳理工学院伦理委员会审核批准,批准号为南理工动伦审〔2018〕011号。
1.4 Th17细胞
Th17细胞来源于2018年3月-2019年7月在南阳市中心医院确诊并接受治疗的硬皮病患者血液样本。经患者知情同意后,抽取其外周血5 mL,由南阳理工学院张仲景国医国药学院韩立老师分选Th17细胞并通过流式细胞仪验证其纯度为96%~98%[9]。本研究临床血液样本的获取符合相关临床试验研究法规、规范及《赫尔辛基宣言》要求,并经南阳市中心医院医学伦理委员会审查、批准后实施(伦理批件号为2017-11-10-01)。
1.5 质粒
pGL3-Basic-luc载体质粒(批号E1751)、海肾荧光素酶RL-TK质粒(批号E2241)均购自美国Promega公司。
2 方法
2.1 温阳化浊通络方水煎液的制备
按温阳化浊通络方组成称取相应量饮片,加10倍量水(mL/g,下同)浸泡1 h,武火煎煮开以后文火煎30 min,收集药液;药渣再加10倍量水以文火煎30 min,收集药液。合并2次煎煮液,浓缩得到生药量为1.5 g/mL的水提物(得率为43.44%)。经高分辨质谱法测定,其中主要含淫羊藿苷(0.98%)、积雪草苷(0.20%)、芥子碱(0.07%)、黄芪甲苷(0.01%)等成分。
2.2 动物分组、给药及含药血清的制备
将60只大鼠随机分为空白对照组和温阳化浊通络方低、中、高剂量组,每组15只。温阳化浊通络方低、中、高剂量组大鼠分别按照15、30、60 g/(kg·d)[分别为成人临床等效剂量的1、2、4倍,按照成人临床日用剂量(141 g/d)及大鼠与成人体质量剂量折算系数(6.25)计算出大鼠的日用药量为15 g/kg(141 g/60 kg×6.25≈15 g/kg)]灌胃给药,空白对照组大鼠灌胃等体积生理盐水。早晚各给药1次,连续灌胃7 d。各组大鼠分别于末次灌胃给药30 min后,在麻醉状态下于股动脉采血,将各组大鼠的血样混合后在4℃下静置2 h,再以3 000 r/min离心10 min,吸取上清液,即得空白血清和含药血清。将血清用0.45 μm滤器过滤除菌,分装后置于-80℃冰箱中保存,备用。
2.3 CCK-8法检测Th17细胞增殖
将Th17细胞按每孔100 μL(2×103个细胞)接种到96孔板中,分为空白血清对照组,温阳化浊通络方含药血清低、中、高剂量组(后文简称含药血清低、中、高剂量组)和DAC组(阳性对照组),每组设置6个复孔;并另外设置空白孔(加100 μL无细胞培养基)。常规培养24 h后,空白血清对照组加入10%体积空白对照血清,含药血清低、中、高剂量组分别加入10%体积对应含药血清,DAC组加入1 μmol/L DAC和10%体积空白血清,处理48 h。每孔加入10%体积CCK-8溶液,于37℃下孵育2 h。采用酶标仪检测450 nm波长处各孔的吸光度(A),计算细胞增殖率:细胞增殖率(%)=(A给药组-A空白孔)/(A空白对照组-A空白孔)。实验重复3次。
2.4 qRT-PCR法检测细胞中RORγt、IL-17 mRNA的表达水平
将Th17细胞按每孔500 μL(1×105个细胞)接种到24孔板中,分组同“2.3”项下,每组设置3个复孔。常规培养24 h后,按“2.3”项下方法加药处理。处理48 h后,收集细胞,按照RNA抽提试剂盒步骤提取细胞中总RNA,并测定总RNA的浓度。取1 μg总RNA反转录合成cDNA,并以cDNA为模板进行PCR扩增。反应体系(20 μL)如下:cDNA模板1 μL,上、下游引物(10 μmol/L)各0.5 μL,SYBR Green 试剂10 μL,超纯水8 μL。反应条件如下:95℃热启动15 s;95℃变性5 s,60℃退火30 s,72℃延伸30 s,共40个循环。以GAPDH作为内参,采用2-ΔΔCt法计算各目的基因mRNA的表达水平。引物由生工生物工程(上海)股份有限公司设计并合成,引物序列及扩增产物长度见表1。

表1 引物序列及产物扩增长度
2.5 Western blot法检测细胞中RORγt蛋白表达水平
将Th17细胞按每孔1 mL(2×105个细胞)接种到12孔板中,细胞分组及给药处理方法同“2.3”项下。处理48 h后,在4℃下以2 000 r/min离心5 min,收集细胞。使用RIPA裂解液提取细胞中总蛋白,以BCA法测定总蛋白的浓度,加入上样缓冲液将总蛋白煮沸10 min变性。配制10%聚丙烯酰胺凝胶,取40 μg总蛋白上样,先在80 V电压下电泳30 min,待样品进入分离胶后,在120 V电压下电泳1 h;在200 mA电流下转移1 h至聚偏二氟乙烯膜上,以5%牛血清白蛋白在室温下封闭1 h;分别加入RORγt一抗(稀释比例为1∶2 000)、GAPDH一抗(稀释比例为1∶5 000),4℃孵育过夜;TBST漂洗5 min×5次,分别加入对应二抗(稀释比例均为1∶10 000),室温孵育1.5 h;TBST漂洗5 min×5次,ECL化学发光试剂显色并用凝胶成像分析系统拍照。使用Image J 1.52 a软件分析蛋白条带灰度值,以目的蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值表示RORγt蛋白的表达水平。实验重复3次。
2.6 ELISA法检测细胞上清液中IL-17蛋白表达水平
将Th17细胞按每孔1 mL(2×105个细胞)接种到12孔板中,细胞分组及给药处理方法同“2.3”项下。处理48 h后,在4℃下以12 000 r/min离心10 min,收集细胞上清液。按照ELISA试剂盒说明书操作步骤检测各组细胞上清液中IL-17蛋白表达水平。
2.7 甲基化特异性PCR法检测细胞中RORγt基因启动子甲基化水平
将Th17细胞按每孔1 mL(2×105个细胞)接种于12孔板中,细胞分组、给药处理方法同“2.3”项下。处理48 h后,收集细胞,采用柱式法提取细胞中总DNA,根据DNA甲基化修饰试剂盒方法进行DNA重亚硫酸盐处理将非甲基化的胞嘧啶(C)转变为尿嘧啶(U),甲基化的胞嘧啶(C)保持不变,回收并纯化DNA。使用在线工具MethPrimer 2.0(http://www.urogene.org)设计RORγt基因启动子区甲基化(methylated,M)与非甲基化(methylated,U)引物,甲基化特异性PCR引物由生工生物工程(上海)股份有限公司合成(引物序列及扩增产物长度见表1)。使用热启动DNA聚合酶进行甲基化特异性PCR反应,反应体系如下:DNA模板5 μL,dNTPs(10 mmol/L)1 μL,上、下游引物(10 μmol/L)各1 μL,热启动DNA聚合酶0.25 μL,反应缓冲液10 μL,用水补至总体积50 μL。反应条件如下:95℃热启动30 s;95℃变性15 s,58℃退火30 s,68℃延伸30 s,共35个循环;最后68℃延伸5 min。PCR反应结束后,产物上样于2%琼脂糖凝胶,在120 V电压下电泳20 min,使用凝胶成像分析系统拍照成像,并采用Image J 1.52 a软件分析DNA电泳条带的灰度值,并计算RORγt基因启动子甲基化水平:RORγt基因启动子甲基化水平=给药组条带灰度值/空白对照组条带灰度值。实验重复3次。
2.8 双荧光素酶法检测细胞中RORγt基因启动子转录活性
先将RORγt基因启动子片段克隆构建到pGL3-Basic-luc载体上,命名为pGL3-RORγt-luc,经生工生物工程(上海)股份有限公司测序正确后用于后续实验。将Th17细胞按每孔500 μL(1×105个细胞)接种于24孔板中,细胞分组同“2.3”项下。常规培养24 h后,每孔转染0.5 μg pGL3-RORγt-luc及10 ng RL-TK质粒,6 h后更换为新鲜培养基,同时细胞给药处理同“2.3”项下。处理48 h后,按照双荧光素酶检测试剂盒说明书步骤检测细胞中RORγt基因启动子的转录活性。
2.9 统计学方法
使用GraphPad Prism 9.0软件进行数据分析和作图。数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 含药血清对Th17细胞增殖的影响
与空白血清对照组[(100.700±6.500)%]比较,含药血清低、中、高剂量组和DAC组细胞的增殖率[(88.040±2.970)%、(75.182±4.216)%、(58.440±5.575)%、(58.440±5.575)%、(44.461±3.147)%,n=6]均显著降低(P<0.05),并且具有一定的剂量依赖趋势。
3.2 含药血清对细胞中RORγt、IL-17 mRNA表达的影响
与空白血清对照组比较,含药血清各剂量组和DAC组细胞中RORγt mRNA表达水平以及含药血清中、高剂量组和DAC组细胞中IL-17 mRNA表达水平均显著降低(P<0.05)。结果见表2。
表2 各组细胞(上清液)中RORγt、IL-17 mRNA及其蛋白表达水平的测定结果(±s,n=3)
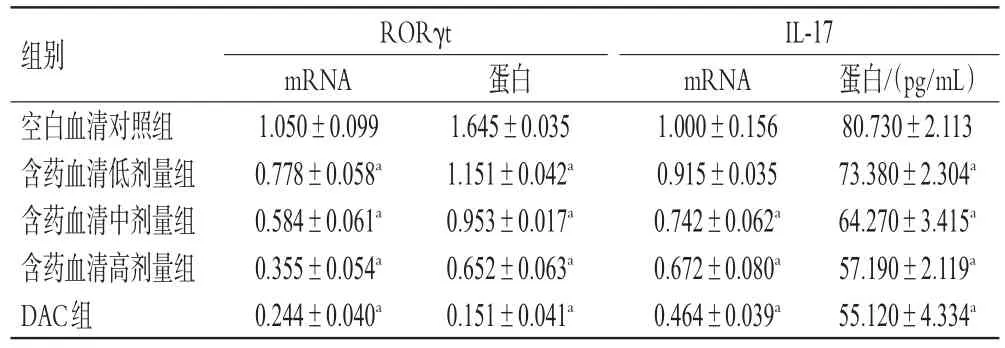
表2 各组细胞(上清液)中RORγt、IL-17 mRNA及其蛋白表达水平的测定结果(±s,n=3)
a:与空白血清对照组比较,P<0.05
组别空白血清对照组含药血清低剂量组含药血清中剂量组含药血清高剂量组DAC组蛋白/(pg/mL)80.730±2.113 73.380±2.304a 64.270±3.415a 57.190±2.119a 55.120±4.334a RORγt mRNA 1.050±0.099 0.778±0.058a 0.584±0.061a 0.355±0.054a 0.244±0.040a蛋白1.645±0.035 1.151±0.042a 0.953±0.017a 0.652±0.063a 0.151±0.041a IL-17 mRNA 1.000±0.156 0.915±0.035 0.742±0.062a 0.672±0.080a 0.464±0.039a
3.3 含药血清对细胞(上清液)中RORγt、IL-17蛋白表达的影响
与空白血清对照组比较,含药血清各剂量组、DAC组细胞(上清液)中RORγt、IL-17蛋白表达水平均显著降低(P<0.05)。结果见图1、表2。

图1 各组细胞中RORγt蛋白表达的电泳图
3.4 含药血清对细胞中RORγt基因启动子甲基化的影响
与空白血清对照组比较,含药血清中、高剂量组和DAC组细胞中RORγt基因启动子甲基化水平均显著升高(P<0.05)。结果见图2、表3。

图2 各组细胞中RORγt基因启动子甲基化检测的电泳图
3.5 含药血清对细胞中RORγt基因启动子转录活性的影响
与空白血清对照组比较,含药血清各剂量组和DAC组细胞中RORγt基因启动子的转录活性均显著降低(P<0.05),且具有一定的剂量依赖趋势。结果见表3。
表3 各组细胞中RORγt基因启动子甲基化水平及其转录活性测定结果(±s,n=3)

表3 各组细胞中RORγt基因启动子甲基化水平及其转录活性测定结果(±s,n=3)
a:与空白血清对照组比较,P<0.05
组别空白血清对照组含药血清低剂量组含药血清中剂量组含药血清高剂量组DAC组转录活性7.323±0.505 6.565±0.398a 5.600±0.450a 5.170±0.332a 4.140±0.512a甲基化水平1.000±0.050 1.017±0.032 1.133±0.031a 1.223±0.025a 1.467±0.061a
4 讨论
在血清药理学实验中,研究者通常会选择雄性大鼠或雌雄各半的大鼠来制备含药血清,但也有部分研究仅选用雌性大鼠来进行含药血清的制备[10]。因硬皮病的发病对象以女性为主(男女发病率之比为1∶3~1∶8)[11],为了避免雄性大鼠血清中某些成分对细胞的影响,也为了与临床研究对象保持一致[12],故本研究仅选用了雌性大鼠作为研究对象。DAC为DNA甲基化酶抑制剂,其可通过抑制DNA甲基化酶的表达起到抑制DNA甲基化的作用[13],因此本研究选择DAC作为阳性对照药。
Th17细胞是以分泌IL-17A为主的CD4+T细胞亚群,Th17细胞的异常增殖会促进IL-17等促炎因子的产生,引起组织损伤及纤维化[14]。转录因子RORγt是调节Th17细胞分化和发育的关键因子,其可与靶基因启动子结合,调节IL-17等炎症因子的表达,在自身免疫性疾病中发挥重要作用[15]。万琳琳等[16]研究发现,硬皮病患者外周血中Thl7细胞数量以及IL-17、RORγt表达水平明显高于非活动期硬皮病患者和正常人,并与活动期硬皮病患者病情活动度呈正相关。Okamoto等[17]研究发现,与正常小鼠相比,博来霉素诱导的硬皮病模型小鼠的皮肤和肺组织中Th17细胞浸润明显,血清、皮肤和肺组织中IL-17A和RORγt表达水平显著升高。上述研究表明,Th17细胞异常增殖及IL-17、RORγt在硬皮病患者体内表达上调在疾病进程中起着重要作用。由此可见,通过RORγt调节Th17细胞平衡可能是治疗硬皮病的潜在靶点。
本研究发现,温阳化浊通络方含药血清可抑制硬皮病患者外周血来源Th17细胞的增殖以及IL-17、RORγt mRNA及其蛋白的表达。梁娟等[18]发现,红花水煎液可通过降低硬皮病模型小鼠皮肤组织中RORγt蛋白的表达,抑制免疫炎症反应来发挥其抗皮肤纤维化的作用。其结果也表明,中医药可通过干预Th17细胞增殖、调节免疫反应来发挥治疗硬皮病的作用。但本课题组前期研究发现,温阳化浊通络方含药血清对正常人Th17细胞中RORγt mRNA及蛋白表达也有一定的抑制作用,说明温阳化浊通络方含药血清对硬皮病患者Th17细胞的作用可能是非特异性的。
DNA甲基化是表观遗传学修饰之一,在基因表达调控中起着重要作用,基因DNA高度甲基化会导致基因低表达,而低甲基化则使基因高表达[19]。Mazzoni等[2]发现,Th17细胞中RORC2基因启动子呈低甲基化水平,而初始T细胞和Th1细胞中RORC2基因启动子呈高甲基化水平,这提示RORC2基因甲基化水平的降低可能是初始T细胞和Th1细胞向Th17细胞转化的必要条件。由此可见,从调节RORγt基因甲基化的表观遗传学角度出发来调控Th17细胞数量,可作为硬皮病防治的新思路。本研究发现,温阳化浊通络方含药血清可以升高Th17细胞中RORγt基因启动子甲基化水平,并可抑制RORγt基因启动子转录活性,说明温阳化浊通络方含药血清可通过调节RORγt基因甲基化影响Th17细胞数量。
综上,温阳化浊通络方含药血清可通过促进RORγt基因启动子甲基化及下调RORγt基因转录活性,抑制RORγt表达及IL-17分泌,从而抑制Th17细胞的增殖。但是本研究也可能存在如下问题:(1)虽然通过制备含药血清可以更好地模拟中药的有效成分,更准确、科学地进行中药复方体外药效学和药理学评价[20],但是在血清中检测到的成分是否为有效成分很难确定,而且血清中化学成分含量复杂,给鉴定带来了巨大的困难[21]。(2)温阳化浊通络方含药血清对Th17细胞的作用具有非特异性,而Th17细胞的增殖及RORγt的表达受到多种方式的调节,后续还需深入研究温阳化浊通络方含药血清是否通过其他途径调节正常人及硬皮病患者Th17细胞增殖。

