阿苯达唑纳米混悬剂的研制及其评价
田 凯,许 丹,卢 迪,谢书宇,赵宝凯*
(1.沈阳伟嘉生物技术有限公司.沈阳110020;2.华中农业大学,武汉.430070)
阿苯达唑(albendazole,ABZ),别名丙硫咪唑,化学名称为5-丙硫基-1H-苯并咪唑-2-氨基甲酸甲酯,是苯并咪唑类的广谱抗寄生虫药,现已被世界卫生组织(WHO)认定成为抗棘球蚴病的首要药物之一。近年来临床应用广泛,且疗效得到了广泛认可[1]。遗憾的是,阿苯达唑溶解性低、首过效应强,在胃肠道吸收率极低,在血浆和肝脏组织中浓度不高,对非肠道寄生虫如细粒棘球蚴病等治愈率仅为30%[2]。目前市场上阿苯达唑经常使用的制剂类型以片剂、粉剂和混悬剂为主。混悬剂在给药途径上优于片剂和粉剂,但由于阿苯达唑溶解度较差,普通混悬液的生物利用度依然很低。目前阿苯达唑的溶解性低、生物利用度低等缺点已经严重制约其在兽医临床上的使用,因此开发新制剂技术提高其生物利用度非常必要。
纳米晶体(Nanocrystals,NC),是将水难溶性的药物或药物化合物在稳定剂的作用下分散于介质中(常以水为介质),利用机械研磨、高压均质、控制析晶等纳米化工艺,将药物粒径降低至 1 μm以下,使药物形成纳米胶体分散体系,可以明显使难溶性药物的溶解度及生物利用度得以改善。相比其他解决药物难溶性问题的方法,此方法不需要加入任何载体,只需在制备过程中加入稳定剂来稳定制备的纳米晶体,具有生产工艺简单、纳米混悬液制剂溶解性好、生物利用度高的优点,因此利用此方法可有效解决难溶性药物临床应用问题,有利于药物在肠道内吸收并延长药物的体内作用时间,从而提高难溶性药物的生物利用度[3-4]。
通过改变传统的混悬剂制备工艺,本研究利用反溶剂法-高压匀质法制备阿苯达唑纳米混悬剂,并考察该制剂的药剂学特征及稳定性;同时进行大鼠体内的药代动力学研究,考察其生物利用度,为提高阿苯达唑的临床效果提供新的策略。
1 材 料
1.1 药品与试剂 阿苯达唑对照品(含量99.9%,批号100373-201103),甲苯咪唑对照品(含量99.8%,批号H1032011),均购自中国兽医药品监察所;阿苯达唑亚砜对照品(含量99.07%,批号G119446),购自德国Dr.Ehrenstorfer GmbH公司;阿苯达唑原料(含量99.2%,批号9011806059),购自连云港亚晖医药有限公司;苹果酸,购自西安天正药用辅料有限公司;肝素钠、吐温80、苯甲酸钠均购自国药集团化学试剂有限公司;聚维酮K30(PVPK-30)(批号20180603),购自湖州展望药业有限公司。阿苯达唑伊维菌素粉(含量10%,规格250 g,批号2019040101),沈阳伟嘉生物技术有限公司;阿苯达唑混悬液(含量10%,规格100 ml,批号2019101701),佛山市正典生物技术有限公司。甲醇、乙腈,色谱纯;氢氧化钠、乙酸乙酯、冰醋酸、95%乙醇,分析纯;均购自国药集团化学试剂有限公司。
1.2 试验仪器 LC-1260高效液相色谱仪,美国AgiLent公司;分析天平MS105DU/A,梅特勒-托利多公司;PGC-01D型氮吹仪,天津艾维欧科技发展有限公司;UV-2501PC 紫外分光光度计,日本岛津公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;TGL-18C高速台式离心机,上海安亭科学仪器厂;XH-C涡旋混合器,常州迈科诺仪器有限公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;Zetasizer Nano-ZS90纳米粒度电位仪,英国马尔文仪器有限公司;高压匀质机APV2000,德国APV公司。
1.3 试验动物 清洁级 SD大鼠30只,雄性,体重200±20 g,由辽宁长生生物技术股份有限公司提供。试验前正常饲养1周,自由饮水和采食;并于试验前1 d检查确认试验动物处于良好的健康状态。
2 方 法
2.1 阿苯达唑纳米混悬剂的处方筛选 根据《兽药质量标准》(2017版)收载,阿苯达唑混悬液规格为100 mL:10 g。故本研究以阿苯达唑为主药,按照混悬剂制备要求,通过单因素试验进行纳米混悬剂中助溶剂、稳定剂的筛选[5]。通过粒径测定,最终确定L-苹果酸为助溶剂,吐温80 与PVPK-30为稳定剂,苯甲酸钠为防腐剂。
2.2 制备工艺 按照配方比例,先将助溶剂苹果酸用少量蒸馏水溶解,加热至80 ℃~90 ℃,将阿苯达唑原料加入其中,保持加热温度使其完全溶解于助溶剂溶液中;另称取稳定剂吐温80和PVPK-30溶于适量蒸馏水中,使用高速分散器在剪切条件下将溶解的阿苯达唑溶液缓慢加入稳定剂溶液中,使阿苯达唑重新结晶析出,通过剪切获得较小的粒径,得到制剂初混液。将制剂初混液置于高压均质机中,设定温度、压力及均质次数进行均质,即获得纳米混悬液。向制得的纳米晶体混悬液中加入适量已溶解的防腐剂,搅拌均匀并调节pH,最后加纯化水至全量,混合均匀即得。
2.3 纳米混悬剂的质量评价
2.3.1 纳米混悬剂的质量检测 参照《兽药质量标准》(2017版)中“阿苯达唑混悬液”的质量标准进行检查。检测项包括制剂的外观、色泽、pH值、沉降体积比及含量。重分散性检测项参照《药剂学》(第七版)中混悬剂“重新分散性”检测方法进行检查。
2.3.2 纳米颗粒形态及粒径分布 将纳米混悬液进行扫描电镜检测,观察药物形态特征。并测定纳米混悬液的粒径大小及分布。
2.3.3 制剂稳定性研究 参照《中华人民共和国兽药典》(2015版)中的“制剂稳定性试验指导原则”,对该纳米混悬剂进行常温、加速考察试验,定期6个月,研究该制剂在高温、高湿等条件下的稳定性。
2.4 药物动力学试验
2.4.1 药物动力学试验设计 将大鼠随机分为三组,一组给药阿苯达唑伊维菌素粉,一组给药本研究制备的阿苯达唑纳米混悬液,一组给药佛山正典的阿苯达唑混悬液,给药前12 h禁食,自由饮水,给药后6 h恢复进食。根据阿苯达唑在猪上的临床使用剂量,并参考相关文献[6],进行换算得出大鼠的使用剂量为45 mg/kg.bw,进行灌胃给药;三组药物给药前均用适量水稀释制成储备液备用,对每只大鼠进行称重标记,按照 2 mL/0.2 kg 大鼠体重进行灌胃。并于给药前、给药后0.5、1.5、3、4、5、6、7、8、12和24 h从尾静脉取血约0.5 mL置于肝素抗凝的离心管中,4000 r·min-1离心10 min,分离血浆,保存于-20 ℃,待测定。
2.4.2 大鼠血中阿苯达唑亚砜(ABZSX)的色谱条件 色谱柱:Ultimate®XB-C18,3 μm,4.6×250 mm;流动相(甲醇:乙腈 =1∶1)与水按照70∶30(V/V)的初始比例进行梯度洗脱,在 0~34 min水相比例由 70%→30%;在 34~40 min其比例由 30% →70%;检测波长 295 nm;流速1.0 mL·min-1;柱温 35±1 ℃[2]。
2.4.3 血浆样品处理 精确量取200 μL大鼠血浆,置于2 mL离心管中,依次加入 NaOH溶液50 μL(0.4 mol/L),甲苯咪唑(MBZ)内标溶液 100 μL(10 μg/mL)及1.0 mL乙酸乙酯,涡旋振荡 3 min,于12000 r·min-1离心10 min;吸取上清液置于另一离心管,并于第一管中再加入0.5 m L乙酸乙酯,重复前述操作进行涡旋振荡及离心,合并两次上清液,40 ℃氮气流吹干,残留物用200 μL甲醇乙腈混合液(V/V=1∶1)溶解,12000 r·min-1离心 10 min,取上清即为待测样品,进样量50 μL[2,7]。
2.4.4 血浆标准曲线的建立 精密量取空白血浆200 μL 9份,分别置 2 mL离心管中,留一支作为空白对照,其他分别加入等量的甲苯咪唑(MBZ)内标溶液,然后各加入不同量的阿苯达唑亚砜(ABZSX)标准工作液,得到药液浓度依次为0.01、0.02、0.05、0.2、1、3.5、7、10 μg/mL的标准血浆样品。按照“血浆样品处理”方法处理,进行HPLC分析,记录色谱图。以测得的ABZSX峰面积与内标MBZ峰面积的比值为横坐标(x),ABZSX浓度(y)为纵坐标,建立血浆中ABZSX标准曲线,拟合回归方程,求得相关系数(r)。
2.4.5 方法学验证 取空白血浆200u L,分别加入经稀释的高、中、低三个浓度的ABZSX标准工作液,混合均匀,以制成含ABZSX浓度分别是0.2、3.5、10 μg/mL的血浆样品,按照“血浆样品处理”方法处理,进行HPLC检测,每个浓度一天内制备5个平行样品检测,考察日内变异系数;连续重复检测5 d,测定日间变异系数。并计算方法的回收率、准确度及精密度。
2.4.6 大鼠血浆中药物浓度的测定 同一只鼠的血浆样品在同一分析批内完成,按照“血浆样品处理”方法处理检测,将得到的ABZSX的峰面积代入标准曲线回归方程,计算各时间点血浆中ABZSX的浓度。
2.5 数据分析 利用ExceL软件分析处理检测方法学数据,绘制血浆标准工作曲线及药-时曲线图;并利用药动学分析软件Winnonlin5.2以非房室模型处理血浆浓度-时间数据,获得的药动学参数以平均数±标准差(x±s)表示。
3 结果与分析
3.1 阿苯达唑纳米混悬剂的制备工艺 以纳米混悬液粒径为评价指标,根据配方筛选单因素试验结果,选择L9(34)表设计,进行正交试验,进一步优化匀质压力(A)、均质次数(B)、匀质温度(C)的工艺条件。正交试验各因素与水平、正交设计试验结果见表1,表2。
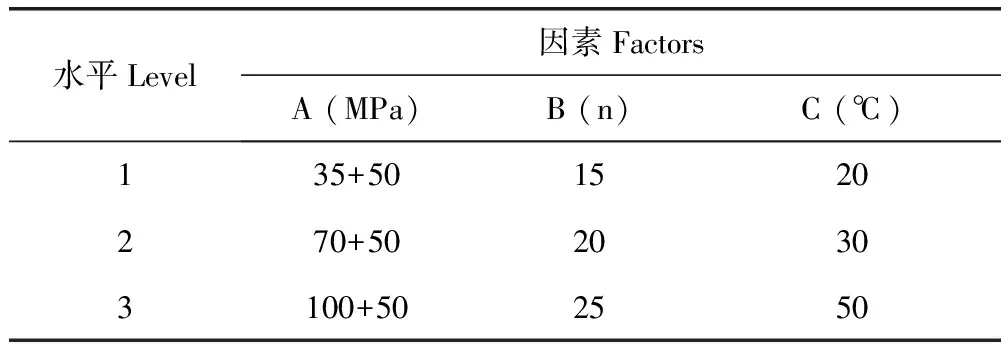
表1 正交设计试验的因素与水平
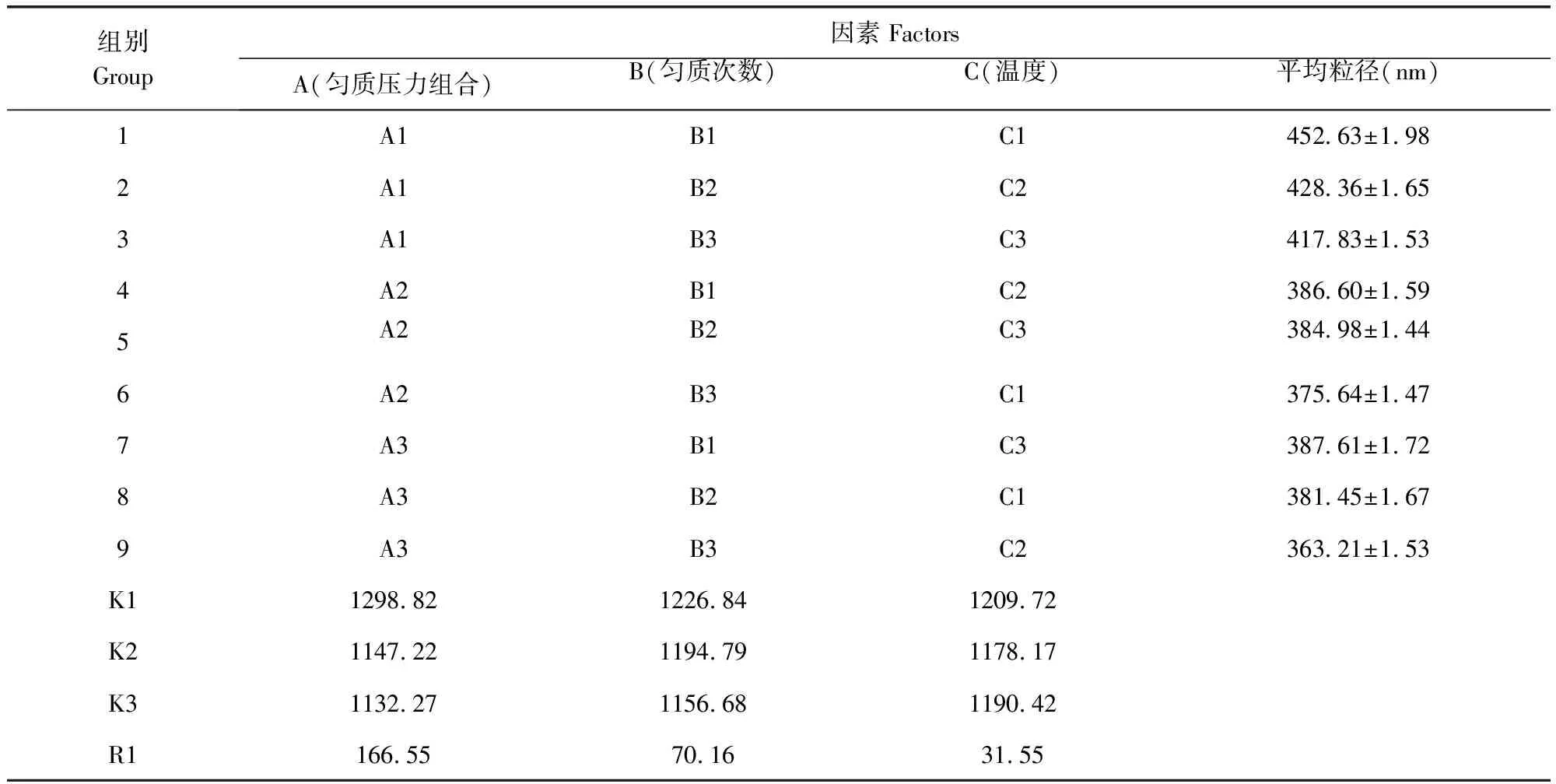
表2 正交设计表
纳米晶体粒径受各因素影响的主次关系为A>B>C,说明匀质压力对纳米晶体制备影响最大。根据正交试验结果,优选的工艺参数为温度30 ℃,100 MPa和50 MPa下各循环25次。同时为保证制备工艺的可行性,按照最佳工艺条件进行3次不同批量的重复试验,所得结果平均粒径为(365.43±1.68)nm,说明优选出的制备工艺稳定可行。
3.2 阿苯达唑纳米混悬液的质量评价
3.2.1 质量检测结果 该纳米混悬剂外观为类白色,长时间静置,性状无明显变化。pH值在5.0~7.0内,含量为99.6%,沉降体积比为0.99,符合规定。
室温下,将该制剂置于100 mL 具塞量筒中,密塞放置,沉降7 d后,并以20 次/min 的速度翻转量筒,底部沉降物随即消失,说明制剂重分散性较好。
3.2.2 形态观察与粒径分布结果 纳米混悬液在扫描电镜下药物形状大小均一,且中位粒径为358.1 nm。具体见图1、表3。

表3 阿苯达唑纳米混悬液的粒径分布
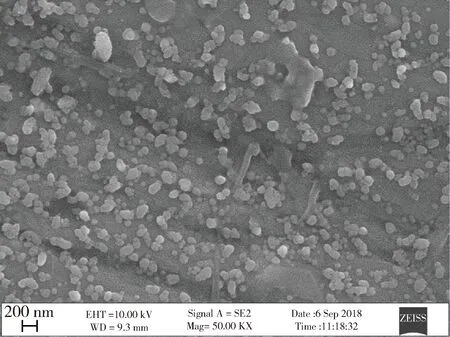
图1 阿苯达唑纳米混悬液扫描电镜图片
3.2.3 稳定性考察结果 将纳米混悬剂在温度30±2 ℃,相对湿度65±5%的条件下进行加速试验,并分别于1个月、2个月、3个月、6个月考察样品的各检测项,与常温放置样品比较均无明显差异。同时对放置6个月的样品进行粒径检测,结果显示粒径有所增加,但仍为纳米级,具体结果见表4、表5。
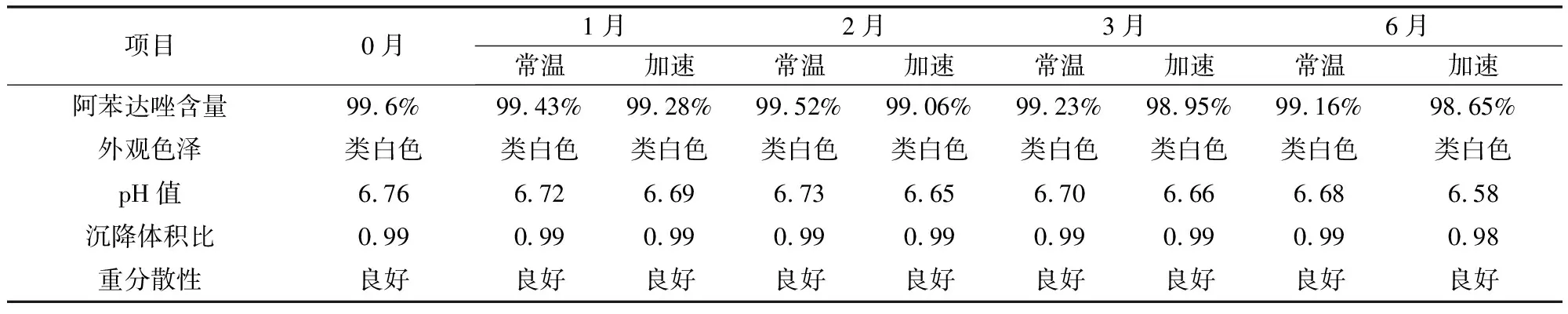
表4 阿苯达唑纳米混悬液加速试验结果

表5 阿苯达唑纳米混悬液的物理稳定性
3.3 阿苯达唑纳米混悬液在大鼠体内的动力学特征
3.3.1 方法专属性 阿苯达唑亚砜ABZSX在本试验所建立的色谱条件下,保留时间为9.7 min,基线平稳,药物峰形良好,均能与杂质峰良好分离,检测效率高。内标甲苯咪唑的保留时间为22 min,阿苯达唑保留时间为28 min。空白血浆色谱图如图2,空白血浆添加ABZSX(2ug/mL)、内标MBZ(10 μg/mL)、阿苯达唑ABZ(3 μg/mL)的色谱图如图3,样品血浆色谱图如图4。

图2 空白血浆色谱图

图3 空白血浆中添加ABZSX、MBZ、ABZ色谱图
图4 给药后血浆中ABZSX、MBZ、ABZ色谱图
3.3.2 血浆标准工作曲线 阿苯达唑亚砜(ABZSX)在 0.02~10 μg/mL浓度范围内,血浆药物浓度与ABZSX峰面积与内标峰面积二者比值呈良好的线性关系,回归方程为y=0.2501x+0.0147,相关系数r为0.9992。
3.3.3 方法学验证结果 阿苯达唑亚砜(ABZSX)在 0.02~10 μg/mL浓度范围内,该分析方法的回收率为83.39%~95.41%;日内变异系数均在6.29%以内,日间变异系数均在6.19%以内,精密度良好;检测限(LOD)、定量限(LOQ)分别为0.01、0.02 μg/mL。
3.3.4 药物动力学数据 大鼠口服三种制剂的各时间点平均血药浓度见表6,平均血药浓度-时间曲线见图5。采用非房室模型分析方法估算三种制剂的药动学参数及相对生物利用度,具体药物动力学参数见表7。
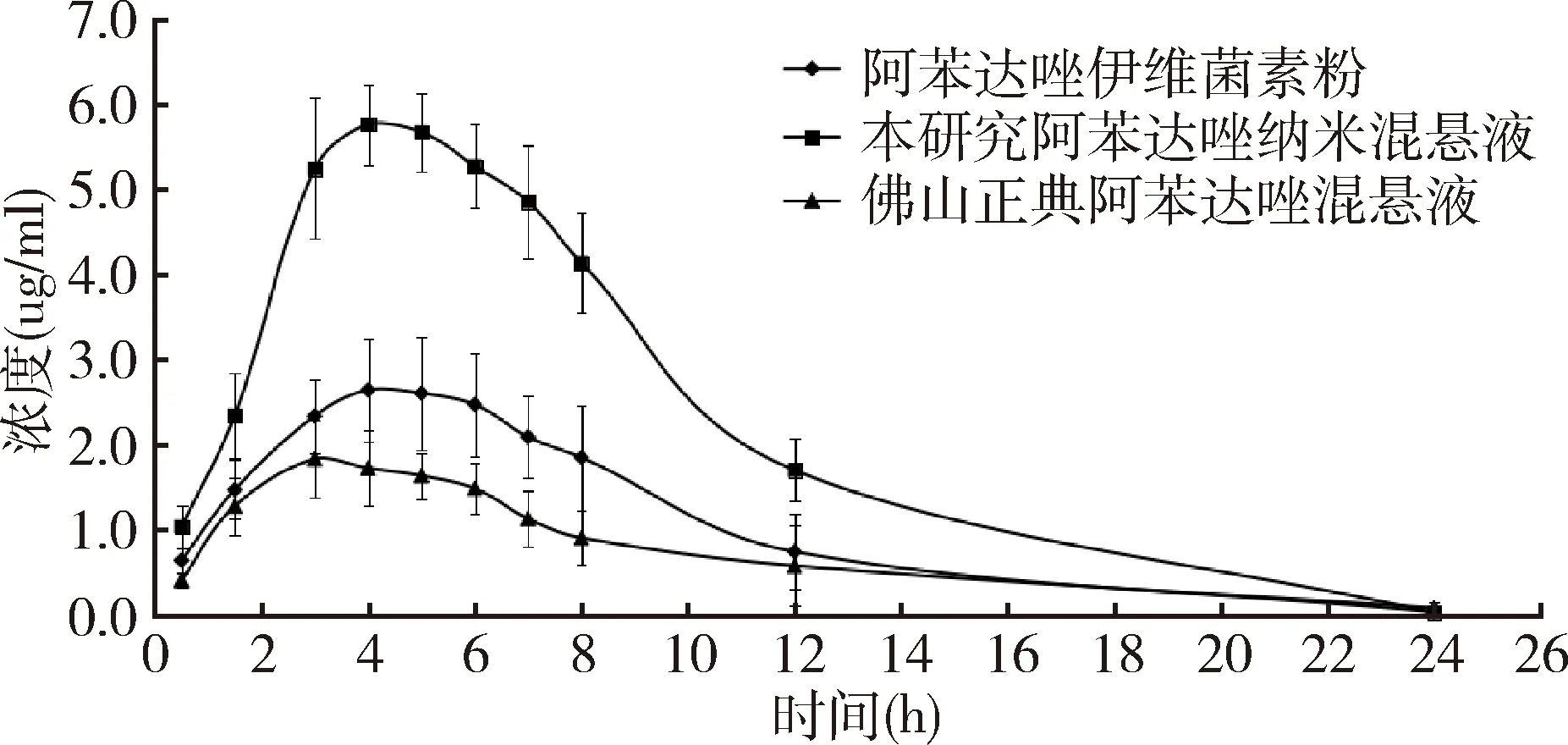
图5 大鼠口服阿苯达唑伊维菌素粉及2种混悬液(45 mg/kg.bw)后ABZSX的血药浓度-时间曲线

表6 大鼠口服阿苯达唑伊维菌素粉及2种混悬液(45 mg/kg.bw)后各时间点代谢产物ABZSX的血药浓度(n=10)

表7 大鼠口服阿苯达唑伊维菌素粉及2种混悬液(45 mg/kg.bw)后ABZSX的主要药动学参数(n=10)
研制的阿苯达唑纳米混悬液与阿苯达唑伊维菌素粉、佛山正典阿苯达唑混悬液的血药峰浓度Cmax分别为5.895、2.804、2.053 μg/mL,药物达峰时间 Tmax分别为 4.0、4.667和4.40 h,表明研制的阿苯达唑纳米混悬液药物峰浓度显著高于阿苯达唑伊维菌素粉及佛山正典阿苯达唑混悬液,吸收速率明显高于其他两种制剂;且其对阿苯达唑伊维菌素粉、佛山正典阿苯达唑混悬液的相对生物利用度分别为214.0% 和299.74%,表明研制的阿苯达唑纳米混悬液能显著提高阿苯达唑的生物利用度。
4 讨论与结论
纳米晶体是提高难溶性药物溶解度的有效策略之一[8],本研究纳米混悬剂制备工艺主要是将“Bottom-up”技术中的沉淀技术与“Top-down”技术中的高压均质技术联合起来使用,即反溶剂法-高压匀质法[9]。沉淀过程当中药物在析出时会产生结晶态颗粒的纳米晶体,或者产生无定型态的纳米晶体,在此两种形态的纳米晶体基础上,再次进行高压均质会较容易获得分散指数及粒径更小的纳米晶体。同时在药物沉淀过程中通过高速分散器剪切,使析出的纳米晶体通过初步剪切获得较小粒径,得到初混液,在将初混液进行高压匀质,避免需要更多的均质化循环和更大的循环压力使粒径降低,可节约时间减低机器磨损。
纳米混悬剂在配方上,改变了传统沉淀法是将药物溶解于有机溶剂中,稳定剂溶解至反溶剂(通常是水)中进行结晶析出的方法。传统沉淀法的缺点是需要将药物溶解在有机溶剂中,得到的纳米混悬液会残留有机溶剂,物理稳定性较差,易产生沉降聚集使药物负载量低[10]。本研究未采用有机溶剂,而是将药物溶解在助溶剂苹果酸溶液中,在保证药物性质稳定的加热条件下,进行溶解后,加入稳定剂水溶液中进行结晶析出。该制剂中辅料苹果酸可用于药物制剂,有利于药物在体内吸收、扩散,对机体有益。
本研究纳米混悬剂的质量评价及制剂稳定性研究结果表明,其符合《中国兽药典》2015版中对混悬液的质量要求,并在规定条件下进行加速试验6个月,经检测均符合质量要求,说明本研究阿苯达唑纳米混悬液具有很高的物理稳定性。
阿苯达唑口服后,被代谢为阿苯达唑亚砜ABZSX、阿苯达唑砜ABZSN及ABZSO2-NH2,其中最主要代谢产物为ABZSX,它也是抗棘球蚴病的活性成分[11]。大鼠体内的药物代谢动力学和相对生物利用度实验结果表明,口服本研究的阿苯达唑纳米混悬液与阿苯达唑伊维菌素粉、佛山正典阿苯达唑混悬液相比,体内的主要药动学参数 Tmax、Cmax、AUC0-∞、Vz_F、Cl_F、t1/2均有显著差异;本制剂的生物利用度显著高于粉剂(相对生物利用度 F为214.0 %)、佛山正典产品(相对生物利用度 F为299.74 %)。阿苯达唑属于浓度依赖性药物,药物浓度的提高将显著提高其临床治疗效果。
本研究中,大鼠单剂量(45 mg/kg.bw)口服阿苯达唑纳米混悬液后,纳米混悬剂组Tmax为4.0 h,Cmax为5.895 μg/mL;粉剂组Tmax为4.667 h,Cmax为2.804 μg/mL;纳米混悬剂相对粉剂组生物利用度为214.0%。与任洁如等[12]研究的大鼠单剂量(63 mg/kg.bw)口服阿苯达唑纳米微粉的结果基本趋势一致,即纳米微粉组Tmax为3.15 h,Cmax为6.11 μg/mL;原料药组Tmax为3.42 h,Cmax为3.20 μg/mL;纳米微粉相对原料药的生物利用度为157.0%;说明阿苯达唑纳米制剂可提高药物在体内的吸收速度和吸收量,以提高药物生物利用度,增强药物疗效。
综上,将阿苯达唑采用反溶剂法-高压匀质法制备的纳米混悬液,可获得更小的药物粒径,与阿苯达唑伊维菌素粉、佛山正典阿苯达唑混悬液相比,药物制剂粒径的减小使其更易迅速均匀的分散于胃肠液中,在胃肠道内吸收迅速且吸收量增加,提高药物生物利用度,增强驱虫效果。本研究将对阿苯达唑的新剂型研发和临床使用提供重要参考。

