半枫荷调控RA模型的非靶向代谢组学研究
王华坤, 肖方静, 宾万娟, 傅春青, 尹 丽,2*
( 1. 玉林师范学院 生物与制药学院, 广西 玉林 537000; 2. 玉林师范学院地产药用资源开发与生物工程技术中心, 广西 玉林 537000 )
类风湿性关节炎又称类风湿(rheumatoid arthritis, RA),是一种病因未明的以关节滑膜炎症病变为主的全身性慢性疾病,滑膜炎症、关节肿胀疼痛、软骨和骨损坏、功能受限为主要症状(Kowalik et al., 2018; Zulfiqar et al., 2019; Pandey et al., 2019),RA影响患者的生命周期、治疗周期长且医疗费用较高。临床上用于治疗RA药物主要有非甾体类抗炎(NSAIDS) (Zavodovsky & Sivordova, 2018; Malano & Strusberg, 2019; Abbasi et al., 2019)、改善病情抗风湿药(DMARDs)(Roodenrijs et al., 2018; Cacciapaglia et al., 2018; Khilfeh et al., 2019)、糖皮质激素(George & Baker,2019; Lillegraven et al., 2019)、生物剂制(Aletaha & Smolen, 2018)等,能够改善僵硬及减缓痛楚,但常出现物质代谢和水盐代谢紊乱、免疫耐受及胃肠道方面的副作用,不宜长期用药(Krüger, 2018; Wilson et al., 2019)。因此,研究人员将重点转向传统中药及方剂,筛选药性温和、毒副作用少、活性成分和作用机制比较明确的中药缓解病患痛苦。
半枫荷()为金缕梅科半枫荷属,全株入药,是中国特有的单种属植物(国家中医药管理局中华本草编委会, 1999)。药用半枫荷始载于《岭南采药录》,具有活血化瘀止痛、温经散寒除湿的作用(南京中医药大学, 2006),主治“肢体麻痹、风湿腰腿痛、跌打损伤、关节不利、半身不遂、产后风瘫”等,为民间验方的组成之一,广泛使用于苗族、瑶族、畲族、壮族等多个民族,有着悠久的临床用药历史和确切的疗效(中国科学院中国植物志编辑委员会, 1984; 国家中医药管理局中华本草编委会, 1999; 中国科学院广西植物研究所, 2005)。广西壮族民间用半枫荷煎汤当茶饮,治疗类风湿性关节炎疗效甚佳,临床上以金缕梅科半枫荷最为常用且抗风湿效果最佳(Liang et al., 2015; Yang et al., 2016)。由于半枫荷资源稀少,分布零散,所以目前对半枫荷的研究属于起步阶段。叶兴状等(2020)分析了半枫荷转录组中的SSR位点信息,为分子标记辅助育种提供参考。田晓明等(2018,2021)先后采用UPLC-QTOF/MS分析半枫荷根不同部位化学成分及半枫荷不同组织间差异代谢物,发现瓜氨酸、胆酸、白藜芦醇和7-羰基豆甾醇等化学成分在根皮中含量最高,不同组织中差异萜类化合物主要为三萜化合物。廖娜等(2019)成功制备金缕半枫荷的总多酚并证实其具有显著的抗菌、抗氧化能力。蒋杨等(2021)发现半枫荷的水、醇提取物对小鼠具有明显的镇痛抗炎作用。目前,关于半枫荷的研究主要涉及遗传育种、化学成分和药理活性等方面,鲜少涉及代谢组学领域。
代谢组学可用于研究RA疾病特征和发病机制(Ma et al., 2018),采用代谢组学和动物病症模型相互结合的研究思路和方法,偏重应用现代分析手段考察类风湿性关节炎发展进程中的内源性小分子代谢物,阐明疾病发病机制和药物作用机制。本课题组前期通过图谱指认以及文献调研(梁伟红等,2015; 卢海啸等, 2015),明确了半枫荷抗类风湿性关节炎的药用部位为半枫荷根,抗炎镇痛天然活性物质含量丰富。同时,采用弗氏完全佐剂(CFA)诱导的大鼠类风湿性关节炎模型,以足肿胀、关节炎指数、大鼠体重增加、免疫器官指数、外周血液单核细胞中环氧合酶-2(COX-2)和5-脂氧合酶(5-LOX)表达水平及大鼠血清中炎性细胞因子表达为依据,初步证实半枫荷根正丁醇提取部位高剂量组具有显著的抗RA活性。半枫荷在广西少数民族地区使用广泛且疗效确切,但活性成分及作用机制不清,为了进一步阐明该壮药对RA调控作用,本研究借助UPLC/QTOF-MS对半枫荷根活性部位提取物给药前后RA模型大鼠血浆进行非靶向代谢组学分析,拟探讨以下问题:(1) 大鼠给药组和模型组血浆是否存在差异代谢物;(2) 差异代谢物富集在哪些信号通路;(3) 半枫荷正丁醇提取物主要通过调节哪些内源性代谢物水平从而调控RA。以期从内源性代谢物的角度为半枫荷根抗RA的开发利用提供科学依据。
1 材料与方法
1.1 药材
半枫荷 ()由玉林师范学院卢海啸教授采集并鉴定为金缕梅科半枫荷属植物半枫荷的干燥根。本课题组前期实验结果显示半枫荷根正丁醇提取部位高剂量组具有显著的抗RA活性,故选其作为该文实验用药。提取方法:干燥的半枫荷根药材经粉碎过筛,选用75%乙醇回流提取2~3次,每次0.5~1.5 h,合并提取液,减压浓缩得到浸膏,用水混悬后正丁醇进行萃取,合并3次萃取液用旋转蒸发仪回收溶剂并浓缩为稠浸膏即得,出膏率为10.67%。
1.2 动物
SPF级健康SD种雄性大鼠,体重(250±1) g,购自广西医科大学动物实验中心 [许可证号:SCXK(桂)2014-0002]。饲养条件:室温22~25 ℃,相对湿度:55%~70%。
1.3 试剂与仪器
ACQUITY UPLCBEH HILIC色谱柱(美国Waters公司);Triple TOF 6600+四级杆高分辨飞行时间质谱仪(美国SCIEX公司);Agilent 1290 Infinity超高效液相色谱仪(美国Agilent公司);RE-52A型旋转蒸发仪和SHZ-D (III)循环水真空泵(上海亚荣生化仪器厂);DZKW-S-8型水浴锅(北京市永光明医疗仪器厂);FW100型高速万能粉碎机(北京市永光明医疗仪器厂);Micro21R型台式高速冷冻离心机(美国Thermo公司);ZNCL-T型电热套(上海科升仪器有限公司);ABS型小动物气体麻醉机(上海玉研科学仪器有限公司);色谱纯甲醇和乙腈(德国Merck公司);弗氏完全佐剂(美国Sigma-Aldrich公司);Milli-Q 纯水系统(美国Millipore公司)。
1.4 方法
1.4.1动物给药及样品采集 24只雄性SD大鼠随机分为两组:模型组和给药1 h组(经预实验,选用半枫荷根正丁醇提取液给药1 h后取血),=12;大鼠右后足趾皮下注射0.1 mL CFA致炎造模,给药前12 h禁食不禁水。根据前期试验结果,半枫荷根正丁醇提取液给药剂量按5.4 g·kg体重计算,模型组给予等体积生理盐水;大鼠灌胃给药1次,给药后1 h后麻醉大鼠并经肝门静脉采集血样,模型组同法操作;用抗凝管采血,4 ℃ 4 000 r·min离心15 min,收集血浆并分装于离心管,液氮速冻后置于-80 ℃保存。
1.4.2 样本处理 吸取血浆100 μL置于不含抗凝剂的无菌Ep管中,加适量经预冷处理的甲醇/乙腈/水溶液(2∶2∶1,v/v),涡旋混匀后低温超声处理30 min,-20 ℃ 条件下放置10 min,4 ℃条件下以14 000离心20 min,真空干燥上清液,分析前加乙腈水溶液(乙腈∶水=1∶1,v/v)100 μL复溶,4 ℃ 条件下以14 000离心 15 min,取上清液5 μL进样分析。质控(quality control,QC)样本为所有血浆样本混合后取100 μL,同法处理。
1.4.3 数据采集 样品采用 Agilent 1290 Infinity超高效液相色谱系统(UHPLC)配合ESI源,ACQUITY UPLCBEH HILIC色谱柱(100 mm×2.1 mm,1.7 μm)在正负离子模式下进行数据采集。柱温 25 ℃;流速0.5 mL·min;进样量2 μL;流动相组成A为水+25 mmol·L乙酸铵+25 mmol·L氨水,B为乙腈。梯度洗脱程序如下:0~0.5 min,95% B;0.5~7 min,B从 95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%。HILIC 色谱分离后的 ESI 源条件如下:质谱参数为雾化气(GS1) 60 psi,辅助加热气(GS2) 60 psi,气帘气(CUR) 30 psi,温度(TEM) 600 ℃,毛细管电压(IS)±5 500 V(正负两种模式);TOF MS 扫描范围为60~1 000 Da,产物离子扫描范围为25~1 000 Da,TOF MS 扫描累积时间为0.20 s/spectra,产物离子扫描累积时间为0.05 s/spectra;二级质谱采用信息依赖型获取模式(IDA)获得,并且采用超高灵敏度模式,去簇电压(DP)±60 V(正负两种模式),CES碰撞能力叠加(35±15) eV。IDA 设置如下:排除4 Da内的同位素,每个循环监测的候选离子:10。采取随机顺序进行样本连续分析,可以避免仪器检测信号波动带来的影响,取等量的各组样品混合作为质控样本,每运行6个样本采集一次质控样本,以评价和监测系统稳定性及实验数据可靠性。
1.4.4 数据分析 UPLC/QTOF-MS导出原始数据,使用Progenesis(V2.3,UK)软件进行数据预处理,去躁、基线校准、峰对齐、峰识别、积分、精确保留时间、计算归一化峰强度。化合物鉴定基于精确质量数、二级碎片以及同位素分布,利用 PeakView(AB SCIEX,USA)提取差异代谢物的二级碎片质谱并借助HMDB(Human Metabolome Database)和 METLIN (metlin.scripps.edu)进行鉴定并验证。所得数据矩阵作统计分析,利用 MarkerView(AB SCIEX,USA)进行一级质谱的提取,经数据校正和归一化后导入SIMCA-P(14.0)进行PCA和OPLS-DA等多维统计分析。根据变量的VIP(variable importance in projection)>1和|Pcorr|(Pearson correlation)>0.52 为标准,挑选差异代谢物。SPSS(20.0)对筛出的变量进行两组独立样本检验,挑选<0.05的代谢物。KEGG pathway(https://www.kegg.jp/)数据库对血浆样品差异代谢物作通路富集分析,用独立样本检验比较给药前后试验组的差异。
2 结果与分析
2.1 血浆代谢物定性分析及化学分类归属
用UPLC-MS技术对所有血浆样本进行色谱分离及质谱分析,代谢物在正离子和负离子模式下得到很好区分。通过重叠比较质控样本总离子流色谱图(total ion chromatogram,TIC)(图1),发现各色谱峰的响应强度和保留时间基本重叠,说明实验进程中仪器误差引起的变异较小。经The Human Metabolome Database、Lipidmaps(V2.3)以及METLIN数据库定性分析,正负离子模式合并后共鉴定出321种代谢物,其中负离子模式鉴定出174种代谢物,正离子模式鉴定出192种代谢物。所有鉴定的代谢物(合并正负离子鉴定到的代谢物)根据其化学分类归属信息进行分类统计归为12种类型:有机酸及衍生物、脂类及类脂分子、有机杂环化合物、有机含氧化合物、核苷、核苷酸及类似物、苯环型化合物、有机氮化合物、有机硫化合物、苯丙烷类和聚酮酸类、未分类化合物。分类信息显示有机酸及其衍生物和脂类及类脂分子这2类代谢物数量占比均较高,在代谢物中分别占20.87%和15.89%(图 2)。
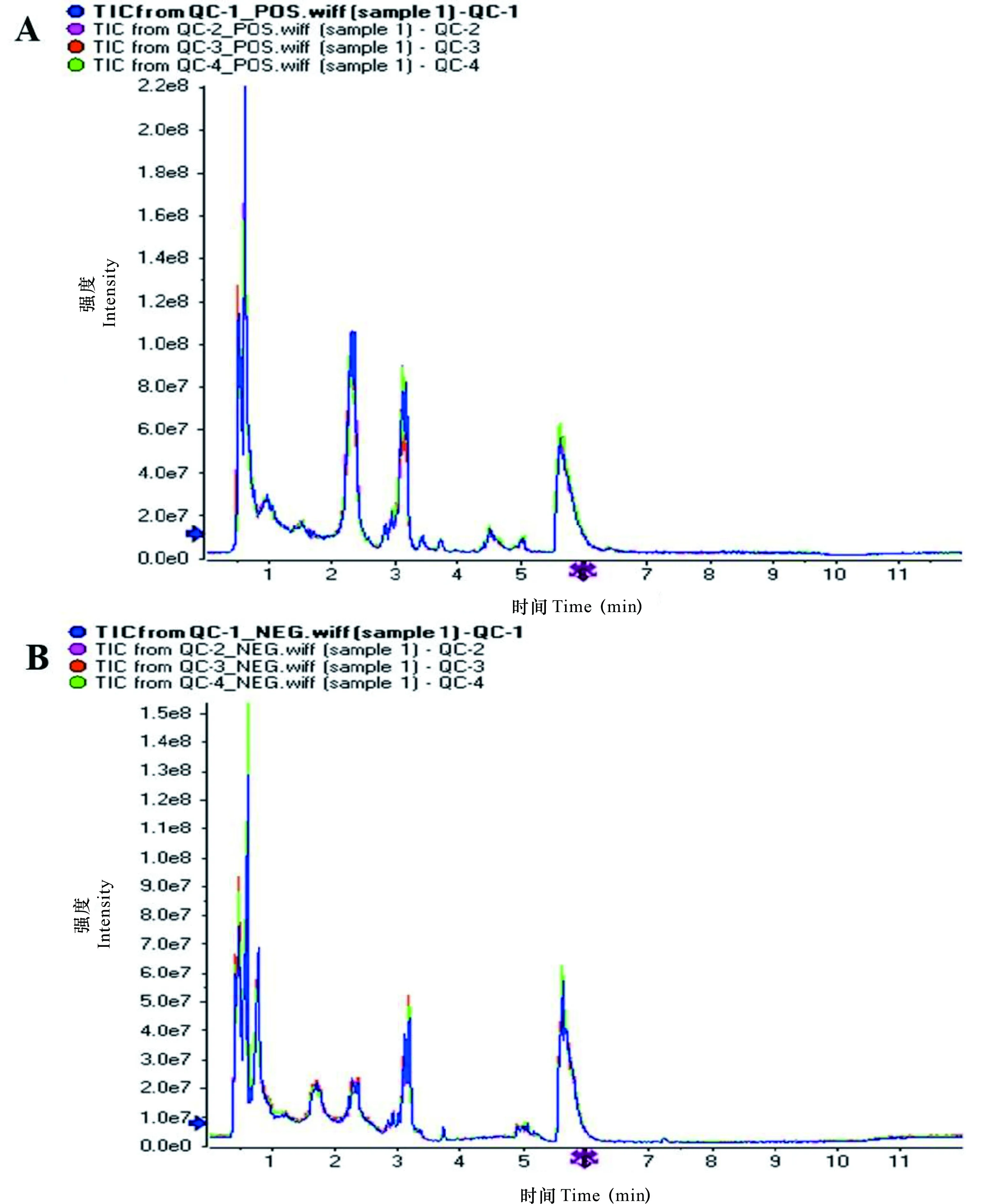
图 1 正离子(A)和负离子(B)模式血浆样本总离子流图Fig. 1 LC-MS total ion chromatography (TIC) of plasma samples in ES+ mode (A) and ES- mode (B)

A. 未分类化合物; B. 有机酸及衍生物; C. 脂类及类脂分子; D. 有机杂环化合物; E. 有机含氧化合物; F. 核苷、核苷酸及类似物; G. 有机含氮化合物; H. 苯环型化合物; I. 苯丙烷类和聚酮酸类; J. 有机氮化合物; K. 有机硫化合物; L. 苯丙烷类和聚酮酸类/生物碱及衍生物。A. Undefiend; B. Organic acids and derivatives; C. Lipids and lipid-like molecules; D. Organic oheterocyclic compounds; E. Organic oxygen compounds; F. Nucleosides, nucleotides and analog-ues; G. Organic nitrogen compounds; H. Benzenoids; I. Phenylpropanoids and polyketides; J. Organic nonitrogen compounds; K. Organic sulfur compounds; L. Phenylpropanoids and polyketides/alkalo ids and derivatives.图 2 鉴定的代谢物在各化学分类的数量占比Fig. 2 Percentage of identified metabolites by chemical classification
2.2 组间差异分析
2.2.1 单变量统计分析 分析给药组和模型组血浆代谢物差异,主要的单变量统计分析方法包含变异倍数分析(Fold Change Analysis,FC Analysis)、检验/非参检验。 单变量分析法对正、负离子模式下得到的所有代谢物(含未被鉴定的代谢物)做差异性分析,采用火山图(图3)的形式来进行可视化展示,玫红色表示FC > 1.5,< 0.05 显著差异代谢物(上调),蓝色表示FC<0.67,< 0.05 显著差异代谢物(下调)。

图 3 正离子(A)和负离子(B)模式火山图Fig. 3 Volcanic plots of ES+ mode (A) and ES- mode (B)
2.2.2 多元统计分析 非监督性的主成分分析(PCA)评价仪器和方法的稳定性,分析所有实验样本和质控样本提取得到的峰,如图4:A所示。在PCA图中,为决定PCA模型质量的主要参数,经过7次循环交互验证得知(cum)=0.579>0.5,质控样本聚集紧密,显示采集样品期间仪器稳定、方法稳定性和数据重现性较好,可进行下一步分析。另外,PCA图也显示给药组和模型组血浆分离完全,两组间代谢轮廓间存在显著性差异,给药组的代谢差异明显区别于模型组。之后建立偏最小二乘判别分析(PLS-DA)模型验证给药组和模型组之间的代谢谱分离状况。PLS-DA模型参数(cum)=0.997,(cum)=0.892>0.5,表明模型稳定可靠(图4:B)。为避免在建模过程中发生模型过拟合,对模型采用置换检验以保证模型的有效性。200次检测结果随着置换保留度逐渐降低,随机模型的和均逐渐下降,表明原模型不存在过拟合状况,模型良好稳健,可以据此结果筛选差异代谢物。借助监督性的OPLS-DA分析,进行潜在差异代谢物寻找,给药组和模型组(图4:C)分离完全,7次循环交互验证和200次响应排序检验的结果显示,(cum)=0.574,(cum)=0.963,=0.841,再次表明给药前后血浆代谢物之间的差异显著,OPLS-DA模型稳定可靠。同时,对该模型进行置换检验,随着置换保留度逐渐降低,随机模型的和均逐渐下降,没有过拟合(图4:D)。以上结果说明,在PCA模型、PLS-DA模型和OPLS-DA模型中给药组和模型组的血浆样本均存在显著性差异,所获得的数据可用于差异代谢物的筛选。本试验以 OPLS-DA VIP>1 和<0.1为显著差异代谢物筛选标准,最后一共筛选鉴定到12个潜在差异代谢物(表1),如D-甘露醇、3-甲基组氨酸、二乙醇胺、D-脯氨酸、鞘氨醇、胆酸、DL-苯丙氨酸等。鉴定到的显著性差异代谢差异倍数变化以柱状图直观展示(图5)。各代谢物在给药组和模型组血浆中的相对水平通过热图分析可视化(图 6)。

A. 总体样本主成分分析得分图; B. 偏最小二乘判别分析平面散点图; C. 正交偏最小二乘判别分析得分图; D. 正交偏最小二乘判别分析模型置换检验结果图。A. Score plot for PCA model; B. Score plot for PLS-DA mode; C. Score plot for OPLS-DA model; D. Validation plot of OPLS-DA model.图 4 给药组和模型组血浆代谢物多维统计分析结果Fig. 4 Multivariate statistical analysis of plasma metabolites in administration and model groups

表 1 正离子模式显著性差异代谢物表Table 1 Metabolite table with significant difference in positive ion mode

A. 四氢巴豆甾酮; B. L-色氨酸; C. 牛磺鹅(去氧)胆酸; D. 1-硬脂酰-2-油酰-sn-甘油-3-磷酸胆碱; E. N-二十二碳酰-4-鞘氨醇-1-O-磷酰胆碱; F. 1-棕榈酰-2-羟基-sn-甘油-3-磷酸乙醇胺; G. 1-硬脂酰-2-花生四烯醇-sn-甘油; H. 1,2-二油基-sn-甘油-3-磷脂酰胆碱; I. 甜菜碱; J. 二甲基砜; K. 牛胆素; L. L-苯丙氨酸; M. 尿素; N. L-组氨酸; O. 肌酸; P. 2-乙氧基乙醇; Q. 神经鞘氨醇; R. 3-羟基丁酸乙酯; S. 泛酸酯; T. L-缬氨酸; U. 烟酰胺; V. 甜菜醛; W. 尿嘧啶; X. 皮质酮; Y. 二乙醇胺; Z. (3-羧基丙基)三甲基铵阳离子; a. 1-甲基烟酰胺; b. 氧化三甲胺; c. 2-甲基丁基肉碱; d. 胆酸。A. Tetrahydrocroticosterone; B. L-tryptophan; C. Taurochenodeoxycholate; D. 1-Stearoyl- 2- oleoyl-sn-glycerol-3-phosphocholine (SOPC); E. N-Docosanoyl-4-sphingenyl-1-O-phosphorylcho-line; F. 1-Palmitoyl-2-hydroxy-sn-glycero-3-phosphoethanolamine; G. 1-Stearoyl-2-arachidonoyl-sn-glycerol; H. 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine; I. Betaine; J. Dimethyl sulf one; K. Taurine; L. L-Phenylalanine; M. Urea; N. L-Histidine; O. Creatine; P. 2-Ethoxyethanol; Q. Sphingosine; R. Ethyl 3-hydroxybutyrate; S. Pantothenate; T. L-valine; U. Nicotinamide; V. Betaine aldehyde; W. Uracil; X. Corticosterone; Y. Diethanolamine; Z. (3-Carboxypropyl) trimethylammonium cation; a. 1-Methylnicotinamide; b. Trimethylamine N-oxide; c. 2-Methyl butyroyl carnitine; d. Cholic acid.图 5 显著性差异代谢物表达差异倍数分析Fig. 5 Difference multiple analysis of significant metabolites expression
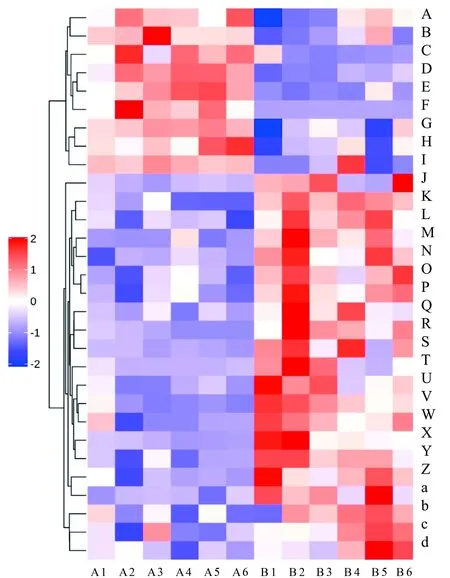
A. 甜菜碱; B. 1-棕榈酰-2-羟基-sn-甘油-3-磷酸乙醇胺; C. 牛磺鹅胆酸盐; D. 1-硬脂酰-2-油酰-sn-甘油-3-磷酸胆碱; E. L-色氨酸; F. 四氢巴豆甾酮; G. 1-硬脂酰-2-花生四烯醇-sn-甘油; H. 1,2-二油基-sn-甘油-3-磷脂酰胆碱; I. N-二十二碳酰-4-鞘氨醇-1-O-磷酰胆碱; J. L-缬氨酸; K. 牛胆素; L. 泛酸酯; M. 甜菜醛; N. 二乙醇胺; O. 2-乙氧基乙醇; P. 3-羟基丁酸乙酯; Q. L-组氨酸; R. 2-甲基丁基肉碱; S. 1-甲基烟酰胺; T. 胆酸; U. 尿嘧啶; V. 氧化三甲胺; W. 尿素; X. (3-羧基丙基)三甲基铵阳离子; Y. 肌酸; Z. 烟酰胺; a. 皮质酮; b. L-苯丙氨酸; c. 神经鞘氨醇; d. 二甲基砜。A. Betaine; B. 1-Palmitoyl-2-hydroxy-sn-glycero-3-phosphoethanolamine; C. Taurochenode- oxycholate; D. 1-Stearoyl-2-oleoyl-sn-glycerol 3-phosphocholine(SOPC); E. L-tryptophan; F. Tet-ahydrocroticosterone; G. 1-Stearoyl-2-arachidonoyl-sn-glycerol; H. 1,2-Dioleoyl-sn-glycero- 3-phosphatidylcholine; I. N-docosanoyl-4-sphingenyl-1-O-phosphorylcholine; J. L-valine; K. Taurine; L. Pantothenate; M. Betaine aldehyde; N. Diethanolamine; O. 2-Ethoxyethanol; P. Ethyl 3-hydroxy- butyrate; Q. L-histidine; R. 2-Methylbutyroylcarnitine; S. 1-Methylnicotinamide; T. Cholic acid; U. Uracil; V. Trimethylamine N-oxide; W. Urea; X. (3-Carboxypropyl)trimethylammonium cation; Y. Creatine; Z. Nicotinamide; a. Corticosterone; b. L-phenylalanine; c. Sphingosine; d. Dimethyl sulfone.图 6 大鼠模型组和给药组血浆差异代谢物热图分析Fig. 6 Heat map of difference metabolites of plasma differential metabolites in model and administration groups
2.3 差异代谢物通路富集
通路富集分析得知12种差异代谢物的37个通路有显著性差异(<0.05)。以气泡图形式呈现代谢通路富集分析结果(图7), 以横坐标和气泡大小的形式体现代谢通路的影响因子大小,气泡大小与影响因子成正比;以纵坐标和气泡颜色示意富集分析的值,颜色越深值越小,富集程度越显著。通路富集表明, 氨基酸代谢通路较为丰富,分别为甘氨酸,丝氨酸与苏氨酸代谢、氨酰-tRNA生物合成、氨基酸生物合成、-丙氨酸代谢、苯丙氨酸,酪氨酸和色氨酸的生物合成。此外,蛋白质的消化和吸收、肿瘤胆碱代谢通路和ABC转运蛋白富集到的差异代谢物数量最多。37个通路均表现为显著上调(表2)。

A. EGFR酪氨酸激酶抑制剂耐药; B. 癌症胆碱代谢; C. 非洲锥虫病; D. 脂肪细胞脂解; E. 鞘脂信号通路; F. 癌症中枢碳代谢; G. 蛋白质消化吸收; H. 逆行内酰苷信号; I. 矿质吸收; J. 泛酸和辅酶A生物合成; K. β-丙氨酸代谢; L. 醛固酮合成和分泌; M. 甘氨酸、丝氨酸和苏氨酸代谢; N. 氨酰tRNA生物合成; O. 初级胆汁酸生物合成; P. 嘧啶代谢; Q. 甘油磷脂代谢; R. 脂肪酸生物合成; S. ABC转运蛋白; T. 胆汁分泌。A. EGFR tyrosine kinase inhibitor resistance; B. Choline metabolism in cancer; C. African trypanosomiasis; D. Regulation of lipolysis in adipocytes; E. Sphingolipid signaling pathway; F. Central carbon metabolism in cancer; G. Protein digestion and absorption; H. Retrograde endocannabinoid signaling; I. Mineral absorption; J. Pantothenate and CoA biosynthesis; K. β-Alanine metabolism; L. Aldosterone synthesis and secretion; M. Glycine,serine and threonine metabolism; N. Aminoacyl-tRNA biosynthesis; O. Primary bile acid biosynthesis; P. Pyrimidine metabolism; Q. Glycerophospholipid metabolism; R. Fatty acid biosynthesis; S. ABC transporters; T. Bile secretion.图 7 大鼠给药组和模型组血浆差异代谢物KEGG通路富集分析Fig. 7 KEGG pathway enrichment analysis of plasma differential metabolites in administration and model groups

表 2 大鼠给药组和模型组KEGG通路富集分析Table 2 Enrichment analysis of KEGG pathways of administration and model groups
3 讨论与结论
针对鉴定得到的半枫荷活性部位调控疾病的差异代谢物及通路进行分析,可知佐剂型关节炎代谢异常化合物的种类错综复杂,涉及的代谢通路多且富集在脂类代谢和氨基酸代谢通路。半枫荷根正丁醇提取物主要影响氨基酸(如苯丙氨酸、脯氨酸、组氨酸和色氨酸等)、嘧啶(尿嘧啶)和脂类代谢产物(1-硬脂酰-2-花生四烯酰--甘油、二乙醇胺、神经鞘氨醇、D-甘露醇、1-硬脂酰-2-烯酰--甘油3-磷酸胆碱等)等内源性代谢物的表达水平。本研究表明,氨基酸、神经鞘氨醇、磷脂等内源性代谢物体内表达量与RA疾病发展息息相关,氨基酸代谢紊乱直接影响RA疾病进展。多种氨基酸介导炎症因子的产生,导致体内氨基酸水平甚至能够调控疾病疼痛程度。色氨酸可反映膝关节骨关节炎的存在和严重程度,色氨酸代谢增加,提示其机体内存在炎症反应。色胺酰-tRNA合成酶 (tryptophanyl-tRNA-synthetase,TTS)能介导色氨酸与tRNA特异性结合,催化合成的色胺酰-tRNA复合物直接构成了蛋白质合成的色氨酸储存库,在局部组织内激发色氨酸水平升高,进而刺激淋巴细胞的增殖和分化。外周血微环境中的色氨酸代谢途径失衡可通过激活RA患者自身反应性免疫细胞破坏自身组织,导致RA发病(Han et al., 2017)。陈双双等(2020)研究发现中医药方法治疗前、后,RA患者血清中的游离氨基酸表达水平具有显著性差异,治疗后患者血清谷氨酸、天冬氨酸及苯丙氨酸水平降低,-氨基酸、亮氨酸、色氨酸、牛磺酸及甘氨酸的水平升高明显,提示蛋白分解代谢增强,本实验研究结果与这些报道一致。3-甲基组氨酸为多肽链上的组氨酸经过甲基化所得的产物,属于动物骨骼肌蛋白分解代谢产物之一(Kochlik et al., 2018),可参与蛋白质消化吸收代谢,组氨酸能够治疗心脏病、贫血、风湿性关节炎等,RA患者适量多食用富含组氨酸食物有益于关节健康。本研究中半枫荷根正丁醇提取物降低了大鼠血浆中的3-甲基组氨酸含量,推测其通过抑制大鼠骨骼肌蛋白分解代谢,调控能量代谢,进而调节肌肉收缩功能障碍等原因,改善了给药组大鼠类风湿性关节炎症状。神经酰胺是炎症关键信号分子,神经鞘氨醇是神经酰胺细胞内的合成原料来源之一,被认为是细胞凋亡信号传导的一个机械性途径(mechanistic pathway)(Goins & Spassieva, 2018)。本研究表明鞘氨醇在给药组和模型组之间存在差异,给药组血浆内鞘氨醇水平降低,参与蛋白质消化吸收通路,表明鞘氨醇合成大量神经酰胺对炎症反应进行应答。D-甘露醇和D-脯氨酸参加ABC转运蛋白代谢通路,其作为渗透性脱水剂迅速提高血浆渗透压并能诱导细胞凋谢,两者水平在给药大鼠体内下调,缓解了体内血液渗透压,从而使半枫荷根正丁醇提取物达到改善关节炎的效果。文献显示,RA发病与体内脂质代谢异常同样存在密切关系。日常餐饮中改变脂肪成分能够影响机体内细胞膜脂肪酸构成,包括细胞免疫系统,而这些变化也可以改变膜的功能,进而影响风湿性疾病的发生和发展。脂肪酸的免疫调节功能参与代谢和免疫之间的相关性,作为一种信号分子,通过多种方式参与炎症和内质网应激信号通路,诱发炎症反应(Tong & Zhou, 2018)。Pang等(2018)采用血浆代谢组学技术评估CIA大鼠代谢变化,同样得出RA发病与脂质代谢异常相关这一结论。鞘氨醇等鞘脂代谢物参与RA等疾病的发展过程,调节免疫功能和炎症反应,揭示了本研究结果中RA模型组和给药组血浆内脂质代谢物表达差异的原因。本研究从内源性代谢物角度科学合理地解释半枫荷根正丁醇提取物对RA的调控方式,主要是通过调节与疾病发生密切相关的氨基酸和脂类等异常代谢物的表达水平而发挥作用。本研究结果可为半枫荷药用资源的深入开发提供新研究策略。

