副溶血性弧菌外膜蛋白BamA重组表达及其免疫原性分析
刘建欣,刘 蕾,郭珊珊,袁倩云,王文彬
(1.江苏省海洋生物技术重点实验室,江苏连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏连云港 222005;3.江苏海洋大学食品科学与工程学院,江苏连云港 222005)
弧菌是革兰氏阴性嗜盐菌,在海洋环境中分布广泛,是海产品中常见的食源性致病菌。食用致病性弧菌污染的食物通常会引起急性肠胃炎,重症患者则表现为脱水、休克昏迷甚至死亡。最常见的致病性弧菌包括副溶血性弧菌()、创伤弧菌()和霍乱弧菌(),其中创伤性弧菌对鱼类的致死率较高,副溶血性弧菌在海鲜中具有更高的流行率。此外,弧菌病是一种重要的海洋水产动物病害,已发现了50多种易感的水产动物,危害了海洋水产健康养殖,构成了重要的经济威胁。
弧菌诊断特异性抗原是建立准确、快速弧菌免疫检测手段的基础,也有助于弧菌病害的防控。外膜蛋白(outer membrane protein,简称Omp)因其基本功能、表面暴露性和在菌株中的保守性,常被用于疫苗的候选抗原。目前,已证实的弧菌属保守性和特异性较好的外膜蛋白较少,仍然需要新的弧菌属外膜蛋白。伦镜盛等分别重组表达了5种弧菌的外膜蛋白U(OmpU),来自副溶血性弧菌、创伤弧菌和拟态弧菌()的OmpU的小鼠免疫血清与13种弧菌发生交叉反应,与菌属外不发生免疫交叉反应,表明OmpU是弧菌保守的候选免疫抗原。副溶血性弧菌外膜蛋白VP1243在弧菌中广泛分布,具有高度保守性,诱导了对副溶血弧菌、溶藻弧菌和创伤弧菌的交叉免疫反应和免疫保护,是预防弧菌感染的多功能疫苗候选蛋白。Li等用同源和异源细菌免疫小鼠,采用免疫蛋白组学确定了弧菌外膜蛋白的多价疫苗候选物,发现了30~40种弧菌外膜蛋白。其中,重组外膜蛋白A(OmpA)和肽聚糖相关脂蛋白(Pal)对溶藻弧菌、嗜水气单胞菌和荧光假单胞菌均有免疫保护作用。
BamA作为跨膜桶状蛋白具有较好的表面暴露性,是β-桶状组装系统(BAM)家族的核心成分,目前在所有已测序的革兰氏阴性菌中均有发现。前期我们建立了生物信息学方法对副溶血性弧菌4 831个编码蛋白进行筛选,获得了101个位于外膜的蛋白,并通过表面蛋白质组检验筛选结果,2种方法均表明BamA是外膜蛋白,且该蛋白在弧菌属中具有广泛保守性,具有作为弧菌免疫检测抗原的潜力。目前,关于弧菌BamA的重组表达及免疫原性的研究未见报道,其作为诊断抗原和疫苗抗原的价值仍不清楚。因此,本研究进一步对BamA的保守性和基本结构进行分析,并通过生物信息学方法筛选特异性多肽,采用酶联免疫分析(ELISA)和免疫印迹评价其免疫BALB/c小鼠后血清与7株副溶血性弧菌、9种常见弧菌、发光杆菌等海洋细菌及其他常见细菌的交叉反应。
1 材料与方法
1.1 菌株、质粒及培养条件
本研究所用的菌株详见表1,于2019年4月在江苏海洋大学实验室中培养。原核表达载体pET-28a(+)为笔者所在实验室保存。副溶血性弧菌(CICC21617)用含3%NaCl的LB培养基(1.0%胰蛋白,0.5%酵母提取物,3.0% NaCl)在37 ℃条件下过夜培养。大肠杆菌DH5α和大肠杆菌BL21作为工程菌株,培养条件为LB培养基(1.0%胰蛋白,0.5%酵母提取物,1.0% NaCl)37 ℃过夜培养,用于重组质粒构建和蛋白质表达。将pET-28a(+)质粒载体转化到大肠杆菌DH5α中,保存备用。

表1 本研究所用菌株
1.2 主要试剂及仪器
限制性内切酶HⅠ和Ⅰ,均购自宝生物工程(大连)有限公司;弗氏完全和不完全佐剂、牛血清蛋白BSA,均购自Sigma公司;沉淀型四甲基联苯胺(TMB)底物缓冲液,购自广州捷倍斯生物科技有限公司;质粒抽提试剂盒、卡那霉素、异丙基--硫代半乳糖苷(IPTG)、DNA Marker、双色预染蛋白Marker、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)所需试剂,均购自生工生物工程(上海)股份有限公司;羊抗鼠二抗,购自Jackson ImmunoResearch公司;4--(马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(Sulfo-SMCC)和二甲基甲酰胺(DMF),购自Jackson ImmunoResearch Laboratories公司;其他化学试剂均购自上海国药集团化学试剂有限公司;96孔酶标板,购自无锡国盛生物工程股份有限公司;透析袋(截留相对分子质量为14 000),购自上海桥星贸易有限公司;酶标仪为Infinite F50;半干式转膜仪型号为AmershamTE 70。
1.3 副溶血性弧菌BamA蛋白拓扑结构分析及多肽的筛选
副溶血性弧菌的外膜蛋白BamA的氨基酸序列(GI:28899084)从美国国家生物技术信息中心的蛋白数据库(NCBI)中获得,并采用搜索比对工具BLAST分析其与其他弧菌属弧菌序列的同源性水平。为了直观分析BamA蛋白在弧菌属及革兰氏阴性菌株蛋白之间的关系,用ClustalX分析蛋白质序列的多重比对,并使用MEGA 7.0中的邻接(neighbor-joining,简称NJ)法构建系统进化树。设置了10 000次重复的Bootstrap测试,以检查分支拓扑的有效性。BamA蛋白质三维结构使用SWISS-MODEL同源建模法在线生物信息学软件进行模拟,将候选蛋白质的序列输入至序列框中,SWISS-MODEL同源建模法可自动找到与目标序列同源的已知结构作为模板,为目标序列与模板序列创建序列比对,根据序列比对,用同源建模软件预测结构模型,评估模型质量。模拟结构同时通过I-TASSER和TrRosetta进行了验证。利用Pymol软件分析最佳蛋白模型的结构。结合SnapGene和Proten软件对副溶血性弧菌外膜蛋白BamA的保守区域进行分析,筛选出保守且对弧菌属物种具有特异性的多肽序列。利用Pymol软件分析蛋白结构,将在弧菌属中具高保守性的多肽定位到蛋白结构,找到其中的暴露性表位氨基酸序列。
1.4 BamA重组质粒的构建和表达
利用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,简称CTAB)法提取DNA,副溶血性弧菌外膜蛋白BamA基因(登录号为BA000031.2和BA000032.2),通过PCR进行扩增。上游引物:5′-C A C G G A T C C A T G G C G A T T A A G C G A A T T C T-3′,下游引物:5′-C C G C T C G A G G A A A G T T C T A C C G A T A G T G A A T-3′。PCR程序为94 ℃预变性5 min;94 ℃ 1 s,58 ℃ 40 s,72 ℃ 60 s,30个循环;72 ℃延伸5 min。通过1%琼脂糖凝胶电泳检测PCR产物,目的基因和pET-28a(+)质粒均用HⅠ和Ⅰ进行双酶切,并用TDNA连接酶进行连接。将重组质粒转化到大肠杆菌DH5α中,用含有50 μg/mL卡那霉素的LB琼脂平板,选择5个单菌落进行PCR扩增目的基因,并通过测序验证。将阳性重组质粒转化到大肠杆菌BL21中,并保存在加入15%甘油的LB培养基中,-80 ℃ 冻存。
用含有卡那霉素(50 μg/mL)抗性的LB培养基过夜培养阳性重组菌株,以1∶100(体积比)加入到LB培养液中,在37 ℃摇床中孵育至为0.5~0.8时,加入诱导剂IPTG。通过单因素试验优化培养温度、IPTG浓度(0.1、0.2、0.4、0.8 mmol/L)和IPTG诱导时间。最终培养条件为诱导时间16 h,温度16 ℃,诱导剂浓度0.4 mmol/L。4 ℃,5 000 r/min 离心 30 min 收集菌体,用含有2 mol/L尿素和1%聚乙二醇辛基苯基醚(Triton X-100)的磷酸盐缓冲液(PBS)洗涤2次,在冰浴中260 W超声破碎 30 min,超声开3 s,超声关7 s。4 ℃,12 000 r/min 离心20 min,收集上清液和沉淀,然后将沉淀溶于含有8 mol/L尿素的50 mmol/L PBS缓冲液(pH 值为8.0)中。通过10% SDS-PAGE分离胶,用5%浓缩胶研究目标蛋白的表达形式(可溶性表达或包涵体)。
将8 mol/L尿素溶解后的溶液12 000、4 ℃离心10 min,取上清液。将上清液通过装有镍离子亲和层析柱(Ni-NTA)进行纯化,通过优化含咪唑的尿素缓冲液梯度纯化蛋白,并采用200 mmol/L咪唑洗脱,得到单一条带。纯化后的BamA蛋白,浓度稀释到0.5 mg/mL,装入透析袋(截断分子量为 14 000)中,低温梯度透析,用磁力搅拌器低速搅拌,透析缓冲液(0.05 mol/L PBS,8 mol/L尿素)浓度从8 mol/L尿素梯度降低至不含尿素的0.01 mol/L PBS缓冲液。蛋白浓度通过Bradford方法确定。蛋白质的表达和纯化通过10% SDS-PAGE分离胶进行验证,并通过考马斯亮蓝R-250染色显示蛋白质条带,制备的重组BamA蛋白在-80 ℃保存,待用。
1.5 多肽偶联
采用Sulfo-SMCC作为偶联剂,在0.1 mol/L PBS缓冲液中,7 mg 载体蛋白BSA与2.3 mg Sulfo-SMCC 偶联,将反应的溶液移至10 ku超滤管中,反复超滤3次以去除多余的Sulfo-SMCC。称取7 mg多肽于BSA-SMCC体系中,室温磁力搅拌12 h,将偶联完成的溶液装入透析袋,并通过蛋白电泳表征。
1.6 动物免疫
6~8周龄的雄性BALB/c小鼠购自扬州大学兽医学院。将纯化的BamA可溶蛋白与弗氏完全佐剂等体积乳化后免疫小鼠。小鼠第1次免疫使用的乳化剂为弗氏完全佐剂,之后的加强免疫使用的乳化剂为弗氏不完全佐剂。共免疫4次,首次和第2次免疫剂量为80 μg/只,第3、第4次免疫剂量减半。免疫间隔时间为3周,免疫方式为小鼠背部皮下多点注射。第3、第4次免疫后1周小鼠尾部采血,获得血清并于-20 ℃ 保存。
1.7 间接ELISA和蛋白质印迹法(Western blot)测定血清效价及交叉反应
表1中的菌株过夜培养并计数后,在100 ℃煮沸15 min灭活并冷却至室温。用碳酸盐缓冲液(pH值为9.6)将菌体浓度稀释到10CFU/mL,每孔 100 μL 加入到96孔酶标板中,37 ℃包被2 h;用含0.05%吐温-20的磷酸缓冲液(PBST)洗涤3次后,每孔加200 μL含0.2%明胶的碳酸盐缓冲液封闭酶标板,37 ℃封闭 2 h;小鼠血清用抗体稀释液(PBS缓冲液,0.1%明胶,0.05% Tween-20)稀释500倍,并以3倍梯度稀释6个梯度,并用稀释液作阴性对照,每孔100 μL,37 ℃孵育30 min;用PBST洗板3次;加入用抗稀稀释4 000倍的辣根过氧化物酶(HRP)标记羊抗鼠IgG(0.5 μg/mL),每孔100 μL,37 ℃孵育30 min;用PBST洗板4次;加入100 μL显色液,37 ℃孵育10~15 min;50 μL 2 mol/L硫酸溶液终止反应,用酶标仪测定450 nm处吸光度。当最高稀释度的阳性血清的与空白对照的之比(P/N)≥2.1时,该稀释度即为血清效价。
免疫印迹方法参考文献[15-16]。简要步骤为将过夜培养的50 mL菌液离心,弃上清,用15 mL PBS缓冲液将沉淀重悬;采用“1.2.4”节中的方法冰浴破碎;离心取上清,将细菌蛋白上样10 μL至SDS-PAGE电泳仪,分离胶浓度为10%,浓缩胶浓度为5%;电泳完成后用半干转膜仪TE 70将蛋白转膜至聚偏二氟乙烯(PVDF)膜上,电流为 30 mA,转膜 30 min;用50 mL含5%脱脂奶粉的(PBS缓冲液)封闭PVDF膜上的多余位点,37 ℃轻轻振荡2 h;加入20 mL血清稀释液(稀释1 000倍数),室温孵育1 h;用PBST洗涤3次,每次在摇床轻轻振荡5 min,加入20 mL抗稀稀释的HRP标记羊抗鼠IgG(0.5 μg/mL),室温避光孵育1 h;洗涤5次,TMB显色剂显色5~10 min,有清晰条带出现后洗涤拍照。
2 结果与分析
2.1 BamA蛋白保守性及多肽分析
BamA是外膜蛋白组装复合体的一部分,它参与β-桶蛋白的组装及其插入外膜。BamA是Omp85超级家族的成员,Omp85超级家族是一组16链β-桶状蛋白,参与细菌和细胞器中的膜蛋白插入和蛋白分泌反应。图1-a为大肠杆菌BamA蛋白的结构图(PDB:5D0O),图1-b是以大肠杆菌K12的BamA为模板模拟的副溶血性弧菌BamA蛋白的结构图,从图中可知BamA蛋白结构具有β-桶状结构,具有细胞外的无规则卷曲环区(由上至下第1条虚线的上方为膜外部分),说明蛋白具有一定的暴露性。为了进一步了解BamA的保守性,选取了具有代表性的弧菌属蛋白序列与副溶血性弧菌BamA蛋白序列进行比对。同源性分析结果表明,BamA蛋白在所有弧菌中广泛分布,较保守,序列一致性在83%以上,与其他革兰氏阴性细菌的蛋白序列相似性较低,最高相似度在50%以下,说明BamA蛋白属内保守性较高,具有一定的特异性。
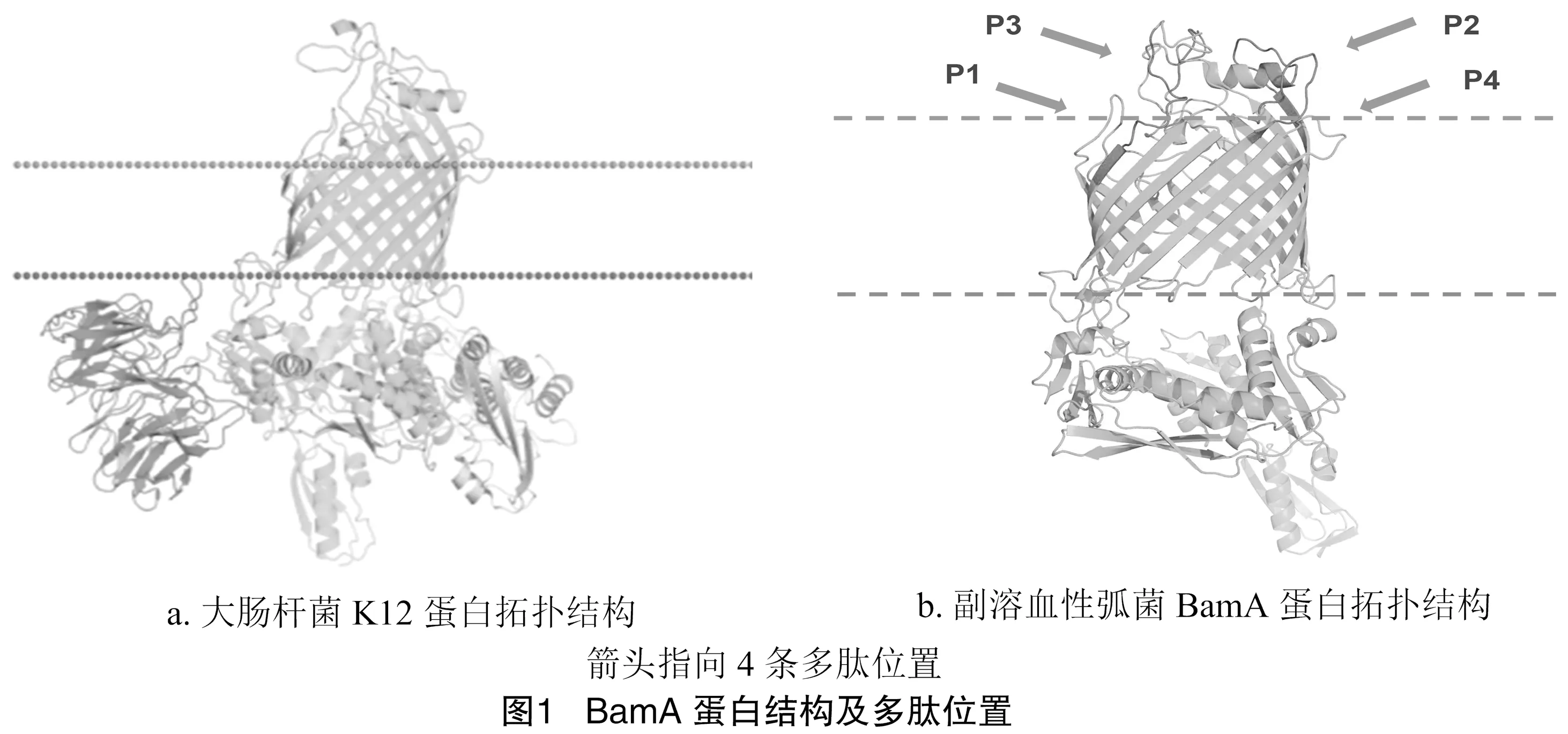
通过NCBI中BLAST与副溶血性弧菌BamA蛋白序列进行比对,结合SnapGene软件进行分析(图2),最终选取出相似性在80%以上的连续氨基酸序列。利用Pymol软件,将找出的氨基酸序列在模拟蛋白结构中标记出来,得到4条保守性较高且位于膜外的表位氨基酸,分别为BamA-1(P1)Y Y Y D Y S D P T N Y R S S、BamA-3(P2)N G Y G Q T D G N D N L F、BamA-4(P3)VYRDYSGSN、BamA-5(P4)QADNIDSSGALNT,位置见图1-b,这些序列都是 8~13 aa的短肽,分子量为1 163~1 896 u,这些表位具有较高的保守性及较好的暴露性,使得BamA蛋白具有潜在的检测价值及疫苗价值。
2.2 副溶血性弧菌BamA蛋白的表达及多肽偶联
采用CTAB法从副溶血性弧菌(CICC 21617)中提取DNA,并以此为模板扩增出分子量为2 000~3 000 bp 的基因片段(图3-a),与BamA基因片段长度(2 415 bp)一致。将其插入pET-28a(+)中,构建的重组质粒经双向测序后与BamA符合度为100%,确认构建成功。
采用不同浓度IPTG及诱导时间诱导BamA蛋白表达,培养温度为16 ℃,将超声破碎后的上清和沉淀经SDS-PAGE分析。结果如图3-b所示,在70~100 ku出现过表达的蛋白条带,重组质粒带有6个组氨酸标签,BamA理论分子量为89 ku,表达的蛋白位置与理论值较为吻合。IPTG浓度为 0.4 mmol/L、诱导时间为6 h时,可溶性蛋白表达量较高,但后期纯化时回收率较低,蛋白BamA最终以包涵体形式制备,诱导条件为16 ℃培养,IPTG浓度为 0.4 mmol/L,诱导时间为16 h。

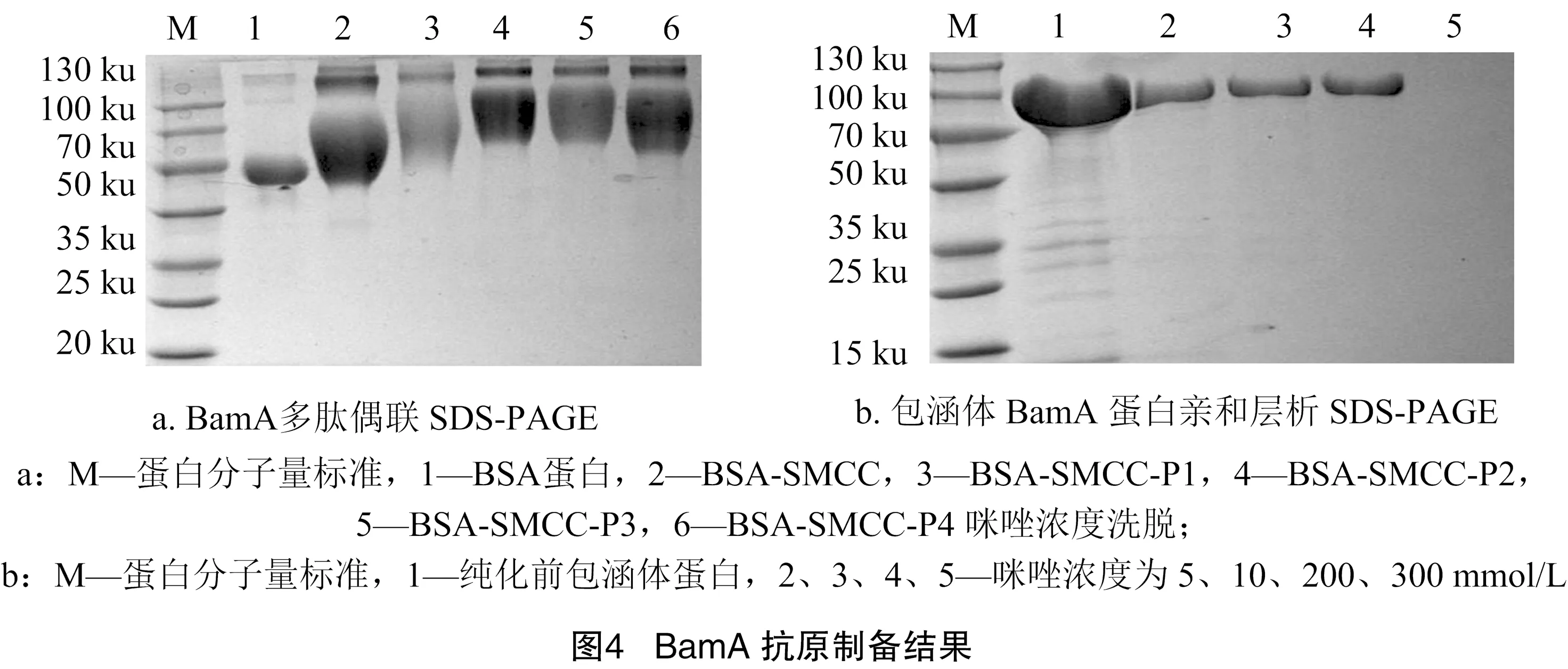
为了将多肽与载体蛋白偶联形成完全抗原,所有多肽的N端均用半胱氨酸修饰。通过SDS-PAGE表征偶联情况,如图4-a所示,BSA蛋白条带在与Sulfo-SMCC连接后移至更高的位置(泳道2),与多肽反应后蛋白条带进一步上移,说明分子量进一步增加(泳道3至泳道6),多肽偶联成功。
采用Ni-NTA亲和层析柱纯化包涵体蛋白,对柱子的洗脱采用浓度为8 mol/L的尿素缓冲液,其所含咪唑浓度分别是5、10、200、300 mmol/L。如图4-b所示,在咪唑浓度为200 mmol/L时可以在90 ku左右得到清晰的单一蛋白条带。可溶性蛋白与包涵体蛋白相比具有正确的折叠结构,存在着较好的功能性。因此,对BamA包涵体蛋白进行纯化和尿素梯度透析复性,透析复性设置的尿素浓度梯度分别为8.0、6.0、4.0、3.0、2.0、1.5、1.0、0.5 mol/L,随后又进行了0.05 mol/L PBS和 0.01 mol/L PBS的透析,透析袋中无可见沉淀,提示复性成功。
2.3 免疫血清评价
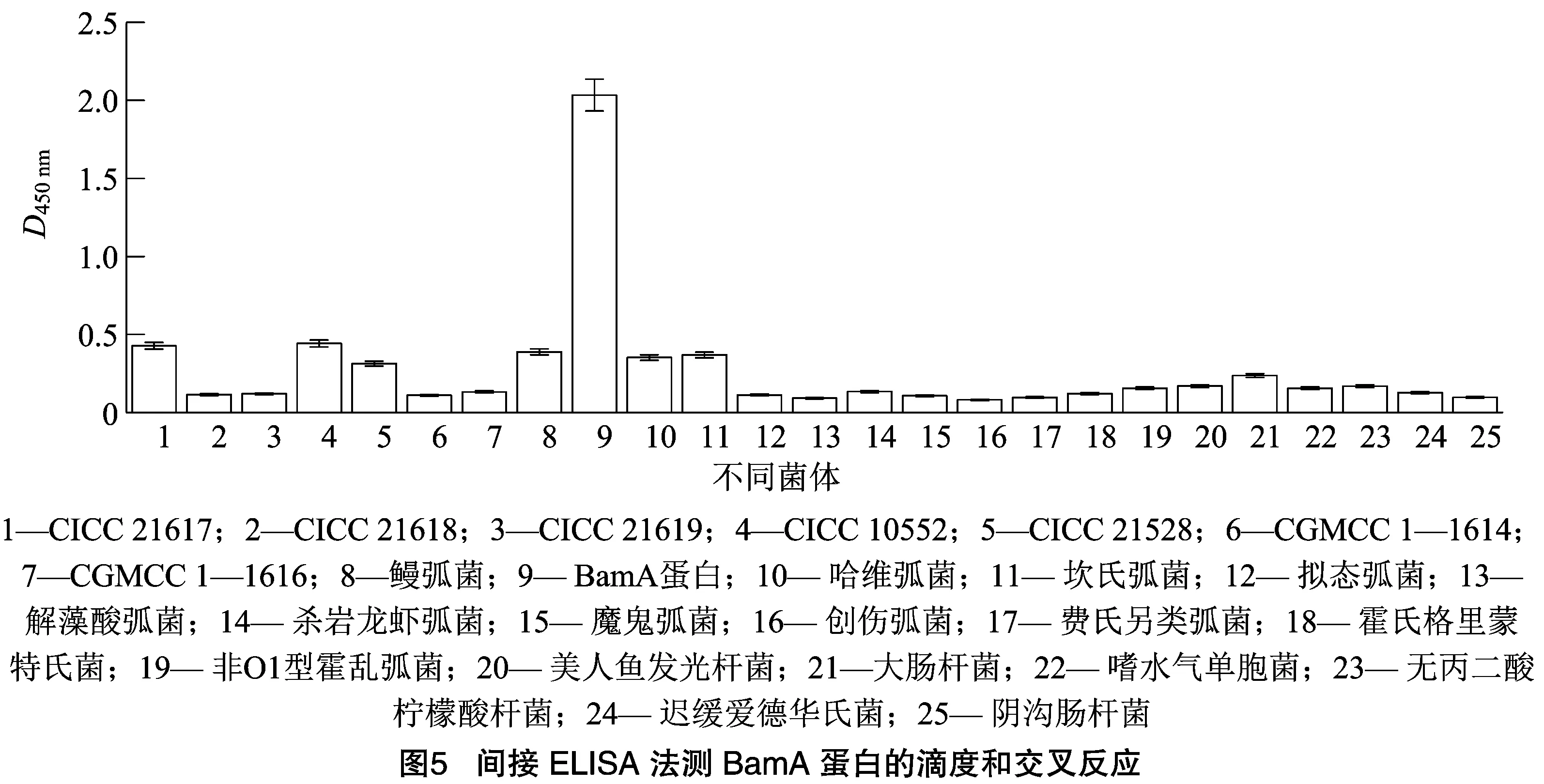
蛋白抗原在第3次免疫后,用间接ELISA方法检测小鼠血清对免疫抗原的效价,结果见图5。纵轴表示450 nm处吸光度,横轴表示测试菌株,血清稀释500倍。BamA免疫血清对BamA重组蛋白的平均吸光度为2.121,与副溶血性弧菌CICC10552等包板时的平均吸光度为0.428,与哈维氏弧菌等弧菌属包板的平均吸光度为0.345;对美人鱼发光杆菌等弧菌属外细菌的平均吸光度为0.155。BamA蛋白免疫血清对弧菌及其他细菌菌体效价大多仅为0.5 K,而对BamA重组蛋白的效价高达121.5 K。说明免疫过程诱导产生了BamA重组蛋白的抗体,但血清与菌体的识别性较弱。BamA蛋白多肽P1、P2、P3、P4免疫血清对BamA重组蛋白的平均吸光度为2.058、0.625、1.222、1.184,与副溶血性弧菌包板的平均吸光度分别为0.344、0.478、0.243、0.278,对哈维氏弧菌等弧菌属包板的平均吸光度分别为0.302、0.361、0.213、0.232,对美人鱼发光杆菌等弧菌属外包板平均吸光度为0.173,结果表明免疫血清与菌属外几乎无交叉反应。BamA多肽免疫血清对BamA蛋白的效价为13.5 K,而对弧菌及其他细菌菌体的效价大多为 0.5 K,表明选取的多肽位于BamA蛋白表面,受空间结构影响并不大,但免疫血清与菌体的识别性同样较弱。
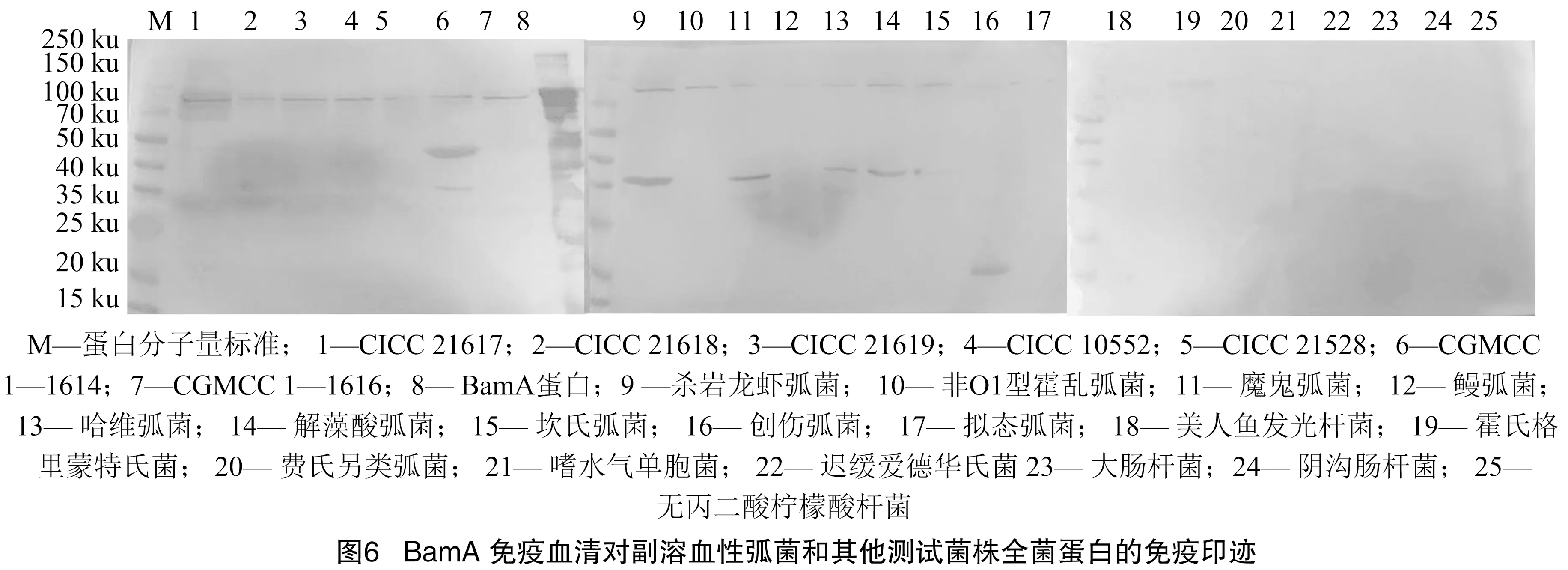
为验证血清的结合蛋白和交叉反应,采用免疫印迹进行进一步分析。由图6可知,BamA蛋白血清与7株副溶血性弧菌以及9株其他弧菌的全菌蛋白在70~100 ku出现显色条带,其中对副溶血性弧菌CICC 21618及非O1型霍乱弧菌反应较弱,识别位置与副溶血性弧菌外膜蛋白BamA(89 ku)分子量大小一致,对弧菌属外的全菌蛋白多数不反应,只对霍氏格里蒙特氏菌有反应,但在全菌ELISA中未观察到与霍氏格里蒙特氏菌有交叉反应的。免疫印迹结果说明BamA重组蛋白免疫血清能与大部分弧菌的BamA蛋白产生特异性反应,BamA蛋白在弧菌属具有较高的保守性和特异性。
3 讨论与结论
弧菌是一种水产动物和人类共患的条件致病菌,其引起的细菌性病害给我国南美白对虾、海产鱼类等水产养殖业造成了较大的经济损失。细菌外膜蛋白的序列部分暴露于细胞外环境,这些膜外多肽结构不仅使外膜蛋白质具有基本的生理或病理功能,也可以诱导特定的免疫反应。
外膜蛋白是否可用作潜在的检测抗原和疫苗抗原应考虑多种因素,包括表面暴露、菌株间的保守性和诱导免疫反应的能力。β-桶状外膜蛋白通常是跨膜或是嵌入细胞膜内,在细胞质中合成后,通过分泌系统运输到细胞膜上的β-桶状组装系统(BAM)上,并完成组装和在细胞膜上的定位。在革兰氏阴性细菌中,BAM复合物参与细胞外膜蛋白运送和安装过程,负责将合成的外膜蛋白插入并折叠到细菌胞膜。BAM家族蛋白具有较好的保守性,其中BamA是该系统的核心并且在细胞外膜具有较好的暴露性,其他BamB、BamC、BamD均位于细胞外膜的膜内,BamA由嵌入外膜的C末端β-桶和周质N末端区域组成,该区域包含多个与转运相关的表位。对副溶血性弧菌BamA蛋白进行基于弧菌菌株之间的保守性分析结果表明该蛋白具有较高保守性,与常见弧菌序列一致性达到83%,与属外常见菌序列一致性低于50%。
通过小鼠模型研究了弧菌副溶血性弧菌BamA重组蛋白及多肽抗原的免疫原性。BamA重组蛋白经纯化获得包涵体蛋白并成功复性,制备的BamA重组蛋白与天然蛋白具有更为接近的结构。免疫血清测试结果表明,BamA重组蛋白的抗体可与常见弧菌及其全菌蛋白发生特异性反应。免疫印迹中,重组BamA蛋白和弧菌超声破碎裂解物出现的目的条带位置相同,说明菌体与血清的抗原结合位点也为BamA蛋白。免疫血清与7种副溶血性弧菌和9种测试弧菌全菌蛋白发生不同程度的特异性结合,而与美人鱼发光杆菌、费氏另类弧菌、嗜水气单胞菌、迟缓爱德华氏菌、大肠杆菌、阴沟肠杆菌、无丙二酸柠檬酸杆菌没有交叉反应,仅与霍氏格里蒙特氏菌出现特异性反应条带。霍氏格里蒙特氏菌是弧菌科中的一种致病菌,2003年前分类属于弧菌属,名为霍利斯弧菌(),可引起人类肠胃炎。因此,与该菌蛋白的反应主要由于较近的亲缘关系。值得一提的是,本试验采用的弧菌属菌株较为广泛,且具有代表性,包含了对人类具有致病性的霍乱弧菌、溶藻弧菌、拟态弧菌,及对水生物具有致病性的鳗弧菌和哈维氏弧菌。
ELISA和免疫印迹的结果表明,BamA蛋白和多肽免疫血清对BamA蛋白具有较强的结合,但与不同副溶血性弧菌菌体的结合均较弱。免疫印迹是菌体破碎后的蛋白与免疫血清直接反应,而ELISA则是用菌体包板,ELISA中菌体与外膜蛋白BamA免疫血清结合较差提示抗原抗体的结合可能受到了菌体表面其他抗原的影响。革兰氏阴性菌表面存在有荚膜和脂多糖(LPS)等抗原,其中荚膜是副溶血性弧菌等弧菌主要的表面抗原,细菌荚膜长度为0.2~0.5 μm,可以掩盖抗体与菌体外膜蛋白的结合,抵抗宿主免疫系统的杀伤。Vij等研究发现,采用菌体免疫结合重组BamA蛋白加强免疫的方法制备了81个大肠杆菌BamA单克隆抗体,其中7个抗体可以对大肠杆菌K12(缺失核心多糖)和LPS核心多糖突变株(ΔwaaD)有90%以上的抑制生长率,证明了BamA为大肠杆菌的外膜蛋白并具有中和性抗原表位,但正常大肠杆菌完整的LPS结构限制了抗体与BamA的接触而不被BamA抗体识别。后续研究可通过设计突变菌株研究免疫血清与副溶血性弧菌的结合,验证是否存在荚膜、脂多糖等表面抗原的影响。这也提示筛选外膜蛋白作为诊断抗原和疫苗抗原,除了应位于外膜,具有一定保守性、特异性,还应该考虑其在其他抗原影响下的表面暴露性。
综上,本研究首次报道了副溶血性弧菌外膜蛋白BamA重组质粒的构建、重组蛋白的表达纯化、多肽的筛选和偶联,以及BamA抗原在小鼠中的免疫原性。ELISA和免疫印迹的结果表明,免疫血清与弧菌属菌体蛋白存在交叉反应,与迟缓爱德华氏菌等弧菌属外细菌蛋白无交叉反应,血清与弧菌菌体的结合效价较低,可能与弧菌表面荚膜等其他表面抗原的影响有关。该研究证明了弧菌BamA具有弧菌属保守性和良好的特异性,但表面可暴露性可能较为有限,这为后续验证研究指明了方向,也为弧菌属免疫检测抗原和疫苗抗原开发提供了新的影响因素和研究思路。

