Mn(BO2)2/BNO界面结构调控增强催化臭氧分解性能研究
王姝焱,张瑞阳,刘润,刘凯,周莹
(1 西南石油大学油气藏地质及开发工程国家重点实验室,四川 成都 610500;2 西南石油大学新能源与材料学院,四川成都 610500)
引 言
随着人们环保意识的提高以及各级政府污染防治措施的落实,我国主要大气污染物浓度在逐年下降。然而与此同时,臭氧污染物浓度却在不断上升,成为了仅次于PM2.5的大气污染物[1-2]。臭氧污染不仅造成农作物减产,而且威胁人类健康,阻碍社会的可持续发展,因此臭氧的治理迫在眉睫[3]。催化臭氧分解技术利用催化材料表面活性位点在常温常压下加速臭氧分解为氧气,绿色环保、安全高效,是解决臭氧污染问题最有潜力的技术之一[4-6]。对于催化臭氧分解技术而言,催化剂是关键。相比贵金属[7-9],以锰、镍、铁等过渡金属为活性位点的金属化合物以其优异的催化性能、丰富的储量等优点备受关注[10-13]。然而,在实际环境中,水在活性位点上的吸附,易造成催化剂的失活,制约催化臭氧分解技术的发展。复合材料不仅具有各组分的性质,还能够通过组分之间的界面作用力影响电子迁移,调控臭氧和水在催化剂表面的吸附和反应过程,是提高催化活性和抗湿性的策略之一[14-15]。例如,Wei 等[16]在锰氧化物中掺入元素铈,发现Ce 以CeO2的形式与MnOx结合在一起,两者界面处具有强烈的相互作用力,促进了电子转移,从而提高了催化剂在湿润条件下对高浓度臭氧分解能力。Zhu 等[17]也发现活性位的电子迁移能力与催化剂抗湿性密切相关,将石墨烯与MnO2复合后的界面结构发生了变化,促使电子定向迁移至MnO2,提高活性位点对臭氧的吸附并抑制水的吸附,从而增强抗湿性能。因此选择合适的载体材料是提高抗湿性的策略之一。六方氮化硼(BN)具有良好的化学稳定性和大的比表面积,在能源[18]、环境[19]等领域受到广泛的关注。在之前的报道中,发现氧掺杂BN(BNO)与氮化碳界面之间的相互作用力可以实现电子的定向转移,促进催化活性[20]。因此,以BNO 为载体有望提高催化臭氧分解活性以及抗湿性。
基于以上思路,本工作构建了偏硼酸锰/氧掺杂氮化硼[Mn(BO2)2/BNO,Mn/BNO]臭氧分解催化剂,研究了Mn/BNO 在不同湿度下的臭氧分解性能并提出了相应的反应路径,为高效耐湿臭氧分解催化剂的设计提供了新思路。
1 实验材料和方法
1.1 材料
硼 酸(H3BO3),四 水 合 醋 酸 锰[Mn(CH3COO)2·4H2O],上海阿拉丁化学试剂有限公司提供。尿素(CH4N2O),天津科密欧化学试剂有限公司提供。实验用水为双重去离子水,电阻为18.25 MΩ。
1.2 材料的制备
锰负载氮化硼(Mn/BNO)材料的制备:将四水合醋酸锰、24.00 g 尿素和2.00 g 硼酸完全溶解于去离子水中后冷冻干燥;接着,将粉末平铺于磁舟中;最后,在N2氛围、900℃下反应5 h 得到样品。根据Mn摩尔比,将样品分别命名为BNO、1%Mn/BNO、3%Mn/BNO、5%Mn/BNO、10%Mn/BNO、20%Mn/BNO,其 中Mn(CH3COO)2·4H2O 的 用 量 分 别 为0、0.07、0.22、0.37、0.74和1.48 g。
不同金属负载氮化硼材料的制备:首先将0.22 g四水合醋酸锰分别换为0.37 g 硝酸铁和0.23 g 硝酸钴,其他化学试剂用量以及实验步骤与3%Mn/BNO保持一致。最后将获得的样品命名为3%Fe/BNO 和3%Co/BNO。
1.3 材料表征及分析方法
X 射线衍射仪(XRD),X’Pert PRO MPD 型,荷兰,辐射源为CuKα,测试范围和扫描步长分别为10°~70°和0.05 (°)/s;扫描电子显微镜(SEM),ZEISS EV0 MA15 型,德国,工作电压为20 kV;透射电子显微镜(TEM),FEI Tecnai G2 20 型,荷兰,工作电压为200 kV;X 射线光电子能谱分析仪(XPS),Thermo ESCALAB 250Xi 型,美国;傅里叶变换红外光谱仪(FT-IR),Nicolet-6700 型,美国,测试范围为3800~600 cm-1,采用溴化钾对样品进行压片;氮气等温吸脱附(BET,BJH),麦克ASAP 2460 型,美国,在120℃下脱附6 h;水蒸气程序升温脱附(H2O-TPD),ASAP 2920 型,美国,先在150℃下通氩气2 h,除去表面吸附杂质,然后降温至100℃,再通入水蒸气反复吸附30 次至吸附饱和后,待基线平稳,最后在100~600℃测试范围内氩气气氛下通入水蒸气进行测试;拉曼光谱(Raman),Thermo Fischer DXR 型,美国,激发波长为514 nm,测试范围为300~3600 cm-1。
1.4 臭氧催化分解性能测试
通过自主搭建的装置评价样品的催化臭氧分解性能:首先控制气体总流速为1.5 L/min,由真空紫外(185 nm)光源产生O3[初始浓度(85.7±4.3) mg/m3],并维持温度25℃;接着将0.1 g 样品均匀分散在半径为0.02 m、高0.04 m 的圆柱形海绵中,并放入半径为0.02 m 的不锈钢反应器中;最后通过臭氧分析仪(model 106L 型,美国2B Technologies)检测进出口的O3浓度。臭氧去除率(q)通过式(1)计算:

其中,Coutlet和Cinlet分别代表反应器出口处和入口处的O3浓度,mg/m3。
1.5 理论计算
所有模型结构均采用Mede-A 中的Vienna Abinitio Simulation Package(VASP)程序进行模拟[21],所有的计算均基于广义梯度近似理论(generalized gradient approximation, GGA) 中的Perdew-Burke-Ernzerhof (PBE)泛函方法[22]。收敛精度为0.02 eV/Å(1 Å=0.1 nm),能量收敛值为1×10-5eV,截断能为400 eV,k点为2×2×1,真空层为15 Å。吸附能(Eads)通过式(2)计算:
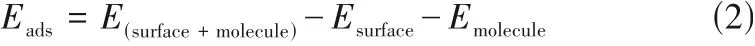
其中,E(surface+molecule)为O3或H2O 吸附在材料表面的总能量,eV;Esurface为材料表面的能量,eV;Emolecule对应O3或H2O的能量,eV。
2 实验结果与讨论
2.1 臭氧催化分解的性能测试与表征
2.1.1 Mn/BNO 臭氧催化分解的性能测试 首先,通过自制的臭氧分解测试系统评价样品的催化性能。如图1(a)所示,不同金属负载BNO 样品中,Mn/BNO 表现出最高的臭氧去除率,达到50%。接着研究了不同Mn/BNO 的活性。在20%相对湿度(RH)下,BNO 活性较低(10%),而锰的加入提高了活性,其中,当反应20 min 后,3%Mn/BNO 具有最高的臭氧去除率(50%)[图1(b)];当湿度为60%时,3%Mn/BNO 的臭氧去除率仅为4%,而10%Mn/BNO 的臭氧去除率达到92%[图1(c)]。另外发现10%Mn/BNO 样品随湿度的增加活性先增后减,并在60%湿度下具有最好的催化活性[图1(d)]。基于上述测试结果,对3%Mn/BNO 和10%Mn/BNO 在干燥、湿度为20%和60%的条件下进行长时间的臭氧分解性能测试。首先,3%Mn/BNO 在20%湿度下的臭氧分解率随反应时间增长而降低,4 h后稳定在28%。这可能是由于分解产物的累积以及湿度的增加造成活性位被占据,抑制了臭氧的分解,同时也导致了60%湿度下几乎不具有催化活性[图1(e)]。类似地,10%Mn/
BNO 在60%湿度下的臭氧分解率逐渐下降至46%,这主要是分解产物的不及时脱附造成的[图1(f)]。以上结果表明10%Mn/BNO可有效抑制水对活性位点的毒害作用,并且在一定湿度下水可以促进臭氧分解。
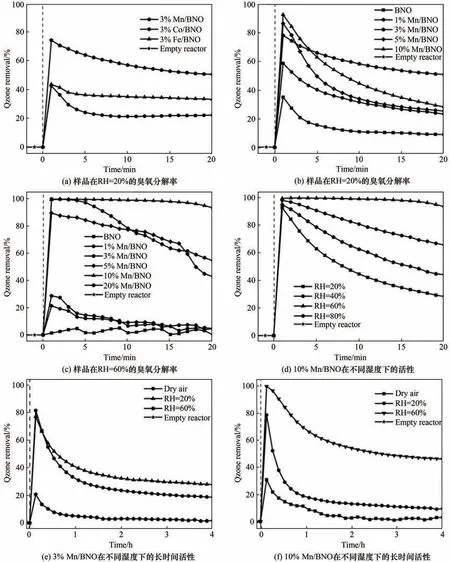
图1 样品的臭氧去除性能Fig.1 Catalytic ozone removal property of samples
2.1.2 Mn/BNO 的XRD 表征 通过XRD 对样品进行物相分析,结果如图2 所示。BNO 出现属于BN(PDF#34-0421)的特征峰,但较宽的衍射峰表明其结晶度低[23]。而引入锰之后,Mn/BNO 中出现了偏硼酸锰Mn(BO2)2(PDF#03-0815)的特征峰,且峰的强度随锰含量增加而增强。但20%Mn/BNO 中锰以Mn(BO2)2和Mn2(BO3)2(PDF#19-0781)两种形式存在。此外,BNO 的结晶度随着锰的引入而提高。以上结果证明锰主要以Mn(BO2)2的形式与BNO复合。

图2 样品的XRD谱图Fig.2 XRD patterns of samples
2.1.3 Mn/BNO 的形貌分析 图3 为样品的扫描电镜和透射电镜测试。BNO 为纳米片形貌,结晶度较差,晶格条纹难以辨认[图3(b)、(c)]。而负载锰之后[图3(e)、(f)、(h)、(i)],出现颜色深暗的区域,推测为Mn(BO2)2覆盖在BNO 片层上,并且属于BN(002)的晶面清晰可辨,进一步表明Mn(BO2)2的形成促进BNO 的结晶[24]。此外,10%Mn/BNO 中晶格间距为5.78 Å 的衍射条纹属于Mn(BO2)2的(011)晶面[25]。以上结果进一步证明Mn(BO2)2与BNO 结合在一起。

图3 样品的SEM、TEM和HRTEM谱图Fig.3 SEM,TEM and HRTEM images of samples
2.1.4 Mn/BNO 的XPS 和FT-IR 分析 利用红外光谱分析样品的表面官能团,结果如图4(a)所示。BNO 在781 cm-1和1600~1300 cm-1的 吸 收 归 因 于B—N—B 和B—N 键[23]。引入Mn(BO2)2后,1143 cm-1处出现属于Mn(BO2)2的B—O 键[26]。并且10%Mn/BNO 在1600~1300 cm-1的峰形发生改变,且3383、3133 cm-1处—OH、—NH 峰强度降低[27-28]。XPS 测试结果如图4(b)~(f)所示。在O 1s 精细谱中,532.7、534.5 和535.8 eV 的特征峰分别对应B—O、C—O 和O—H 键,证实了氧掺杂BN[图4(e)][19,23]。在C 1s 谱中,BNO 表面各类含碳官能团随锰含量增加而消失[图4(b)]。含锰样品的Mn 2p 谱中位于641.9 eV 和654.5 eV两个峰分别为Mn 2p3/2和Mn 2p1/2,表明锰为正二价[图4(f)]。引入锰之后,BNO 在190.6 eV 和398.3 eV 处的B—N 键键能分别增大至190.7 eV(3%Mn/BNO)和190.9 eV(10%Mn/BNO)以及398.5 eV(3%Mn/BNO)和398.6 eV (10%Mn/BNO)[29],此 外 在401.6 eV 和535.8 eV 处的N—H 和O—H 键峰消失[图4(c)、(d)],并在530.8 eV 处出现Mn—O 键的新峰[图4(e)][30-31]。以上结果表明Mn(BO2)2的引入,调控了Mn(BO2)2与BNO 之间的界面结构,使BNO 的电子迁移到Mn(BO2)2,并减少了材料表面的亲水官能团,这不仅有利于臭氧的分解,而且可以抑制水的吸附,提高材料的抗湿性[16]。

图4 样品的FT-IR图和XPS图Fig.4 FT-IR and XPS spectra of samples
2.1.5 Mn/BNO的Raman光谱分析 拉曼光谱测试结果如图5 所示。BNO 在1379 cm-1处出现了属于六方氮化硼的E2g声子振动的拉曼峰[32]。而含锰样品还在660、820 cm-1处出现两个峰,分别代表Mn—O 键伸缩振动的拉曼峰和属于偏硼酸锰的B—O 键[26,33]。值得注意的是,加入Mn(BO2)2后的10%Mn/BNO 中不仅属于Mn—O 键的峰形变宽,属于BNO 的E2g声子振动峰向低波数方向偏移至1370 cm-1,并且对应的半峰宽明显变宽,这进一步证实了BNO和偏硼酸锰之间存在强烈的相互作用力。

图5 样品的拉曼光谱图Fig.5 Raman spectra of samples
2.2 机理分析
2.2.1 Mn/BNO 的比表面积和孔径结构分析 一般而言,比表面积是影响催化活性的关键因素之一。图6(a)中,BNO 和3%Mn/BNO 的比表面积分别为662.2 m2/g、510.6 m2/g,而10%Mn/BNO 的比表面积降低至81.4 m2/g。结合图6(b)的孔径分布,10%Mn/BNO 比表面积的减小可能是由于Mn(BO2)2堵塞BNO 孔道造成的。结合催化活性测试表明,在干燥或低湿度下,比表面积是影响催化活性的关键因素,导致3%Mn/BNO 的催化活性高于10%Mn/BNO。而当湿度提高,高比表面积的3%Mn/BNO可吸附更多的水分子,导致水对催化剂的毒化作用显著提高,催化活性下降。而10%Mn/BNO 比表面积较小,孔径结构被堵塞,导致水分子难以聚集在催化活性位点上,延缓了水对催化剂的毒害作用。
图6 BNO、3%Mn/BNO和10%Mn/BNO的氮气等温吸脱附曲线和孔径分布曲线Fig.6 N2 isotherm adsorption and desorption,pore size distribution curves of BNO,3%Mn/BNO and 10%Mn/BNO samples
2.2.2 臭氧和水在材料表面吸附的理论计算分析 为了深入研究催化臭氧分解过程,构建了H2O 和O3在材料表面的吸附模型(图7)。在Mn(BO2)2表面,臭氧吸附在锰[Mn(Ⅱ)]上并直接分解,且对H2O 的吸附能只有-0.72 eV;在BNO 表面,O3和H2O 的吸附能分别为-4.08 eV 和-0.38 eV。以上计算结果表明,Mn/BNO 的活性位点为表面暴露的锰,而载体BNO可以抑制水的吸附,从而提高催化臭氧分解活性和抗湿性。

图7 Mn(BO2)2和BNO的结构以及H2O和O3在材料表面上的吸附模拟情况Fig.7 Structures of Mn(BO2)2 and BNO,and theoretical calculations of water and ozone adsorption on material surfaces
2.2.3 Mn/BNO 的H2O-TPD 分析 为了进一步证明材料的抗湿性,测试了样品对水的程序升温脱附实验,如图8 所示。BNO 和10%Mn/BNO 样品均在100~600℃区域内出现三个水的脱附峰,分别归属于表面物理吸附水、化学吸附水以及表面亲水基团解离的水[34]。与BNO 相比,10%Mn/BNO 中水的脱附峰面积明显减小且脱附温度较低,这表明10%Mn/BNO 具有更低的吸附水能力以及更好的水脱附性能[35]。

图8 BNO和10%Mn/BNO的H2O-TPD图Fig.8 H2O-TPD profiles of BNO and 10%Mn/BNO
2.3 Mn/BNO催化臭氧分解过程
综合以上分析,提出了O3在10%Mn/BNO 表面的反应过程(图9):在低湿度下,水对催化剂的毒性不明显,而3%Mn/BNO 的比表面积显著大于10%Mn/BNO,提高了臭氧的吸附能力,增强了催化活性,导致3%Mn/BNO 的活性高于10%Mn/BNO;随着湿度的提高,3%Mn/BNO 不仅具有高比表面积且表面存在丰富的亲水官能团,这导致了水易聚集在催化剂表面,造成催化活性的下降。而10%Mn/BNO 的比表面积较小,并且表面亲水官能团较少,水分子难以聚集在催化剂表面,水对催化剂的毒害作用不明显,除此之外,根据文献[36]报道,H2O 与Mn(Ⅱ)形成Mn(Ⅱ)-O(H2)结构,提供新的O3分解路径,促进O3的分解,使得O3分解活性随着湿度的增加而提高,增强了10%Mn/BNO 的催化臭氧分解活性;当湿度继续提高,H2O 之间会通过氢键连在一起形成水膜,完全覆盖活性位点,导致催化活性下降。另外,BNO 与Mn(BO2)2之间的界面作用力使电子定向迁移至Mn(BO2)2,促进了Mn(Ⅱ)的回复,提高了催化O3分解活性。

图9 10%Mn/BNO的臭氧分解路径Fig.9 The ozone decomposition path of 10%Mn/BNO
3 结 论
(1)通过臭氧分解测试发现锰负载氮化硼具有催化臭氧分解性能,且湿度对其活性具有重要的影响;在不同锰含量的样品中,10%Mn/BNO 在60%湿度下具有最高的臭氧去除率(92%)。
(2) 材料表征结果表明10%Mn/BNO 中BNO 与Mn(BO2)2成功复合在一起,并存在强烈的电子传输作用。
(3)进一步探究其作用机理,二价锰是反应活性位,而且BNO 与Mn(BO2)2的复合可以降低水对材料的吸附能力,从而使得10%Mn/BNO 在湿润环境下具有良好的催化活性。
(4)10%Mn/BNO 中两组分界面之间的强相互作用力促进电子的定向传输,有利于O3分解以及削弱H2O 吸附。这为设计具有优异催化性能的臭氧分解催化材料提供了一个新的思路。

