巨大芽孢杆菌与噁霉灵联用对甜瓜连作障碍的缓解效果
王叶青, 刘 芳, 潘纪源, 陆秀君*,, 刘文菊, 李博文*,
(1. 河北农业大学 植物保护学院,河北 保定 071000;2. 河北农业大学 资源与环境科学学院,河北 保定 071000)
河北省沧州市青县 ‘羊角脆’ 甜瓜具有口感香甜酥脆、皮薄肉嫩等特点,被认定为中国地理标志产品,但由于种植模式单一,轮作倒茬困难,甜瓜枯萎病等土传病害发生严重,成为制约其产量和品质的重要因素[1]。长期连作可能导致土壤微生物群落结构发生变化,造成多种植物病原菌富集[2]。甜瓜枯萎病是由尖孢镰刀菌甜瓜专化型Fusarium oxysporumf. sp.melonis引起的典型土传病害,同时也是连作障碍产生的主要原因,全生育期均可发生,尤其在甜瓜伸蔓期到结瓜期发病最重,植株发病后茎基部变褐缢缩猝倒,严重时整株死亡[2],易造成重大经济损失。
目前生产上防治甜瓜枯萎病的主要措施有嫁接育苗和化学防治。嫁接育苗是缓解甜瓜枯萎病的有效栽培措施之一,常采用抗病南瓜品种作为甜瓜嫁接苗的砧木,以降低甜瓜枯萎病的发病率,但对于长期连作发病较重的地块,嫁接育苗也无法缓解其影响,还可能导致甜瓜品质降低。本研究团队前期在河北省青县甜瓜连作区调研发现,农民为了保留甜瓜的特有品质和降低生产成本,自己培育甜瓜苗的状况仍有一定比例,即只能单纯依赖化学药剂防治甜瓜枯萎病。噁霉灵(hymexazol) 是一种高效内吸性杀菌剂,同时也是植物生长调节剂,持效期长,对镰刀菌引起的多种病害有一定的治疗效果,尤其对甜瓜枯萎菌的抑制效果优于其他药剂[3]。
长期不合理使用所造成的农药残留及病原菌抗药性等问题,导致化学药剂的应用越来越受到限制,利用生防菌剂替代部分化学药剂已日益引起科研工作者的关注[4]。芽孢杆菌属 (Bacillus) 是一类应用广泛的植物病害生防细菌[4],其中,巨大芽孢杆菌Bacillus megaterium是一种具有解磷、促生长和抑菌、抗逆等多种作用的功能型细菌,其在土壤修复及抗逆等方面已得到广泛研究和应用[5]。单因素处理对甜瓜枯萎病等连作病害的治疗效果存在一定的局限性,因此,联合应用杀菌剂和生防菌,发挥其互补优势防治植物病害的研究受到了广泛关注。已有研究表明,枯草芽孢杆菌B. subtilis与噁霉灵混用对番茄根腐病具有很好的防治效果,同时还可促进植株生长[6]。王炎峰等[7]将噁霉灵与绿针假单胞菌Pseudomonas chlororaphisG5 菌株发酵液复配后施用,对盆栽苦瓜枯萎病的防治效果达到81.60%。另外,庄敬华等[8]研究发现,木霉属 (Trichoderma) 真菌与噁霉灵在一定浓度下具有协同增效作用,对甜瓜枯萎病的防效可达到79.27%,效果优于单因素处理。目前尚未见关于将巨大芽孢杆菌与噁霉灵联用处理连作土壤以防治甜瓜枯萎病的研究报道。
前期研究发现,巨大芽孢杆菌b1 菌株与噁霉灵联用对基质培育南瓜幼苗的生长有促进作用,同时还可预防苗期病害的发生(未报道)。本研究于河北省青县采集连作甜瓜土壤,通过盆栽试验探究了连作土壤对甜瓜及南瓜幼苗生长的影响,分析了土壤微生物数量及群落结构的变化。在明确连作障碍的基础上,分离得到甜瓜枯萎菌 T2 菌株,利用连作土壤进行盆栽育苗试验,研究了巨大芽孢杆菌与噁霉灵联用对连作土壤甜瓜枯萎病的缓解效果以及对甜瓜植株生长的影响,在此基础上,通过田间试验,分析了巨大芽孢杆菌与噁霉灵联用对连作土壤甜瓜枯萎病的缓解效果及对土壤微生物优势属的影响,以期为甜瓜的安全高效生产和缓解连作障碍提供理论依据及技术支持。
1 材料与方法
1.1 试验材料
菌株:甜瓜枯萎菌Fusarium oxysporumT2菌株,于河北省青县连续单作11 年甜瓜的土壤中分离得到,经过形态学鉴定[3],并委托美吉生物进行了分子鉴定;巨大芽孢杆菌Bacillus megateriumb1 菌株,本实验室前期分离保存的菌种。
药剂:99% 噁霉灵 (hymexazol) 原粉,河北赛瑞德化工有限公司。
供试作物:南瓜种子 ‘金妈妈619’ 购自永清县兴晟农业有限公司,甜瓜种子 ‘白蜜玉F1’ 由青县齐营村根枝叶蔬菜种植专业合作社提供。
供试土壤:取自河北省沧州市青县齐营村根枝叶蔬菜种植专业合作社 (116° 44′ 19′ E;38° 32′ 6′ N) ,多年连续种植 ‘羊角脆’ 甜瓜,试验地块均采取一年一大茬模式连续单作甜瓜:1 月定植,9 月中旬拉秧,之后整地,期间未种植其他作物。2018 年1 月于甜瓜定植前分别采集1 年新土以及连续单作6 年和11 年的土壤,用于连作障碍分析、微生物数量和群落优势属相对丰度分析及连作障碍缓解相关盆栽试验;田间试验在连续单作11 年的温室进行,于甜瓜定植10 d 时分别选取各处理土壤样本进行土壤微生物优势属丰度分析。
试验基质:草炭、珍珠岩与蛭石质量比为13 :3 : 4,其中含碱解氮942.48 mg/kg、速效磷1.61 mg/kg、速效钾305.64 mg/kg、有机质440.14 g/kg,pH 值 5.85。
培养基:PDA (马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL)、LB (酵母5 g,蛋白胨10 g,氯化钠10 g,固体琼脂12 g,蒸馏水1 000 mL) 和改良高氏一号 (可湿性淀粉20 g,硝酸钾1 g,磷酸氢钾0.5 g,硫酸镁0.5 g,氯化钠0.5 g,硫酸亚铁0.01 g,琼脂20 g,蒸馏水1 000 mL) 培养基分别用于分离土壤真菌、细菌和放线菌。
1.2 试验方法
1.2.1 连作甜瓜土壤对南瓜及甜瓜幼苗生长的影响测定 参考李青梅等[9]的方法,采用穴盘试验测定连续单作6 年和11 年的甜瓜土壤对南瓜及甜瓜幼苗长势的影响,以1 年新土为对照。逐日记录南瓜及甜瓜出苗情况,统计出苗率;10 d后取南瓜和甜瓜幼苗,洗净,测量根长、株高,将地下部根和地上部植株分别装袋,于105 ℃高温杀青30 min,75 ℃下烘干至恒重,称量,计算根冠比,统计各处理植株干重。比较各处理根长、株高、干重和根冠比等指标的差异,分析连作甜瓜土壤对南瓜和甜瓜幼苗生长的影响。
1.2.2 连作甜瓜对土壤中微生物的影响测定
1.2.2.1 对微生物数量的影响 参考Zhao 等[10]的方法,分别选用PDA 培养基、LB 培养基和改良高氏一号培养基进行土壤真菌、细菌和放线菌的分离培养,每处理设3 次重复,对不同土壤样品中可培养放线菌、细菌和真菌的数量进行统计,比较不同连作时间土壤样品中微生物数量的差异。
1.2.2.2 对真菌和细菌优势属丰度的影响 参考Zhao 等[10]的方法,试验委托上海美吉生物医药科技有限公司进行。对不同连作年份的土壤样品进行基因组DNA 提取及质量检测,以土样中提取的微生物基因组DNA 为模板,对真菌和细菌16S rDNA 的分子序列进行扩增,PCR 扩增产物经建库检测,在Illumina MiSeq 平台上进行高通量测序,对测序所得数据进行分析,采用R D P classifier 贝叶斯算法与SILVA 和UNITE 数据库,对97%相似水平的OTU 代表序列进行分类学分析,统计各样本在各个水平上的群落组成。选取优势真菌镰刀菌属 (Fusarium) 和细菌芽孢杆菌属 (Bacillus) 为例,分析连作甜瓜对土壤微生物优势属相对丰度的影响。
1.2.3 噁霉灵与巨大芽孢杆菌的相容性及对甜瓜枯萎菌的抑制作用测定 参考前文[11]方法进行噁霉灵与巨大芽孢杆菌的相容性试验,噁霉灵终浓度分别为质量浓度100、50 和25 mg/L ,以灭菌水为对照,每处理4 次重复。在此基础上,采用菌丝生长速率法分别测定噁霉灵与巨大芽孢杆菌对甜瓜枯萎菌T2 菌株的抑制作用。将巨大芽孢杆菌b1 菌株悬液用灭菌水逐级稀释至1 × 103~1 ×107CFU/mL 5 个浓度,打取直径6 mm 的甜瓜枯萎菌菌碟,接种于PDA 平皿中心,取灭菌滤纸片,浸润巨大芽孢杆菌悬液后呈品字型放置于平皿边缘处。按照噁霉灵和培养基体积比1 : 9 的比例制作含药PDA 平板,噁霉灵系列质量浓度分别为62.5、125、250、500 和1 000 mg/L,将6 mm的甜瓜枯萎菌菌碟接种于平皿中心。以无菌水处理为对照,25 ℃培养6 d 后,用十字交叉法测量菌落直径,每处理重复3 次,按公式 (1) 计算抑制率。采用SPSS 17.0 软件对数据进行分析,计算毒力回归方程,求出EC50值。
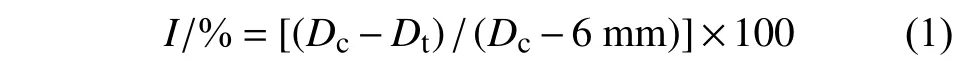
其中,I表示菌丝生长抑制率,%;Dc表示对照菌落直径,mm;Dt表示处理菌落直径,mm。
1.2.4 联用对连作土壤甜瓜枯萎病的缓解效果测定 分别通过盆栽试验和田间试验进行。
1.2.4.1 盆栽试验 将培养好的b1 菌株悬液用灭菌水稀释至2 × 105CFU/mL,噁霉灵原粉用灭菌水稀释至125 和62.5 mg/L。针对连续单作11 年的甜瓜土壤,分别设如下处理:b1 菌株,2 × 105CFU/mL;噁霉灵,125 mg/L;b1 菌株 (2 × 105CFU/mL) + 噁霉灵 (62.5 mg/L);以灭菌水处理为对照。每盆装土3 kg,播2 粒甜瓜种子,每重复10 盆,每处理重复3 次。26 ℃温室中保湿培养,于开花结果期调查并记录甜瓜枯萎病的发病情况,病情分级标准采用庄敬华等的[10]方法。按公式 (2) 和 (3) 分别计算病情指数和防治效果。

其中:DI 为病情指数;DN 为各级发病株数;GN 为各级代表值;DT 为调查总株数;CE为防治效果,%;DIC 为对照组病情指数;DIT 为处理组病情指数。
1.2.4.2 田间试验 于河北省沧州市青县齐营村根枝叶蔬菜种植专业合作社基地日光温室进行。采用随机区组排列,药剂处理与盆栽试验相同,每处理分别设3 个重复小区,每小区面积为33.6 m2。甜瓜苗于2020 年1 月定植,株距30 cm,行距90 cm,采用高垄双行栽培模式,于定植前7 d 按常规施肥量施足底肥、旋耕整地起垄。于100 L水中加入12.5 g 噁霉灵原粉和200 mL b1 菌株悬液 (2 × 108CFU/mL),采用蘸根处理,分别以两种单剂处理和未处理区为对照。于开花结果期调查死苗情况,统计甜瓜枯萎病发病率和防治效果,计算公式见式(4) 和式(5),分析巨大芽孢杆菌b1 菌株与噁霉灵联用对甜瓜枯萎病的影响。

式中:D 为发病率,%;DN 为发病株数;DT 为调查总株数;CE 为防治效果,%;DC为对照组发病率,%;DT为处理组发病率,%。
1.2.5 联用对连作土壤甜瓜生长的影响测定 本部分试验与1.2.4 节的试验同时进行。1.2.5.1 盆栽试验 逐日记录甜瓜出苗率,于苗期及开花结果期调查记录植株地上部分和地下部分干重,按式(6) 计算根冠比,分析巨大芽孢杆菌b1菌株与噁霉灵联用对连作土壤甜瓜生长的影响。
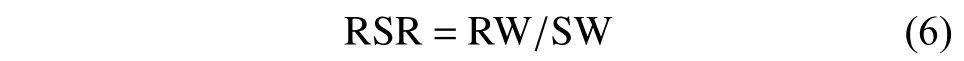
式中:RSR 为根冠比;RW 为地下部分干重,g;SW 为地上部分干重,g。
1.2.5.2 田间试验 分别于甜瓜定植10 d 后调查不同处理组株高;于甜瓜植株拉秧后,每处理随机挑选5 株,将根自嫁接口位置切下,每处理分别装袋,105 ℃高温杀青30 min,75 ℃下烘干至恒重,统计不同处理组单株根重;于收获期调查甜瓜果实质量,计算不同处理组甜瓜产量。
1.2.6 联用对连作甜瓜土壤中微生物优势属丰度的影响测定 于甜瓜定植后10 d,分别采集1.2.4节田间试验各处理组土壤样品,采用1.2.2.2 节方法,以其中优势真菌和细菌为例,比较不同处理组土壤中镰刀菌属和芽孢杆菌属 的相对丰度,分析巨大芽孢杆菌与噁霉灵联用对田间连作甜瓜土壤中微生物优势属的影响。
2 结果与分析
2.1 连作甜瓜土壤对南瓜及甜瓜幼苗生长的影响
采用不同连作年份甜瓜土壤分别穴盘培育南瓜及甜瓜幼苗,结果表明:1 年连作土壤组南瓜根长、株高、根冠比和干重等指标均高于连续单作6 年和11 年土壤,且与11 年连续单作土壤间差异显著;11 年连续单作土壤组南瓜及甜瓜幼苗全株干重均低于1 年土壤组,其中甜瓜幼苗全株干重比1 年土壤组低23.53%,差异显著 (表1)。研究表明,11 年连续单作甜瓜土壤表现出较为明显的连作障碍。

表1 连作甜瓜土壤对南瓜及甜瓜幼苗生长的影响Table 1 Effects of continuous cropping melon soil on the growth of pumpkin and melon seedlings
2.2 连作甜瓜对土壤中微生物的影响
2.2.1 对土壤中微生物数量的影响 不同连作年份甜瓜根际土壤中可培养微生物数量的变化见表2。从中可看出,甜瓜连作可导致土壤中细菌数量减少,真菌数量增加。其中,甜瓜连续单作11 年土壤中细菌和放线菌数量最少,分别比1 年土壤组低1.66 和1.78 倍,且与1 年土壤间差异显著;而11 年连续单作土壤中真菌数量是1 年土壤的10 倍,且与其他各处理组间差异显著。

表2 不同连作年份甜瓜土壤中微生物种群数量变化Table 2 Changes in microbial populations in melon soil with different continuous cropping years
2.2.2 对土壤中真菌和细菌优势属丰度的影响
镰刀菌属包含多种常见植物致病菌,甜瓜枯萎菌即属于该属。对不同连作年限土壤中微生物群落的分析(图1) 表明,随着甜瓜连作年限的增加,土壤中镰刀菌属的相对丰度发生了明显变化 。其中,在连续单作11 年甜瓜的土壤中,镰刀菌属成为优势属,相对丰度 (13.2%) 是1 年土壤的4.27 倍,差异显著。 芽孢杆菌属包含多种可用于防治植物病害的生防菌,有利于植物生长。试验表明,随着甜瓜连作年限增加,土壤微生物中芽孢杆菌属丰度也发生了明显的变化,其中,11 年连续单作土壤中芽孢杆菌属的相对丰度最低,1 年土壤中最高,是11 年土壤的2.65 倍,差异显著。

图1 属分类水平下不同连作年限土壤中镰刀菌属和芽孢杆菌属的相对丰度Fig. 1 The relative abundance of Fusarium and Bacillus under different continuous cropping years
2.3 噁霉灵和巨大芽孢杆菌的相容性及对甜瓜枯萎菌的抑制作用
拮抗作用测定结果表明,当噁霉灵终浓度为100、50 和25 mg/L,b1 菌株活菌数为1.30 × 108、1.26 × 108和1.23 × 108CFU/mL,而空白对照为1.23 × 108CFU/mL,各处理与空白对照间差异均不显著,表明将质量浓度低于100 mg/L 的噁霉灵与巨大芽孢杆菌b1 菌株联用是可行的。
噁霉灵与 b1 菌株对甜瓜枯萎菌T2 菌株的抑制活性测定结果见表3。二者对T2 菌株都具有一定的抑制作用,EC50值分别为10.82 mg/L 和2.02 ×105CFU/mL。

表3 噁霉灵和巨大芽孢杆菌b1 菌株对甜瓜枯萎菌T2 菌株的抑制作用Table 3 Inhibitory effect of hymexazol and B. megaterium b1 on F. oxysporum T2
2.4 巨大芽孢杆菌与噁霉灵联用对连作土壤甜瓜枯萎病的缓解效果
开花结果期是甜瓜枯萎病发病高峰期。室内盆栽试验调查结果见表4,其中巨大芽孢杆菌 b1菌株 + 噁霉灵处理组发病率最低,病情指数最小,防效达42.85%,与空白对照间差异显著。说明将噁霉灵剂量减半后与巨大芽孢杆菌联用,优于两种单剂处理,即可用巨大芽孢杆菌替代部分噁霉灵防控甜瓜枯萎病,达到减施化学药剂的目的。

表4 巨大芽孢杆菌b1 菌株与噁霉灵联用对连作土壤甜瓜枯萎病的盆栽试验防效Table 4 Effect of B. megaterium b1 and hymexazol on Fusarium wilt of melon in continuous cropping soil in the lab
通过田间试验调查不同处理组全生育期甜瓜枯萎病发病情况,结果见表5。采用巨大芽孢杆菌、噁霉灵单剂以及两者联用处理连作甜瓜土壤后,甜瓜枯萎病发病率分别比对照降低了24.77%、100%和100%,防效分别为16.62%、100%和100%。说明将巨大芽孢杆菌b1 菌株与噁霉灵联用可有效防控甜瓜枯萎病,减少化学农药的使用。

表5 巨大芽孢杆菌b1 菌株与噁霉灵联用对连作土壤甜瓜枯萎病的田间防效Table 5 Effects of B. megaterium b1 and hymexazol on Fusarium wilt of melon in continuous cropping soil in the field
2.5 巨大芽孢杆菌与噁霉灵联用对连作土壤甜瓜生长的影响
室内采用连续单作11 年甜瓜的土壤盆栽培育甜瓜,测定巨大芽孢杆菌与噁霉灵联用对甜瓜生长的影响,结果见表6。其中,在甜瓜苗期和伸蔓期,两者联用处理组全株干重分别比CK 组增加了100%和205%,且与其他处理组及CK 间差异显著;在甜瓜开花结果期,经两者联用处理的甜瓜根冠比及全株干重分别比CK 组增加了50%和196.19%。
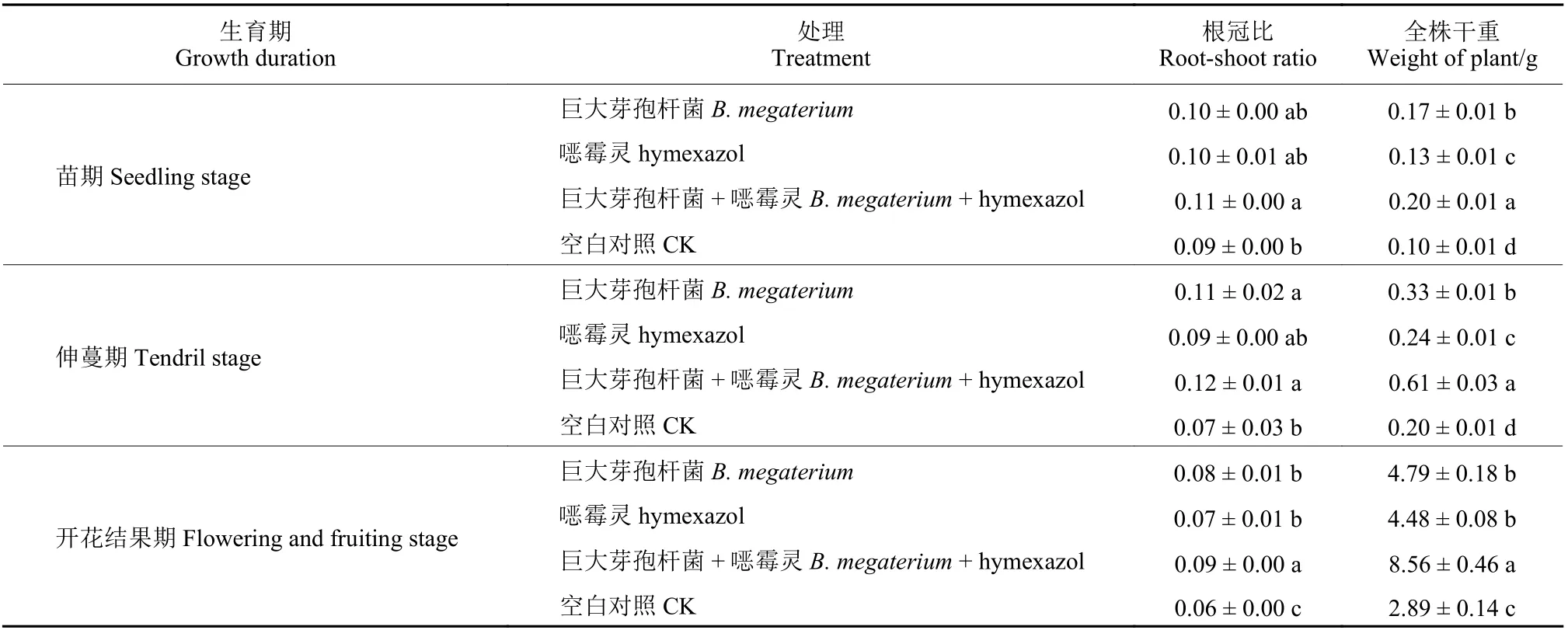
表6 巨大芽孢杆菌b1 菌株与噁霉灵联用对连作土壤室内培育甜瓜植株生长的影响Table 6 Effects of B. megaterium b1 and hymexazol on the growth of melon in continuous cropping soil in the lab
田间试验结果见表7。于甜瓜定植10 d 后开始调查,巨大芽孢杆菌b1 菌株、噁霉灵单剂以及两者联用组甜瓜幼苗株高分别比空白对照高11.19%、10.63%和16.03%,其中联用处理组与空白对照间差异显著。于甜瓜收获期调查产量,与空白对照相比,各处理组甜瓜增产率分别为20.35%、11.23%和26.15%,但各处理与对照间差异不显著。于甜瓜拉秧期调查统计根系干重,结果表明,各处理组单株根系平均干重分别比空白对照提高40.63%、34.69%和64.38%,差异显著。

表7 巨大芽孢杆菌b1 菌株与噁霉灵联用对田间连作甜瓜生长的影响Table 7 Effects of B. megaterium b1 and hymexazol on the growth of melon in continuous cropping soil in the field
综上可见,巨大芽孢杆菌b1 菌株与噁霉灵联用可以促进甜瓜幼苗生长,对采用连作甜瓜土壤种植的甜瓜根系生长具有促进作用,且优于单剂处理,同时可促进甜瓜开花结果,增加产量。表明将巨大芽孢杆菌b1 菌株与降低50%质量浓度的噁霉灵联用,对甜瓜的生长发育具有促进作用,可有效缓解连作土壤引起的连作障碍。
2.6 巨大芽孢杆菌与噁霉灵联用对连作甜瓜土壤中微生物的影响
2.6.1 对土壤中微生物数量的影响 结果见表8。通过巨大芽孢杆菌、噁霉灵单剂及二者联用处理后,甜瓜连作土壤中细菌数量显著提高,分别是空白对照组的5.28、4.75 和6.36 倍,且联用与空白对照和各单剂处理间均差异显著;经各单剂及联用处理后,土壤中真菌数量显著降低,分别比空白对照组降低59.45%、84.62%和86.01%;放线菌数量升高,各处理分别是空白对照组的2.78、1.19 和2.08 倍,其中,巨大芽孢杆菌、巨大芽孢杆菌 + 噁霉灵处理与空白对照间差异显著,但噁霉灵单剂与空白对照间差异不显著。研究表明,巨大芽孢杆菌与噁霉灵联用可有效改善连作甜瓜根区土壤的微生物环境。

表8 巨大芽孢杆菌b1 菌株与噁霉灵联用对甜瓜连作土壤中微生物数量的影响Table 8 Effects of the combined use of B. megaterium b1 strain and hymexazol on the microbial population in continuous cropping melon soil
2.6.2 对土壤中真菌和细菌优势属丰度的影响
根据高通量测序及统计结果,不同处理组土壤中真菌优势属镰刀菌属和细菌优势属芽孢杆菌属相对丰度变化如图2 所示。经巨大芽孢杆菌、噁霉灵单剂以及二者联用处理后,与空白对照相比,土壤中镰刀菌属相对丰度均降低,而芽孢杆菌属相对丰度均提高。其中,巨大芽孢杆菌、噁霉灵、巨大芽孢杆菌 + 噁霉灵及对照土壤中镰刀菌属相对丰度分别为1.14%、0.72%、0.50% 和1.78%,处理组分别比空白对照降低35.96%、59.55%和71.91%,但各处理与对照间差异均不显著;各处理和对照土壤中芽孢杆菌属相对丰度分别为4.71%、6.70%、8.04%和4.55%,各处理组分别比空白对照提高47.25%、3.52%和76.70%,但差异均不显著 (P>0.05)。表明巨大芽孢杆菌b1 菌株与噁霉灵联用可影响土壤中微生物群落结构,减轻连作导致的土壤微生物“真菌化”现象。

图2 不同处理对连作甜瓜土壤中镰刀菌属和芽孢杆菌属相对丰度的影响Fig. 2 Effects of different treatments on the relative abundance of Fusarium and Bacillus in continuous cropping melon soil
3 结论与讨论
连作障碍可使植物的生长发育受到抑制,对其生长指标产生影响[2]。根冠比和全株干重是评价植株长势的重要生理指标。本研究通过穴盘试验发现,11 年连续单作甜瓜土壤组南瓜和甜瓜幼苗根冠比均最低,且与1 年土壤间存在显著差异,说明甜瓜连作存在明显的连作障碍。Cui 等[12]的研究表明,土壤微生物群落变化是导致连作障碍的主要原因,本研究也得到了相似的结论。本研究连作甜瓜土壤中微生物群落变化主要表现为真菌数量上升,而细菌数量下降,且优势菌群发生了明显变化,其中包含甜瓜枯萎菌在内的镰刀菌属逐年富集,而芽孢杆菌属等有益细菌逐年减少。本课题组前期对棚室连作黄瓜的研究表明,施用巨大芽孢杆菌可以增加有益细菌属的相对丰度,同时显著抑制致病菌属的发生[10]。本研究结果表明,巨大芽孢杆菌与噁霉灵联用可使真菌数量降低,细菌数量升高,表明巨大芽孢杆菌与噁霉灵联用能够改善土壤微生物组成,修复土壤微生物群落结构。
为了提高对枯萎病的防控效果,减少噁霉灵等化学药剂的使用,开发芽孢杆菌等生防菌剂一直是生防研究领域的重要方向[13]。文献资料表明,芽孢杆菌代谢过程中能够产生脂肽类抗生素及抗菌蛋白等多种抑菌物质,对多种农业植物病原真菌和细菌有明显的抑制作用[13-14]。巨大芽孢杆菌具有解磷功能,是重要的肥用微生物,田间调查发现,该菌剂在多种蔬菜田间应用后增产效果显著,表现出明显的促生和抗病效应,同时对连作障碍有明显的缓解效应[10]。为了明确其促生和抗病机制,以及对连作土壤的缓解机制,本课题组对巨大芽孢杆菌b1 菌株全基因组序列进行了分析,发现该菌株不仅具有解磷相关基因,还存在嗜铁素及多种脂肽类抗生素等相关基因 (待发表)。这些发现为巨大芽孢杆菌的进一步开发应用奠定了良好的理论基础。
之前已有研究者进行了噁霉灵与其他成分联用对枯萎病防治效果的有益尝试。丁蕾等[15]研究发现,将胺鲜酯 (diethyl aminoethyl hexanoate)、芸苔素 (brassin) 与噁霉灵三者联用,对西瓜枯萎病的预防作用效果显著,但尚未见有关噁霉灵与芽孢杆菌联用防治甜瓜枯萎病的研究报道。本研究通过温室盆栽和田间试验,发现将巨大芽孢杆菌与噁霉灵联用,对甜瓜枯萎病的防治效果优于各单剂处理。分析其原因,可能是由于巨大芽孢杆菌与噁霉灵均具有壮苗促生作用,且低剂量的噁霉灵影响了土壤中微生物的群落结构,在抑制土壤或植株内病原菌及其他微生物的同时,还可以为生防菌创造一个特殊的生态环境,促进其快速稳定定殖,使生防菌得以在植物根系形成有效群体,有助于其充分发挥防治病害的作用。

