含单萜酚结构酰胺类杂合分子的设计与合成及抑菌活性
陶丽红, 李 康, 王显助, 普 特, 史 晶,詹俊杰, 叶 敏*,, 王凯博
(1. 云南农业大学 云南生物资源保护与利用国家重点实验室,昆明 650201;2. 云南省农业科学院 茶叶研究所,昆明 650201)
琥珀酸脱氢酶抑制剂 (succinate dehydrogenase inhibitors,SDHI) 类杀菌剂是继甲氧基丙烯酸酯和三唑类杀菌剂之后的又一类新型杀菌剂,其通过抑制病原菌线粒体呼吸链电子传递系统复合体Ⅱ(即琥珀酸脱氢酶SDH) 而发挥作用[1]。自1969 年第一个商品化的SDHI 类杀菌剂萎锈灵 (carboxin)研发上市以来,SDHI 类杀菌剂经历了半个世纪的发展,防治谱已覆盖由担子菌、子囊菌和半知菌等植物病原真菌引起的灰霉、白粉、叶斑、菌核等病害,该类杀菌剂也成为了生产上使用最为广泛的杀菌剂品种之一[2]。但前期研发的SDHI 类杀菌剂大都以原有活性基团为骨架,或在羧酸部分引入苯环、杂环、卤素等活性基团,或对胺部分进行并环、联苯、增长链长等结构优化改造[3],其设计和结构改造均以直接修饰为主,未考虑病原菌对化合物的抗性风险问题。目前,植物病原真菌已对SDHI 类杀菌剂产生较为普遍的抗性[4]。如,引起草莓、黄瓜、番茄等作物灰霉病的灰葡萄孢Botrytis cinerea已对啶酰菌胺 (boscalid)、吡噻菌胺 (penthiopyrad)、氟吡菌酰胺 (fluopyram)、氟唑菌酰胺 (fluxapyroxad) 和苯并烯氟菌唑(benzovindiflupyr) 等SDHI 类杀菌剂产生了不同程度的抗性,其中对啶酰菌胺和吡噻菌胺的抗性频率高达95%[5-6]。啶酰菌胺和吡噻菌胺在西瓜蔓枯病菌Didymella bryoniae的防治中还存在严重的交互抗性[7]。这些抗性和交互抗性的产生大多与靶标基因突变有关,本课题组前期研究也发现,灰葡萄孢琥珀酸脱氢酶 (BcSDH) 的B-P225F 和B-H272R突变可能引起该菌对SDHI 类杀菌剂产生抗性,也可能引起SDHI 类杀菌剂之间产生交互抗性[8]。
通过药效团拼合,有望设计合成并筛选出具有高抑菌活性和低交互抗性风险的杂合分子。选择合理的药效团并进行拼合是设计高活性杂合分子的关键。杨光富课题组通过药效团拼合设计了吡嗪/吡唑-酰胺-二苯醚骨架,通过取代基优化获得的化合物对大豆灰霉病和小麦白粉病具有优异的防治效果,对立枯丝核菌Rhizoctonia solani的抑制效果优于商品化杀菌剂噻呋酰胺[9-10];且该课题组的最新研究表明,通过碳-硅转换策略设计合成的含三甲基硅取代基的化合物,对大豆锈病的防治效果优于商品化杀菌剂苯并烯氟菌唑[11]。除通过化学合成获得杀菌剂外,天然产物也是杀菌剂活性成分的重要来源,以香芹酚 (2-甲基-5-异丙基苯酚) 和百里香酚 (5-甲基-2-异丙基苯酚) 为代表的天然单萜酚类化合物具有广谱的抑菌活性,已被广泛应用于农药和医药研究领域[12-16]。天然单萜酚类化合物广泛存在于牛至属 (Origanum) 和百里香属 (Thymus) 植物挥发油中,对多种植物病原真菌具有广泛的抑菌活性,具有作为先导化合物进一步开发应用的潜力[17-18]。将单萜酚引入杀菌剂分子中能够提高杀菌活性,如甲氧基丙烯酸酯类的醚菌酯和醚菌胺是将2-甲基苯酚和2,5-二甲基苯酚与药效团结合成醚[19],由此推测,引入天然单萜酚也有可能提高SDHI 杀菌剂的抑菌活性。SDHI 类杀菌剂属于芳基取代酰胺类化合物,选择合理的SDHI药效团与作用方式独特的单萜酚类化合物通过酰胺键拼合,有望获得结构新颖、活性高、交互抗性风险低,兼具内吸性杀菌剂和天然产物优点的杂合分子。
因此,本研究拟通过设计、合成“单萜酚 +SDHI 药效团”型的杂合分子,并测定其对几种常见植物病原真菌的生物活性,以期筛选出具有活性高、与SDHI 类杀菌剂之间没有交互抗性、可作为新型杀菌剂活性成分的化合物,旨在为植物病害抗性治理提供新的选择。通过研究高活性杂合分子对植物病原菌SDH 的抑制活性及其与野生型和突变型SDH 间的结合模式,初步明确高活性杂合分子的抑菌机制,为杂合分子的进一步结构修饰奠定理论基础。
目标化合物6a~6o 和7a~7o 的合成路线如图式1所示。

图式1 目标化合物6a~6o 和7a~7o 的合成路线Scheme 1 Synthetic routes of compounds 6a-6o and 7a-7o
1 材料与方法
1.1 仪器
AL104 型电子天平 (梅特勒-托利多仪器上海有限公司);IKA PCR BASIC 型磁力搅拌器;N-1100型旋转蒸发仪 (上海泉杰仪器有限公司);SWCJ 型超净工作台 (苏州安泰空气技术有限公司);HG303-3 型恒温培养箱 (南京实验仪器厂制造);YXQ-LS-50S II 型立式压力蒸汽灭菌锅 (上海博迅实业有限公司医疗设备厂);Bruker AM-400 MHz 或500 MHz 核磁共振波谱仪;LTQOrbitrapXL 超高效液相-静电场轨道傅里叶变换高分辨质谱仪 (HRMS)。
1.2 试剂
香芹酚 (carvacrol) 和百里香酚 (thymol),98%分析纯,上海阿拉丁生化科技股份有限公司;其余所用试剂和溶剂均为市售分析纯,试剂未经进一步纯化直接使用;柱层析所用硅胶为200~300 目 (筛孔径50~75 μm,青岛海洋化工厂有限公司)。牛血清标准蛋白 (Sigma 公司),考马斯亮蓝G-250 (Solarbio 公司),SDH 试剂盒 (南京建成生物工程研究所)。
1.3 供试菌种
茄链格孢菌Alternaria solani,由中国农业大学植物保护学院提供;尖孢镰刀菌Fusarium oxysporum,由云南省农业科学院农业环境资源研究所提供;立枯丝核菌Rhizoctonia solani,为云南农业大学云南省植物病理重点实验室保藏菌种;灰葡萄孢Botrytis cinerea或BcS和山茶炭疽菌Colletotrichum camelliae,分别为玫瑰和茶叶田间采集菌种,经纯化、单孢分离、ITS 测序后保存于云南农业大学植物病理重点实验室;灰葡萄孢的啶酰菌胺高抗菌株 (BcR,EC50>500 μg/mL) 为室内诱导获得的菌群,未进行进一步的单孢分离;灰葡萄孢B-P225F 突变株 (BcP225F,即sdhB 的脯氨酸 (Pro, P) 突变为苯丙氨酸 (Phe, F) ) 为室内诱导的单孢分离菌株,经测序鉴定为B-P225F 突变。
1.4 试验方法
1.4.1 化合物的合成 中间体及目标化合物的合成参照文献[20]进行。
化合物1 (5-异丙基-2-甲基-4-亚硝基苯酚) 的合成:将30 mmol 的香芹酚溶解于75 mL 乙醇中,加入75 mL 盐酸,0 ℃下分批缓慢加入30 mmol亚硝酸钠,低温搅拌反应2 h,待反应完成后加入600 mL 蒸馏水,析出黄色蓬松状固体,经过滤、水洗、干燥后得化合物1,收率63%,m. p. 95~96 ℃,1H NMR 和熔点数据与文献值[21]一致。
化合物2 (4-氨基-5-异丙基-2-甲基苯酚) 的合成:参考文献方法[20]制备,取2 mmol 化合物1 置于100 mL 圆底烧瓶中,加入20 mL 甲醇作溶剂,以36 mg 钯碳 (10%) 作催化剂,用N2置换3 次,H2置换3 次,以气球供氢气,常压过夜反应后过滤,浓缩得白色粉末,即化合物2,收率77%,但该化合物不稳定,常温下易被氧化变紫,难以打谱确证。同法合成化合物3。
化合物5a (邻碘苯甲酰氯) 的合成:将2.4 mmol邻碘苯甲酸 (4a) 溶解于2 mL 氯化亚砜中,85 ℃下回流2 h,减压除去残余的氯化亚砜,所得酰氯产物直接溶解于2 mL 四氢呋喃中备用。同法合成5b~5o。
目标化合物6a (N-(4-羟基-2-异丙基-5-甲基苯)-2-碘苯甲酰胺) 的合成:取2.4 mmol 中间体2 溶解于4 mL 四氢呋喃中,加入4 mmol 三乙胺。在0 ℃下将5a 的THF 溶液缓慢滴加到反应体系中,滴加完成后在室温下继续搅拌,待反应完成后加入20 mL 蒸馏水,二氯甲烷萃取 (20 mL × 3),合并有机相,干燥浓缩柱层析 (V(石油醚) :V(乙酸乙酯)=5 : 1),得到目标化合物6a。同法合成6b~6o 和7a~7o。
1.4.2 化合物结构鉴定 对目标化合物6a~6o 和7a~7o 进行结构鉴定。测定1H NMR、13C NMR 数据时,TMS 为内标,CDCl3或DMSO-d6为溶剂;测定HRMS 数据使用甲醇为溶剂。
1.4.3 抑菌活性测定 采用菌丝生长速率法[22]。以二甲基亚砜 (DMSO) 为溶剂配制质量浓度分别为1 000 和5 000 μg/mL 的化合物母液。待PDA 培养基冷却至45 ℃时,按母液与培养基体积比为1 :100 的量将化合物母液加入培养基中,充分混匀后倾倒至直径9 cm 的培养皿中,每皿15 mL 左右,制成终浓度为10 和50 μg/mL 带药平板。空白对照加入与处理组等量的DMSO。
将供试病原菌活化两代后,在菌落边缘打取直径0.5 cm 的菌饼,分别接种到带药和空白对照PDA 平板上,每处理重复3 次。于26 ℃ ± 0.5 ℃下黑暗培养,待空白对照组菌落生长至平板边缘时,以十字交叉法测量菌落直径,按式 (1) 计算化合物对菌丝生长的抑制率。重复3 次,求取平均值和标准差。

式 (1) 中:I表示抑制率;DC和DT分别表示对照和处理菌落直径,cm;0.5 为菌饼直径,cm。
对于初筛效果好的化合物,设制合理的浓度梯度以相同的方法进行复筛,利用Probit 模型对浓度对数和抑菌率几率值进行线性回归分析,求得EC50值,进一步评价化合物的抑菌活性。
1.4.4 SDH 活性测定 参照刘晓漫[23]的方法进行病原菌培养并加以改进。于250 mL 锥形瓶中加入100 mL 已灭菌的PDB (PDA 不加琼脂粉) 培养基;将已在PDA 培养基上培养3 d 的灰葡萄孢用直径0.5 cm 的打孔器丛菌落边缘打取菌饼,每个锥形瓶中加入5 个菌饼,在26 ℃±0.5 ℃的恒温振荡培养箱中以100 r/min 培养2 d;加入终浓度分别为10、50 和100 μg/mL 的啶酰菌胺和杂合分子7e,以等量的DMSO 作为空白对照,继续培养2 d 后过滤收集菌丝,用蒸馏水冲洗3 次,滤纸吸除多余水分备用。每个处理平行重复3 次。
蛋白质标准曲线的绘制及灰葡萄孢蛋白质含量的测定参照文献方法[23-24]进行。取0.1 mL 灰葡萄孢菌不同处理的蛋白质提取液,分别加入5 mL考马斯亮蓝G-250 溶液,室温下反应5 min 后于595 nm 处测定吸光度值,根据蛋白质标准曲线算出灰葡萄孢菌各处理的蛋白质含量。SDH 活性按照试剂盒陈述的方法测定。将配好的工作液于37 ℃恒温水浴锅中预温5 min,取1 cm 厚度的石英比色皿,用分光光度计在600 nm 处以双蒸水调零;在试管中先加入100 μL 酶液后迅速加入2.6 mL工作液,摇匀并计时,迅速倒入比色皿中,用分光光度计在600 nm 处分别读取5 s 和65 s 时的吸光度值 (OD1和OD2),定义每毫克蛋白每分钟使反应体系吸光度降低0.01 为一个酶活单位。按式(2) 计算SDH 比活力。

式 (2) 中:SDHSA 表示琥珀酸脱氢酶的比活力,CP表示待测蛋白浓度。
1.4.5 数据统计分析 用Excel 软件对数据进行统计,用SPSS 22 软件对各组数据进行处理;抑菌活性数据结合Duncan’s multiple range test 进行单向ANOVA 分析,评价处理间的差异显著性和重复间的离散度;用Origin 2016 软件进行绘图。
2 结果与分析
2.1 化合物的合成
以香芹酚或百里香酚为原料,通过亚硝基化反应得单萜酚的对亚硝基衍生物,再通过催化还原得到单萜酚的对氨基衍生物。羧酸4a~4o 在氯化亚砜中回流得到羧酸酰氯产物5a~5o;5a~5o 与单萜酚的对氨基衍生物在碱性条件下酰胺化得到含单萜结构的酰胺类杂合分子6a~6o 或7a~7o。化合物结构表征如下。
N-(4-羟基-2-异丙基-5-甲基苯)-2-碘苯甲酰胺(6a)为白色粉末状固体,收率78%。1H NMR (400 MHz, Chloroformd),δ: 7.92 (d,J= 7.9 Hz, 1H), 7.54 (d,J= 7.6 Hz, 1H),7.48~7.38 (m, 2H), 7.15 (t,J= 7.7 Hz, 1H), 7.09 (s, 1H), 6.75(s, 1H), 4.86 (s, 1H), 3.18~3.06 (m, 1H), 2.24 (s, 3H), 1.23 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ:168.35, 152.90, 142.47, 141.97, 140.05, 131.35, 128.45,128.41, 128.34, 125.77, 121.87, 112.35, 92.35, 28.02, 23.39,15.42. HRMS, C17H19INO2[M + H]+,计算值 396.045 5,实测值396.046 0.
N-(4-羟基-2-异丙基-5-甲基苯)-2-(三氟甲基)苯甲酰胺(6b)为白色固体,收率83%。1H NMR (400 MHz, DMSOd6),δ: 9.75 (s, 1H), 9.23 (s, 1H), 7.86~7.76 (m, 2H), 7.74~7.62(m, 2H), 6.93 (s, 1H), 6.74 (s, 1H), 3.24~3.03 (m, 1H), 2.10 (s,3H), 1.13 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 166.62, 154.27, 142.93, 136.76, 132.52, 129.71, 129.62,128.55, 126.30, 126.26, 125.08, 122.79, 121.33, 111.27, 27.08,23.36, 15.51. HRMS: C18H19F3NO2[M + H]+,计算值 338.136 2,实测值338.136 8.
N-(4-羟基-2-异丙基-5-甲基苯)-2-甲基苯甲酰胺(6c)为白色粉末状固体,收率89%。1H NMR (400 MHz,Chloroform-d),δ: 7.51 (d,J= 7.9 Hz, 1H), 7.41~7.31 (m, 2H),7.31~7.22 (m, 2H), 7.14 (s, 1H), 6.72 (s, 1H), 5.27 (s, 1H),3.07~2.93 (m, 1H), 2.54 (s, 3H), 2.20 (s, 3H), 1.21 (d,J=6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 169.33,153.04, 141.75, 136.49, 131.28, 130.20, 128.70, 126.60,125.93, 122.08, 112.51, 28.14, 23.20, 19.91, 15.44. HRMS:C18H22NO2[M + H]+,计算值 284.164 5,实测值284.165 0.
N-(4-羟基-2-异丙基-5-甲基苯)苯甲酰胺(6d)为白色粉末状固体,收率90%。1H NMR (400 MHz, DMSO-d6),δ:9.66 (s, 1H), 9.20 (s, 1H), 7.96 (d,J= 7.3 Hz, 2H), 7.60~7.54(m, 1H), 7.50 (t,J= 7.3 Hz, 2H), 6.87 (s, 1H), 6.73 (s, 1H),3.08~2.94 (m, 1H), 2.09 (s, 3H), 1.10 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 166.04, 154.23, 143.32,134.72, 131.29, 130.38, 128.36, 127.48, 125.85, 121.23,111.29, 27.46, 23.26, 15.46. HRMS: C17H20NO2[M + H]+,计算值 270.148 9,实测值270.149 4.
N-(4-羟基-2-异丙基-5-甲基苯)-3-甲基噻吩-2-酰胺(6e) 为浅黄色结晶,收率80%。1H NMR (400 MHz,Chloroform-d),δ: 7.33 (d,J= 4.8 Hz, 2H), 7.24 (s, 1H), 6.95(d,J= 5.0 Hz, 1H), 6.71 (s, 1H), 5.43~5.06 (m, 1H), 3.09~2.94(m, 1H), 2.59 (s, 3H), 2.17 (s, 3H), 1.21 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 162.22, 152.81,142.02, 141.49, 132.33, 128.61, 126.75, 126.15, 121.95,112.44, 28.18, 23.13, 15.87, 15.41. HRMS: C16H20NO2S [M +H]+,计算值 290.120 9,实测值290.121 3.
N-(4-羟基-2-异丙基-5-甲基苯)噻吩-2-酰胺(6f)为浅黄色结晶,收率83%。1H NMR (500 MHz, DMSO-d6),δ: 9.66(s, 1H), 9.21 (s, 1H), 7.94~7.89 (m, 1H), 7.79~7.75 (m, 1H),7.17 (t,J= 4.2 Hz, 1H), 6.84 (s, 1H), 6.71 (s, 1H), 3.15~2.84(m, 1H), 2.06 (s, 3H), 1.07 (d,J= 6.8 Hz, 6H).13C NMR(126 MHz, DMSO-d6),δ: 160.77, 154.36, 143.44, 140.18,131.04, 130.38, 128.47, 128.00, 125.25, 121.33, 111.33, 27.48,23.26, 15.44. HRMS: C15H18NO2S [M + H]+,计算值 276.105 3,实测值276.105 8.
N-(4-羟基-2-异丙基-5-甲基苯)-2-甲基-4-(三氟甲基)噻唑-5-酰胺(6g)为浅黄色固体,收率77%。1H NMR (400 MHz, Chloroform-d),δ: 6.82 (s, 1H), 6.61 (s, 1H), 2.98~2.86(m, 1H), 2.81 (s, 3H), 2.13 (s, 3H), 1.18 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 170.38, 158.00,143.23, 139.46, 138.27, 123.35, 120.87, 112.64, 27.33, 22.97,19.56, 17.01. HRMS: C16H18F3N2O2S [M + H]+,计算值 359.103 6,实测值359.103 9.
N-(4-羟基-2-异丙基-5-甲基苯)噻唑-5-酰胺(6h)为浅黄色固体,收率81%。1H NMR (400 MHz, DMSO-d6),δ:9.91 (s, 1H), 9.27 (d,J= 6.6 Hz, 2H), 8.63 (s, 1H), 6.88 (s,1H), 6.74 (s, 1H), 3.06~2.94 (m, 1H), 2.08 (s, 3H), 1.10 (d,J=6.8 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 159.50,158.16, 154.54, 143.86, 143.38, 135.82, 130.24, 124.79,121.47, 111.38, 27.50, 23.27, 15.43. HRMS: C14H17N2O2S [M+ H]+,计算值 277.100 5,实测值277.100 8.
N-(4-羟基-2-异丙基-5-甲基苯)-1-甲基-3-(三氟甲基)-1H-吡唑-4-酰胺(6i) 为浅黄色粉末状固体,收率83%。1H NMR (400 MHz, Chloroform-d),δ: 8.12 (s, 1H), 6.82 (s, 1H),6.55 (s, 1H), 4.01 (s, 3H), 2.91~2.79 (m, 1H), 2.08 (s, 3H),1.23 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 159.42, 141.41, 141.37, 136.91, 131.44, 127.88, 118.73,117.91, 39.93, 27.67, 22.19, 15.78. HRMS: C16H19F3N3O2[M+ H]+,计算值 342.142 4,实测值342.142 9.
5-氯-N-(4-羟基-2-异丙基-5-甲基苯)-1,3-二甲基-1H-吡唑-4-酰胺(6j) 为浅黄色固体,收率78%。1H NMR (400 MHz, Chloroform-d),δ: 6.84 (s, 1H), 6.56 (s, 1H), 3.97 (s,3H), 2.95~2.77 (m, 1H), 2.09 (s, 3H), 1.24 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 160.91, 152.75,151.21, 141.17, 128.61, 125.87, 122.00, 112.30, 111.66, 36.36,28.04, 23.18, 15.44, 14.58. HRMS: C16H21ClN3O2[M + H]+,计算值 322.131 7,实测值322.132 4.
N-(4-羟基-2-异丙基-5-甲基苯)-1-甲基-1H-吡唑-4-酰胺(6k) 为浅黄色粉末状固体,收率83%。1H NMR (400 MHz,Chloroform-d),δ: 7.54 (s, 1H), 7.39 (s, 1H), 6.72 (s, 1H), 3.85(s, 3H), 3.17~2.93 (m, 1H), 2.52 (s, 3H), 2.19 (s, 3H), 1.21 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ:161.57, 141.68, 141.62, 141.16, 133.90, 131.49, 128.03,118.93, 117.95, 114.50, 39.42, 27.65, 22.24, 15.82. HRMS:C15H20N3O2[M + H]+,计算值 274.155 0,实测值274.155 5.
2-氯-N-(4-羟基-2-异丙基-5-甲基苯)烟酰胺(6l)为黄色固体,收率84%。1H NMR (400 MHz, Chloroform-d),δ:8.52 (dd,J= 4.8, 2.0 Hz, 1H), 8.26 (dd,J= 7.7, 2.0 Hz, 1H),7.91 (s, 1H), 7.42 (dd,J= 7.7, 4.7 Hz, 1H), 6.76 (s, 1H),3.16~3.04 (m, 1H), 2.22 (s, 3H), 1.23 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 163.67, 153.20, 151.25,146.93, 142.09, 140.43, 131.34, 128.56, 125.50, 125.50,123.03, 122.08, 112.42, 28.15, 23.29, 15.43. HRMS:C16H18ClN2O2[M + H]+,计算值 305.105 1,实测值305.105 7.
N-(4-羟基-2-异丙基-5-甲基苯)烟酰胺(6m)为黄色粉末状固体,收率79%。1H NMR (400 MHz, DMSO-d6),δ:9.87 (s, 1H), 9.25 (s, 1H), 9.11 (s, 1H), 8.75 (d,J= 4.6 Hz,1H), 8.29 (d,J= 7.9 Hz, 1H), 7.60~7.51 (m, 1H), 6.90 (s, 1H),6.75 (s, 1H), 3.09~2.97 (m, 1H), 2.09 (s, 3H), 1.11 (d,J= 6.8 Hz,6H).13C NMR (126 MHz, DMSO-d6),δ: 164.62, 154.40,151.97, 148.56, 143.27, 135.26, 130.25, 130.22, 125.33,123.57, 121.36, 111.35, 27.47, 23.27, 15.45. HRMS:C16H19N2O2[M + H]+,计算值 271.144 1,实测值271.144 4.
N-(4-羟基-2-异丙基-5-甲基苯)-2-甲基呋喃-3-酰胺(6n)为黄色粉末状固体,收率86%。1H NMR (500 MHz,DMSO-d6),δ: 9.16~9.11 (m, 2H), 7.54 (d,J= 2.0 Hz, 1H),6.99 (d,J= 2.1 Hz, 1H), 6.81 (s, 1H), 6.69 (s, 1H), 3.02~2.93(m, 1H), 2.50 (s, 3H), 2.06 (s, 3H), 1.07 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 162.48, 156.14, 154.15,143.36, 140.66, 130.50, 125.51, 121.15, 115.86, 111.23,109.44, 27.41, 23.25, 15.43, 13.25. HRMS: C16H20NO3[M +H]+,计算值 274.143 8,实测值274.144 4.
N-(4-羟基-2-异丙基-5-甲基苯)呋喃-3-酰胺(6o)为浅黄色粉末状固体,收率73%。1H NMR (400 MHz, DMSOd6),δ: 9.38 (s, 1H), 9.22 (s, 1H), 8.29 (s, 1H), 7.76 (s, 1H),6.96 (s, 1H), 6.84 (s, 1H), 6.72 (s, 1H), 3.05~2.93 (m, 1H),2.07 (s, 3H), 1.08 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz,DMSO-d6),δ: 161.26, 154.26, 145.43, 144.07, 143.39, 130.35,125.24, 122.88, 121.27, 111.30, 109.23, 27.42, 23.27, 15.44.HRMS: C15H18NO3[M + H]+,计算值 260.128 1,实测值260.128 2.
N-(4-羟基-5-异丙基-2-甲基苯)-2-碘苯甲酰胺(7a)为浅黄色粉末状固体,收率80%。1H NMR (500 MHz, DMSOd6),δ: 9.58 (s, 1H), 9.17 (s, 1H), 7.90 (d,J= 7.8 Hz, 1H),7.50~7.46 (m, 2H), 7.19 (t,J= 8.5 Hz, 1H), 7.07 (s, 1H), 6.63(s, 1H), 3.19~3.09 (m, 1H), 2.17 (s, 3H), 1.14 (d,J= 6.9 Hz,6H).13C NMR (126 MHz, DMSO-d6),δ: 167.79, 152.50,143.38, 139.09, 131.69, 131.66, 130.74, 128.18, 128.03,127.07, 124.23, 116.31, 93.58, 26.31, 22.56, 17.92. HRMS:C17H19INO2[M + H]+,计算值 396.045 5,实测值396.046 1.
N-(4-羟基-5-异丙基-2-甲基苯)-2-(三氟甲基)苯甲酰胺(7b) 为浅黄色结晶,收率79%。1H NMR (500 MHz,DMSO-d6),δ: 10.06 (s, 1H), 7.84 (d,J= 7.9 Hz, 1H),7.81~7.74 (m, 2H), 7.70 (t,J= 7.2 Hz, 1H), 7.43 (s, 1H), 7.09(s, 1H), 3.18~3.09 (m, 1H), 2.21 (s, 3H), 1.13 (dd,J= 6.8, 3.3 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 165.97, 143.18,138.75, 136.17, 134.46, 132.56, 132.33, 130.01, 128.80,124.56, 123.86, 26.30, 23.10, 22.78, 17.25. HRMS:C18H19F3NO2[M + H]+,计算值 338.136 2,实测值338.136 8.
N-(4-羟基-5-异丙基-2-甲基苯)-2-甲基苯甲酰胺(7c)为白色固体,收率86%。1H NMR (500 MHz, DMSO-d6),δ:9.46 (s, 1H), 9.15 (s, 1H), 7.48 (d,J= 7.6 Hz, 1H), 7.34 (t,J=7.4 Hz, 1H), 7.29~7.22 (m, 2H), 6.99 (s, 1H), 6.64 (s, 1H),3.19~3.10 (m, 1H), 2.41 (s, 3H), 2.12 (s, 3H), 1.14 (d,J=6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 167.98,152.43, 137.43, 135.19, 131.77, 131.69, 130.45, 129.30,127.50, 127.24, 125.55, 124.44, 116.33, 26.28, 22.55, 19.52,17.79. HRMS: C18H22NO2[M + H]+,计算值 284.164 5,实测值284.164 6.
N-(4-羟基-5-异丙基-2-甲基苯)苯甲酰胺(7d)为白色粉末状固体,收率79%。1H NMR (400 MHz, DMSO-d6),δ:9.70 (s, 1H), 9.18 (s, 1H), 8.00~7.93 (m, 2H), 7.57 (t,J=7.2 Hz, 1H), 7.50 (t,J= 7.4 Hz, 2H), 6.97 (s, 1H), 6.67 (s, 1H),3.23~3.11 (m, 1H), 2.08 (s, 3H), 1.15 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 165.24, 152.51, 134.68,132.22, 131.75, 131.30, 128.35, 127.62, 127.50, 124.72,116.31, 26.13, 22.57, 17.62. HRMS: C17H20NO2[M + H]+,计算值270.148 9,实测值270.149 5.
N-(4-羟基-5-异丙基-2-甲基苯)-3-甲基噻吩-2-酰胺(7e) 为浅黄色结晶,收率60%。1H NMR (400 MHz,Chloroform-d),δ: 7.37~7.28 (m, 3H), 6.95 (d,J= 5.0 Hz, 1H),6.52 (s, 1H), 5.97 (s, 1H), 3.20~3.08 (m, 1H), 2.60 (s, 3H),1.21 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 151.63, 141.80, 133.05, 132.29, 130.59, 127.49, 127.06,123.29, 117.46, 26.80, 22.55, 17.62, 15.98. HRMS:C16H20NO2S [M + H]+,计算值 290.120 9,实测值290.121 5.
N-(4-羟基-5-异丙基-2-甲基苯)噻吩-2-酰胺(7f)为浅黄色固体,收率96%。1H NMR (500 MHz, DMSO-d6),δ: 9.72(s, 1H), 9.19 (s, 1H), 7.91 (d,J= 3.7 Hz, 1H), 7.78 (d,J= 5.0 Hz,1H), 7.18 (t,J= 4.4 Hz, 1H), 6.92 (s, 1H), 6.64 (s, 1H),3.19~3.10 (m, 1H), 2.05 (s, 3H), 1.13 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 159.99, 152.65, 140.18,132.37, 131.84, 131.07, 128.48, 128.00, 127.03, 124.77,116.34, 26.09, 22.55, 17.62. HRMS: C15H18NO2S [M + H]+,计算值 276.105 3,实测值276.105 9.
N-(4-羟基-5-异丙基-2-甲基苯)-2-甲基-4-(三氟甲基)噻唑-5-酰胺(7g) 为黄色固体,收率72%。1H NMR (400 MHz, Chloroform-d),δ: 6.86 (s, 1H), 6.55 (s, 1H), 2.91~2.83(m, 1H), 2.80 (s, 3H), 2.10 (s, 3H), 1.24 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ: 170.36, 157.56,141.73, 141.39, 131.49, 127.62, 118.43, 117.86, 27.68, 22.16,19.55, 15.79. HRMS: C16H18F3N2O2S [M + H]+,计算值 359.103 6,实测值359.104 2.
N-(4-羟基-5-异丙基-2-甲基苯)噻唑-5-酰胺(7h)为浅黄色固体,收率77%。1H NMR (400 MHz, DMSO-d6),δ:9.97 (s, 1H), 9.27 (s, 2H), 8.62 (s, 1H), 6.95 (s, 1H), 6.67 (s,1H), 3.22~3.10 (m, 1H), 2.08 (s, 3H), 1.14 (d,J= 6.9 Hz,6H).13C NMR (126 MHz, DMSO-d6),δ: 158.71, 158.15,152.84, 143.90, 135.82, 132.33, 131.96, 126.61, 124.66,116.38, 26.08, 22.53, 17.58. HRMS: C14H17N2O2S[M + H]+,计算值 277.100 5,实测值277.101 0.
N-(4-羟基-5-异丙基-2-甲基苯)-1-甲基-3-(三氟甲基)-1H-吡唑-4-酰胺(7i) 为黄色粉末状固体,收率91%。1H NMR (500 MHz, DMSO-d6),δ: 9.45 (s, 1H), 9.17 (s, 1H), 8.43(s, 1H), 6.91 (s, 1H), 6.62 (s, 1H), 3.95 (s, 3H), 3.18~3.09 (m,1H), 2.03 (s, 3H), 1.12 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 158.74, 152.50, 134.02, 131.98, 131.76,127.03, 124.30, 116.65, 116.35, 26.15, 22.54, 17.55. HRMS:C16H19F3N3O2[M + H]+,计算值 342.142 4,实测值342.142 5.
5-氯-N-(4-羟基-5-异丙基-2-甲基苯)-1,3-二甲基-1H-吡唑-4-酰胺(7j)为浅黄色固体,收率80%。1H NMR (500 MHz, DMSO-d6),δ: 9.13 (s, 1H), 8.99 (s, 1H), 7.06 (s, 1H),6.62 (s, 1H), 3.75 (s, 3H), 3.20~3.04 (m, 1H), 2.30 (s, 3H),2.08 (s, 3H), 1.13 (d,J= 6.8 Hz, 6H).13C NMR (126 MHz,DMSO-d6),δ: 160.23, 152.19, 147.12, 131.65, 131.11, 127.49,126.39, 123.68, 116.37, 113.54, 35.97, 26.24, 22.54, 17.83,13.43. HRMS: C16H21ClN3O2[M + H]+,计算值 322.131 7,实测值322.132 3.
N-(4-羟基-5-异丙基-2-甲基苯)-1-甲基-1H-吡唑-4-酰胺(7k)为浅黄色粉末状固体,收率84%。1H NMR (400 MHz,Chloroform-d),δ: 8.04 (s, 1H), 8.01 (s, 1H), 6.78 (s, 1H), 6.61(s, 1H), 3.98 (s, 3H), 3.01~2.89 (m, 1H), 2.13 (s, 3H), 1.17 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, Chloroform-d),δ:161.98, 142.63, 141.66, 139.74, 138.62, 133.90, 123.96,120.84, 114.57, 112.80, 39.43, 27.37, 23.02, 17.04. HRMS:C15H20N3O2[M + H]+,计算值 274.155 0,实测值274.155 5.
2-氯-N-(4-羟基-5-异丙基-2-甲基苯)烟酰胺(7l)为黄色固体,收率87%。1H NMR (500 MHz, DMSO-d6),δ: 9.82 (s,1H), 9.21 (s, 1H), 8.49 (d,J= 4.8 Hz, 1H), 8.06 (d,J= 7.5 Hz,1H), 7.52 (d,J= 7.5 Hz, 1H), 7.06 (s, 1H), 6.64 (s, 1H),3.23~3.10 (m, 1H), 2.15 (s, 3H), 1.14 (d,J= 6.7 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 163.85, 152.63, 150.22,146.53, 138.25, 133.55, 131.82, 131.51, 126.68, 123.93,123.12, 116.42, 26.26, 22.53, 17.66. HRMS: C16H18ClN2O2[M + H]+,计算值 305.105 1,实测值305.105 5.
N-(4-羟基-5-异丙基-2-甲基苯)烟酰胺(7m)为浅黄色粉末状固体,收率69%。1H NMR (500 MHz, DMSO-d6),δ:9.84 (s, 1H), 9.22 (s, 1H), 9.10 (s, 1H), 8.73 (d,J= 4.8 Hz,1H), 8.27 (dt,J= 8.0, 1.9 Hz, 1H), 7.56~7.49 (m, 1H), 6.89 (s,1H), 6.73 (s, 1H), 3.05~2.98 (m, 1H), 2.07 (s, 3H), 1.09 (d,J=6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 164.60,154.40, 151.97, 148.57, 143.26, 135.25, 130.25, 130.22,125.34, 123.56, 121.36, 111.34, 27.47, 23.28, 15.45. HRMS:C16H19N2O2[M + H]+,计算值 271.144 1,实测值271.144 0.
N-(4-羟基-5-异丙基-2-甲基苯)-2-甲基呋喃-3-酰胺(7n)为黄色粉末状固体,收率89%。1H NMR (400 MHz,DMSO-d6),δ: 9.21 (s, 1H), 9.16 (s, 1H), 7.56 (s, 1H), 7.00 (s,1H), 6.90 (s, 1H), 6.65 (s, 1H), 3.21~3.08 (m, 1H), 2.05 (s,3H), 1.14 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz, DMSO-d6),δ: 161.73, 156.19, 152.44, 140.64, 132.30, 131.71, 127.30,124.81, 116.27, 115.85, 109.44, 26.10, 22.56, 17.66, 13.26.HRMS: C16H20NO3[M + H]+,计算值 274.143 8,实测值274.144 6.
N-(4-羟基-5-异丙基-2-甲基苯)呋喃-3-酰胺(7o)为浅黄色粉末状固体,收率72%。1H NMR (500 MHz, DMSOd6),δ: 9.42 (s, 1H), 9.18 (s, 1H), 8.27 (s, 1H), 7.75 (s, 1H),6.94 (s, 1H), 6.90 (s, 1H), 6.64 (s, 1H), 3.19~3.09 (m, 1H),2.04 (s, 3H), 1.12 (d,J= 6.9 Hz, 6H).13C NMR (126 MHz,DMSO-d6),δ: 160.46, 152.55, 145.45, 144.07, 132.29, 131.78,127.06, 124.69, 122.91, 116.32, 109.22, 26.07, 22.56, 17.64.HRMS: C15H18NO3[M + H]+,计算值 260.128 1,实测值260.128 6.
2.2 抑菌活性
在10 和50 μg/mL 质量浓度下,目标化合物对5 种植物病原菌的抑菌活性如表1 和表2 所示。由表1 数据可以看出:在10 μg/mL 下,目标化合物对茄链格孢菌和灰葡萄孢的抑菌活性较好,但对山茶炭疽菌、尖孢镰刀菌和立枯丝核菌的抑制率均低于50%。其中,6e、6f 和7d、7e、7n 对茄链格孢菌的抑菌活性较好;7e 和7n 对灰葡萄孢的抑制率为65%以上,显著高于阳性对照香芹酚和百里香酚;7e 较香芹酚和百里香酚对山茶炭疽菌具有更高的抑菌活性;目标化合物对尖孢镰刀菌的抑制率均小于30%;6g 和7g、7j 对立枯丝核菌的抑制率显著高于香芹酚和百里香酚。

表1 目标化合物在10 μg/mL 下对植物病原真菌的抑菌活性Table 1 The antifungal activity of hybrid molecules against pathogenic fungi at 10 μg/mL

续表1Table 1 (Continued)
由表2 数据可以看出:在50 μg/mL 下,目标化合物对山茶炭疽菌、尖孢镰刀菌和立枯丝核菌的抑菌活性均较低,对山茶炭疽菌和尖孢镰刀菌的抑制率显著低于阳性对照香芹酚和百里香酚。6e、6f 和7a、7b、7d、7n 对茄链格孢菌的抑制率高于80%;7d 和7n 对灰葡萄孢的抑制率高于75%;7j 对立枯丝核菌的抑菌活性显著高于阳性对照百里香酚,其抑制率为75.11%。

表2 目标化合物在50 μg/mL 下对植物病原真菌的抑菌活性Table 2 The antifungal activity of hybrid molecules against pathogenic fungi at 50 μg/mL

续表2Table 2 (Continued)
综上所述,合成的30 个“单萜酚 + SDHI 药效团”型酰胺类化合物在测定质量浓度下对茄链格孢菌的抑菌活性最好,对灰葡萄孢的次之,对立枯丝核菌的较差,对山茶炭疽菌和尖孢镰刀菌的抑菌活性最低。其中,化合物6d、6e、6f 和7d、7e、7f 对茄链格孢菌具有优异的抑菌活性,10 μg/mL时抑制率达60%以上,50 μg/mL 时抑制率达75%以上。化合物7d、7e、7n 对灰葡萄孢的抑菌活性较好,与阳性对照百里香酚相比差异显著,尤其是7e 和7n 在10 μg/mL 时抑制率已达65%以上。
选择对茄链格孢菌抑菌活性较好的化合物6d、6e、6f、7d、7e、7f 和对灰葡萄孢抑菌活性较好的化合物7d、7e、7n,进一步测定其EC50值。结果 (表3) 表明:上述化合物对茄链格孢菌和灰葡萄孢丝生长均有很好的抑制活性,对茄链格孢菌的EC50值在3.28~10.76 μg/mL 之间,其中化合物7d 和7e 的活性较好,EC50值分别为3.40 和3.28 μg/mL。化合物7d、7e 和7n 对灰葡萄孢的EC50值在15.06~18.65 μg/mL 之间,其中7e 的活性最好,EC50值为15.06 μg/mL。整体而言,化合物7d、7e、7f 和7n 对茄链格孢菌和灰葡萄孢具有较高的抑菌保留活性,其中7e 的活性最高。

表3 化合物对茄链格孢菌和灰葡萄孢的毒力测定Table 3 Toxicity test of compounds to A. solani and B. cinerea
选择对灰葡萄孢抑菌活性最好的化合物7e,测定了其对啶酰菌胺高抗菌株 (BcR) 和B-P225F 突变菌株 (BcP225F) 的抑菌活性。结果 (图1) 表明:化合物7e 对BcR和BcP225F也具有优异的抑菌活性,其EC50值分别为9.49 和6.07 μg/mL,即化合物7e 对BcR和BcP225F的体外抑菌活性高于对照药剂啶酰菌胺,且7e 与啶酰菌胺之间没有交互抗性,具有用于灰葡萄孢抗性治理的潜在价值。

图1 化合物对灰葡萄孢不同菌株的抑制活性Fig. 1 Antifungal activity of the compounds against different strains of B. cinerea
2.3 SDH 活性测定
牛血清蛋白标准曲线:在595 nm 处测得吸光度随蛋白浓度变化的回归方程为y=0.003 6x+0.429 9,相关系数r为0.990 4,可用此推算灰葡萄孢的蛋白浓度。
2.3.1 不同处理对灰葡萄孢可溶性蛋白含量的影响 以啶酰菌胺为对照,化合物7e 对灰葡萄孢敏感、抗性和P225F 突变菌株可溶性蛋白含量的影响如图2 所示。从图中可以看出,啶酰菌胺和化合物7e 以不同浓度处理BcS、BcR和BcP225F后,处理组可溶性蛋白含量均高于对照组,且7e 处理组较啶酰菌胺处理组变化明显。啶酰菌胺处理后,BcS可溶性蛋白含量随药剂质量浓度升高而增大;BcR和BcP225F可溶性蛋白含量变化不明显,这可能是造成BcR和BcP225F对啶酰菌胺产生抗性的重要原因之一。化合物7e 处理BcS、BcR和BcP225F的可溶性蛋白含量变化趋势基本一致,菌体内可溶性蛋白含量均随药剂浓度升高而显著增大,其中100 μg/mL的7e 处理后菌体内溶物大量流出,可溶性蛋白含量急剧增加,为62.71~69.10 μg/mL,推测可能是化合物7e 使菌体细胞内溶物外泄,致使细胞凋亡。对比啶酰菌胺和化合物7e 对BcS可溶性蛋白含量的影响,不难发现,在相同浓度下啶酰菌胺处理组的可溶性蛋白含量仅为7e 处理组的一半,说明7e 较啶酰菌胺更能干扰灰葡萄孢体内可溶性蛋白含量的变化,更能影响菌体的正常生命活动。
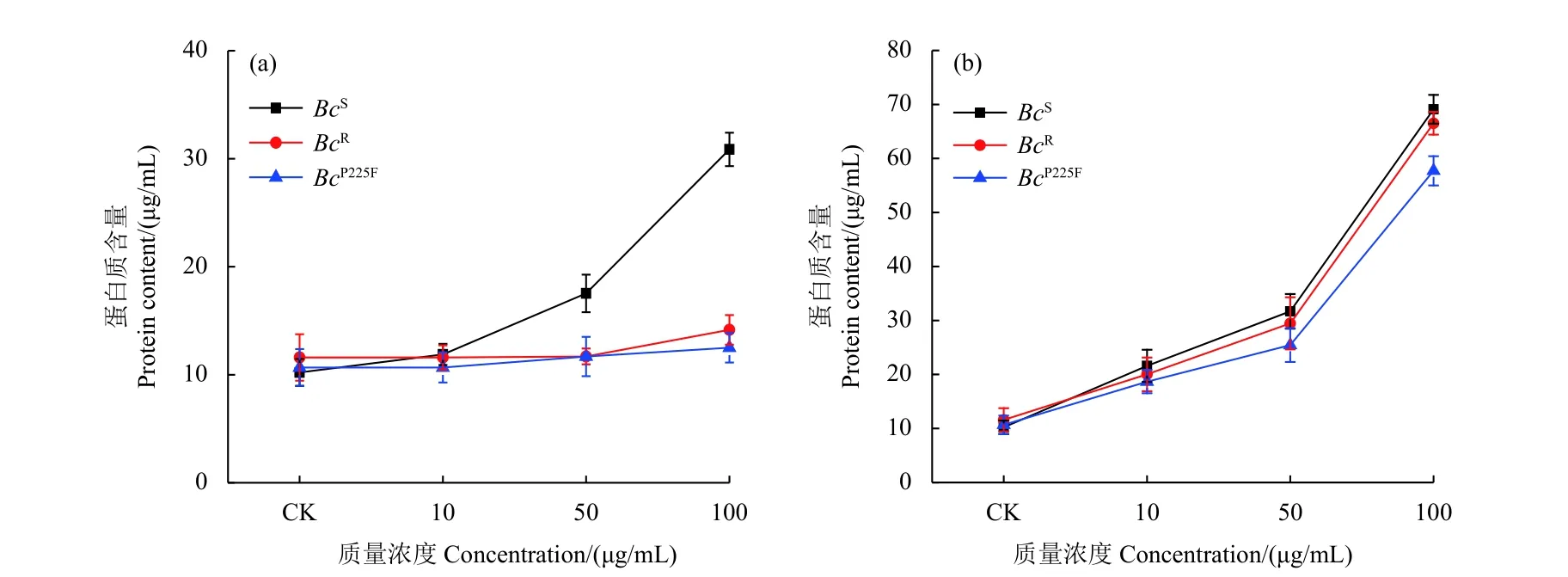
图2 啶酰菌胺 (a) 和7e (b) 不同浓度处理对灰葡萄孢可溶性蛋白含量的影响Fig. 2 Changes of soluble protein content of B. cinerea after treatment with boscalid and 7e at different concentrations
2.3.2 不同处理对灰葡萄孢SDH 活性的影响 由图3 可以看出,啶酰菌胺和化合物7e 对灰葡萄孢SDH 的抑制作用显著,7e 对SDH 的抑制活性强于啶酰菌胺。啶酰菌胺处理组,BcS的SDH 活性下降较BcR和BcP225F的多,对照组SDH 比活力为53.19 U/mg prot,经10、50 和100 μg/mL 的啶酰菌胺处理后,BcS的SDH 比活力分别下降33.57%、41.73%和56.38%;而BcR和BcP225F的SDH 比活力较对照组下降8.51%~26.59%,虽然啶酰菌胺对BcR和BcP225F也有SDH 抑制活性,但却远不及对BcS的抑制活性高。化合物7e 处理组BcS、BcR和BcP225F的SDH 比活力较对照组均显著下降;BcS各浓度处理间差异显著,BcR和BcP225F的SDH 抑制活性对7e 的浓度依赖性不强;经10 、50 和100 μg/mL 7e 处理后,SDH 比活力最高下降率分别为58.78%、61.39%和66.45%;化合物7e 对BcS、BcR和BcP225F均具有很强的SDH 抑制活性,表明7e 是潜在的新型SDHI。

图3 啶酰菌胺 (a) 和7e (b) 处理对灰葡萄孢SDH 活性的影响Fig. 3 Influence of boscalid and 7e on SDH activity of B. cinerea
2.4 分子对接
参照陶丽红等[8]报道的分子对接方法,同源构建了BcSDH 的3D 模型,将啶酰菌胺和化合物7e 分别与野生型和B-P225F 突变型BcSDH 进行分子对接,选择亲和力最高的构象,生成啶酰菌胺和7e 分别与蛋白大分子的复合物。由结合模式(图4) 可知:药物与BcSDH 的结合位点在B、C、D 亚基构成的活性口袋内。啶酰菌胺能够与野生型BcSDH (图4 Ⅰ) 的B-W229、C-L72、CR88、C-I89 形成疏水作用;与D-Y144 形成氢键;具体为啶酰菌胺酸部分的吡啶环上的碳原子与C-R88、胺部分的联苯环的碳原子与B-W229、C-L72、C-I89 形成疏水作用;酰胺键上的氮原子与D-Y144 氨基酸残基形成氢键。B-P225F 突变后(图4Ⅱ),苯丙氨酸侧链所占空间较脯氨酸侧链稍大,活性口袋变窄,啶酰菌胺被往外推,其构象在活性腔口发生了翻转,虽然还能与突变型BcSDH结合,但亲和力下降了3.34 kJ/mol,这可能是灰葡萄孢对啶酰菌胺产生抗药性的重要原因之一。
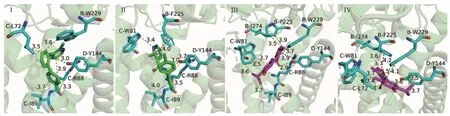
图4 啶酰菌胺和7e 与野生型和突变型BcSDH 的结合模式Fig. 4 The binding modes of boscalid and 7e with wild-type or mutant BcSDH
与啶酰菌胺相比,化合物7e 能够与野生型BcSDH 形成更多的相互作用力 (图4Ⅲ),参与形成疏水作用的氨基酸分别为B-P225、B-W229、BI274 和C-W81、C-I89;参与形成氢键的氨基酸为D-Y144;参与形成π-阳离子作用的氨基酸为C-R88。具体为7e 的酸部分 (3-甲基噻吩) 插入B cS D H 活性腔的底部,噻吩环上的甲基和氮原子分别与B-P225 和B-I274 氨基酸残基形成疏水作用,噻吩环与C-R88 氨基酸残基上的磷原子形成π-阳离子作用;酰胺键上的氧原子与DY144 氨基酸残基形成氢键;胺部分的百里香酚与B-W229、C-W81 和C-I89 氨基酸残基形成疏水作用。B-P225F突变后 (图4Ⅳ),杂合分子7e 仍能进入BcSDH 的活性口袋,与相应氨基酸侧链形成强有力的相互作用,虽然形成相互作用力的类型和参与形成相互作用的氨基酸发生了一定改变,但结合亲和力却增强了0.84 kJ/mol。具体为7e 酸部分 (3-甲基噻吩) 的噻吩环不与C-R88 形成π-阳离子作用,而与B-F225 形成π-π 堆积作用;酰胺键羰基不与D-Y144 形成氢键,胺基与B-W229 形成氢键;胺部分百里香酚上的甲基、苯环和异丙基能够与B-W229、C-L72、C-W81、D-Y144 形成更多的疏水作用。这些疏水作用、氢键、π-阳离子作用和π-π堆积作用的形成,可能是杂合分子7e 能够稳定存在野生型和突变型BcSDH 中发挥药效、产生较高抑菌活性的原因。结合抑菌活性测定结果分析,可能小基团更容易进入植物病原菌SDH 活性口袋,噻吩环与SDH 蛋白周围的氨基酸残基形成π-阳离子作用、π-π 堆积作用和疏水作用有利于提高配体与受体识别度[25];噻吩环、噻吩环上的甲基和胺部分的百里香酚与SDH 蛋白周围的氨基酸残基形成的疏水作用则可能在很大程度上增加熵值、降低自由能,维持药物与靶标之间的结合稳定性[26-27]。
3 讨论
SDHI 类杀菌剂的作用靶标为SDH,本研究的设计思路是将SDHI 药效团与具有广谱抑菌活性的香芹酚和百里香酚拼合设计杂合分子,但目前香芹酚和百里香酚的作用机制尚不完全清楚,可能通过抑制病原菌麦角甾醇的生物合成[28]、破坏细胞膜结构、改变胞内外渗透压和抑制呼吸作用等途径导致病菌裂解死亡[29]。最新研究表明,百里香酚通过调节多种信号通路,包括抑制Ca2+转运蛋白基因表达来降低细胞内Ca2+的浓度,抑制N-糖基化基因表达来减少蛋白质糖基化,通过调节高渗透性甘油 (HOG) 和丝裂原活化蛋白激酶(MAPK) 信号通路来降低麦角甾醇生物合成基因的表达,从而降低内源麦角甾醇含量[30]。本研究合成的酰胺类杂合分子7e 对茄链格孢菌和灰葡萄孢都有很好的抑菌活性,且对BcR和BcP225F的抑菌活性优于BcS,对BcR和BcP225F的抑菌活性优于对照药剂啶酰菌胺,与啶酰菌胺之间不存在交互抗性,具有作为新型杀菌剂活性成分的潜能,能够为植物病害抗性治理提供新理论依据。
本研究表明,啶酰菌胺和杂合分子7e 的酸部分能够插入野生型BcSDH 活性腔底,与B-P225、B-I274 和C-R88 氨基酸残基形成疏水作用或π-阳离子作用;酰胺键上的氮原子或氧原子能够与DY144 氨基酸残基形成氢键;胺部分伸向活性腔口,与B-W229、C-W81 和C-I89 等形成疏水作用。本研究结果与Zhu 等[31]研究结果基本一致,他们对10 种SDHI 与SDH 的结合模式进行了分析,结果表明:杀菌剂的酸部分能够插入SQR 结合的q 位点 (等同于本文SDH 的活性口袋),与周围C-R46、C-S42、B-I218 和B-P169 (等位于本文的C-R88、C-S84、B-I274 和B-P225) 形成范德华力;胺部分延伸到q 位点入口 (等同于本文的活性腔口),与C-W35、C-I43 和C-I30 (等位于本文的C-W81、C-I89 和C-I76) 形成范德华力;酰胺的羰基氧原子与B-W173 和D-Y91 形成氢键 (等位于本文的B-W229 和D-Y144)。因此,在SDHI 类杀菌剂结构修饰时,酸部分应尽可能是富电子的芳环或杂环,骨架部分需含氢键受体,胺部分应该为一个庞大的疏水基团。
本研究还表明,啶酰菌胺处理后BcR和BcP225F的可溶性蛋白含量变化不大,啶酰菌胺对BcR和BcP225F中SDH 的抑制活性低于其对BcS中SDH 的抑制活性;结合模式分析也表明,B-P225F 突变造成BcSDH 活性口袋变窄,啶酰菌胺不能进入突变型BcSDH 活性口袋,且在活性口袋外的构象发生了翻转,导致啶酰菌胺与蛋白大分子的结合亲和力急剧下降。这些因素很可能是共同导致BcR和BcP225F对啶酰菌胺产生抗药性的原因。而化合物7e 处理能够让灰葡萄孢各菌株可溶性蛋白含量明显外泄、SDH 抑制活性显著下降,且化合物7e 能够与突变型BcSDH 产生更为紧密的结合,其中胺部分的百里香酚与蛋白大分子氨基酸侧链形成的疏水作用大幅上升。啶酰菌胺和化合物7e 对BcS、BcR和BcP225FSDH 抑制活性的差异和与野生型和突变型BcSDH 结合模式的不同,可能是造成菌株对啶酰菌胺抗性上升而对化合物7e 依然敏感的原因。
4 结论
本研究设计合成了30 个“单萜酚 + SDHI 药效团”的酰胺类杂合分子,通过1H NMR、13C NMR和HRMS 表征了其结构,并测定这些杂合分子对5 种常见植物病原真菌的抑菌活性,得出如下结论:
1) 在所合成的杂合分子中,7e 的抑菌活性最高,对茄链格孢菌和灰葡萄孢的EC50值分别为3.28 和15.06 μg/mL,且对灰葡萄孢的体外抑菌活性优于对照药剂啶酰菌胺,与啶酰菌胺之间没有交互抗性。
2) 7e 是潜在的新型SDHI,其与啶酰菌胺的用于靶标相同,对BcS、BcR和BcP225F都具有显著的SDH 抑制活性,且能够与B-P225F 突变的BcSDH 结合,这也可能是其与啶酰菌胺没有交互抗性的原因。

