根际土壤理化因子与真菌群落对白及产量和质量的影响
邱 浩,郭 倩,崔浪军,闫鹏东,闫亚平
(西北濒危药材资源开发国家工程实验室/药用资源与天然药物化学教育部重点实验室/陕西师范大学 生命科学学院,陕西 西安 710119)
白及为兰科植物白及Bletillastriata(Thunb.) Reichb.f.的干燥块茎,具有止血、抗菌、消肿、抗肿瘤、生肌敛疮等功效[1],其主要次生代谢物白及多糖具有抗炎症、抗肿瘤、降血脂、降血糖和抗衰老等作用[2]。此外,白及多糖具有良好降解性、相容性和可修饰性,多用于药物递送系统、伤口敷料、生物材料等[3]。
关键次生代谢物含量是衡量药用植物品质的重要指标,其合成除了与植物自身遗传特性密切相关外,与外界环境特征也显著相关。根际土壤真菌不仅能诱导植物合成特定的次生代谢物,有些真菌还能够提高植物的抗病性,从而提升植物产量[4]。土壤理化因子是土壤肥力的重要指标,土壤真菌对土壤养分的稳定和可持续利用起到关键作用[5],二者相互作用,显著影响植物生长和次生代谢物质的积累。研究表明,土壤Zn2+、Mn2+等能够改变植物根际土壤真菌群落结构,影响植物的生长和次生代谢物的合成[6]。如人参(PanaxginsengC. A. Mey.)根际土壤真菌群落结构改变能提高宿主植物多糖含量的积累[7],而大豆(Giycinemax(L)Merrill)根际土壤的镰刀真菌等则降低宿主多糖含量[8]。因此,筛选与宿主植物次生代谢物质积累密切相关的土壤理化因子和根际土壤真菌,对于药用植物次生代谢物质积累机制的揭示和高产、科学田间管理方案的研发具有重要的指导意义。
有研究表明,土壤养分状况能够影响白及多糖及产量变化[9],且根际土壤真菌群落与白及产量和多糖变化关系密切[10]。然而,影响白及产量及质量主要根际土壤真菌种类和关键土壤理化因子尚不清楚。基于此,笔者研究以不同产地的白及和根际土壤为材料,系统分析、揭示关键根际土壤理化因子和真菌种类与白及产量、多糖含量之间的关系,为开发高质高产的白及田间管理技术方案提供理论指导。
1 材料与方法
1.1 材料采集
2019年采集7个产地的白及及其根际土壤样品。每个产地随机选取30株白及(分为3组,每组10株),收集白及根系表面土壤,混合均匀,除去杂质,冰盒运回实验室,分为两部分待测:一部分自然风干用于土壤理化性质的测定,另一部分立即放入-80℃冰箱,用于土壤真菌群落分析。产地见表1。

表1 白及样品来源
1.2 白及产量、多糖含量测定
将采收后的部分附子晒干至恒重,称量其重量并计算产量。粉碎后,采用苯酚—浓硫酸法测定多糖含量[11]。
1.3 根际土壤理化因子测定
土壤中大量与微量元素含量的测定采用PW2403型X-Ray荧光光谱仪(Brukers 8,德国)[12]。
1.4 根际土壤真菌测定
使用Soil Genomic DNA Kit(天根)试剂盒提取土壤总DNA,测定总DNA浓度,1%的琼脂糖凝胶电泳检测总DNA提取质量。利用引物(ITSIF. 5'-CTTGGTCATTTAGAGGAAGTAA-3',ITS2R. 5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增后,建库、Illumina HiSeq高通量测序。利用云平台(http://www.biocloud.net/)进行OTU聚类分析和物种分类学分析等。
1.5 统计学分析
使用 R(v4.1.1;http://www.r-project.org/)分析数据。在P<0.05水平上采用单因素方差(One-way ANOVA)分析白及多糖、产量多样性指数之间的差异,绘制理化因子含量热图、真菌丰度热图、相关性热图,分析根际土壤理化因子与真菌对白及质量及产量的影响,产量、多糖、理化因子、真菌数据进行标准化处理以确保分析准确性。
2 结果与分析
2.1 白及品质含量分析
方差分析结果表明(表2),陕西省商洛市山阳县(A)和云南省丽江市永胜县(D)产地的白及产量接近,与其他产地差异显著(P<0.05)。除河南省三门峡市(E)产地的白及多糖含量明显高于其他产地外,多糖含量在其他产地含量相近。
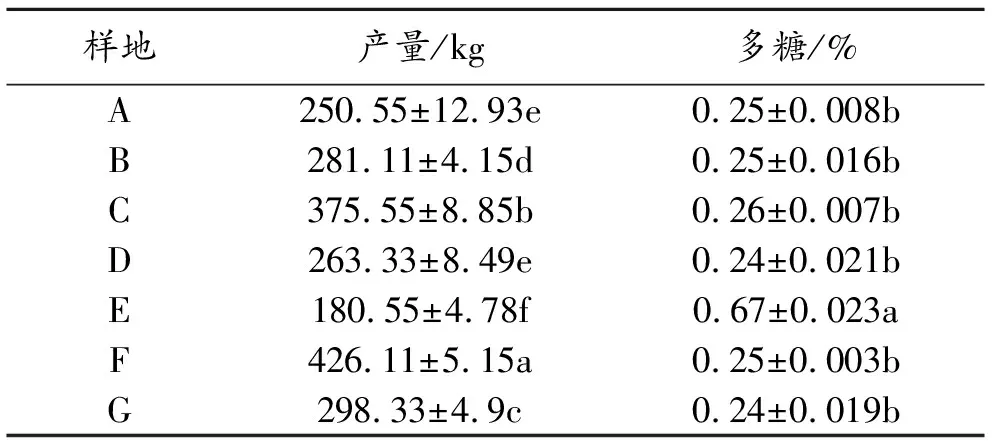
表2 产量及多糖含量
2.2 根际土壤理化因子分析
对白及根际土壤理化因子进行聚类,绘制热图。如图1所示,不同产地理化因子可聚为三类,陕西省商洛市(A)、湖北省宜昌市(B)、河南省三门峡市(E)、云南省普洱市(G)聚为一类;云南省丽江市(D)、湖南省张家界市(F)聚为一类;陕西省汉中市聚为一类(C)。其中,Ca2+在河南省三门峡市(E)含量较高,在其他产地含量相近,Zn2+、P等在陕西省汉中市含量较高,其他产地含量相近。Na+、Mg2+等在陕西省商洛市(A)、湖北省宜昌市(B)含量较高,在其他产地含量相近,Al3+、Fe2+等在不同产地含量相近。
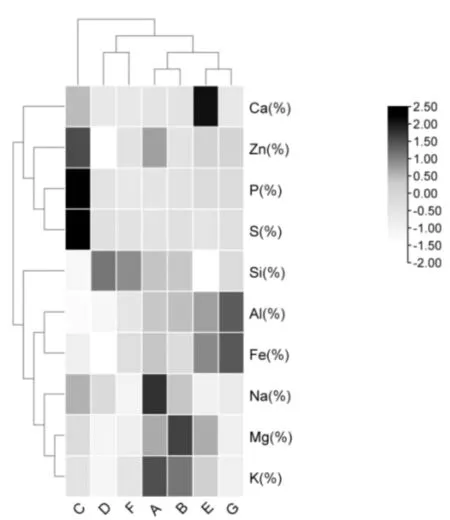
图1 根际土壤理化因子含量热图
2.3 根际土壤真菌多样性指数
通过绘制稀性曲线,评判样本的当前测序深度是否足以反映样本真菌多样性。随样品测序量的增大,相应深度下的Operational Taxonomic Unit(OTU)数量不断增多,随着测序数据量不断增大,各曲线趋向平坦,继续增加测序深度发现新的 OTU 概率较小,说明每个样品测序数量已经满足数据分析需求,测序可以反映出样品中真菌群落的多样性信息,因此测序数据充足、合理,可以用于后续的生物信息学分析(图2)。
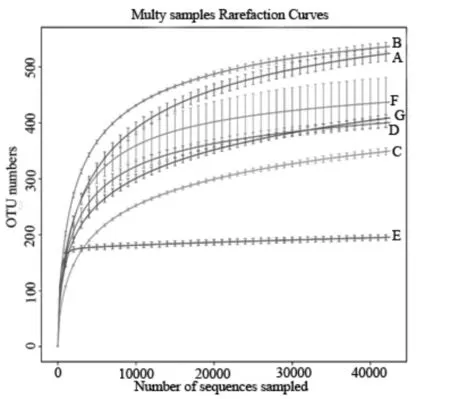
图2 根际土壤真菌稀释曲线
较不同产地附子根际土壤真菌Alpha多样性(表3)。其中,Shannon、Simpson、Ace指数均在云南省丽江市(D)、湖南省张家界市(F)、云南省普洱市(G)之间相似;Chao指数在陕西省商洛市(A)、湖北省宜昌市(B)之间相似,以及陕西省汉中市(C)、云南省丽江市(D)、湖南省张家界市(F)之间相似,Coverage在不同产地均相似。
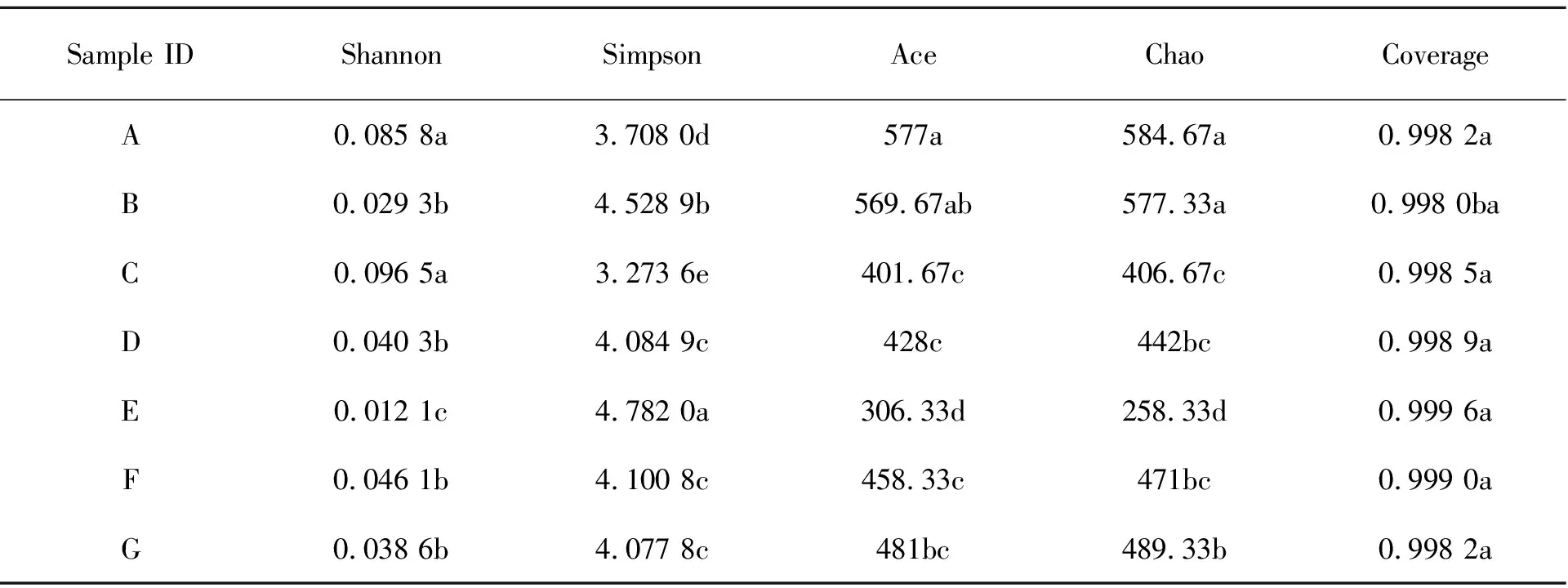
表3 根际土壤真菌Alpha多样性指数
2.4 根际土壤真菌群落结构主成分分析
对白及根际土壤属水平真菌进行主成分分析,绘制不同产根际土壤真菌主成分分析图(PCA)反映真菌群落的组成差异性。如图3所示,两种主成分累积贡献率56.62%。第一主成分分析表明,除A产地,根际土壤真菌群落结构在其他产地相近。第二主成分分析表明,除C产地,真菌群落结构在其他产地相近。

图3 根际土壤真菌PCA
2.5 根际土壤真菌差异性分析
对白及根际土壤真菌中丰度较高的真菌属进行聚类,绘制物种丰度热图。如图4所示,E、F和G聚为一类,呈现出:青霉菌属(Penicillium)、葡萄球菌属(Staphylotrichum)、 木拉克酵母属(Cystofilobasidium)等丰度高,镰刀菌属(Fusarium)、茎点霉属(Phoma)、链格孢属(Alternaria)丰度低的特点。其余的聚为另一类,呈现出:镰刀菌属(Fusarium)、茎点霉属(Phoma)、链格孢属(Alternaria)丰度高、青霉菌属(Penicillium)、葡萄球菌属(Staphylotrichum)、 木拉克酵母属(Cystofilobasidium)丰度低的特点。且在G中青霉菌属(Penicillium)、葡萄球菌属(Staphylotrichum)等真菌丰度最高。F中木拉克酵母属(Cystofilobasidium)、梭孢壳属(Thielavia)等真菌丰度最高。 E中头束霉属(Cephalotrichum)、被孢霉属(Mortierella)等真菌丰度最高。D中链格孢属(Alternaria)、茎点霉属(Phoma)等真菌丰度最高。C中镰刀菌属(Fusarium)、织球壳菌属(Plectosphaerella)等真菌丰度最高。B中拟盾壳霉属(Paraconiothyrium)真菌丰度最高。A中毛壳菌属(Chaetomium)、耐冷酵母属(Guehomyces)真菌丰度最高。
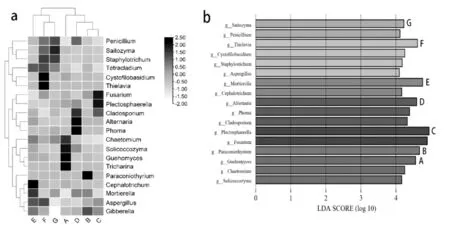
图4 根际土壤真菌群落物种差异
2.6 白及产量、多糖与根际土壤理化因子、真菌群落相关性分析
将白及产量、多糖含量与丰度前20的根际土壤真菌,以及土壤关键理化因子进行相关性分析,结果表明,产量、多糖含量只与少量真菌及个别理化因子显著相关(图5)。其中产量、多糖含量与土壤Cystofilobasidium、Thielavia丰度、以及Zn2+含量正相关,与土壤Phoma丰度和Na+含量负相关。此外,土壤Penicillium和Fusarium丰度与白及产量正相关,与多糖含量负相关, 而Al3+、Ca2+与多糖含量正相关,与产量负相关;
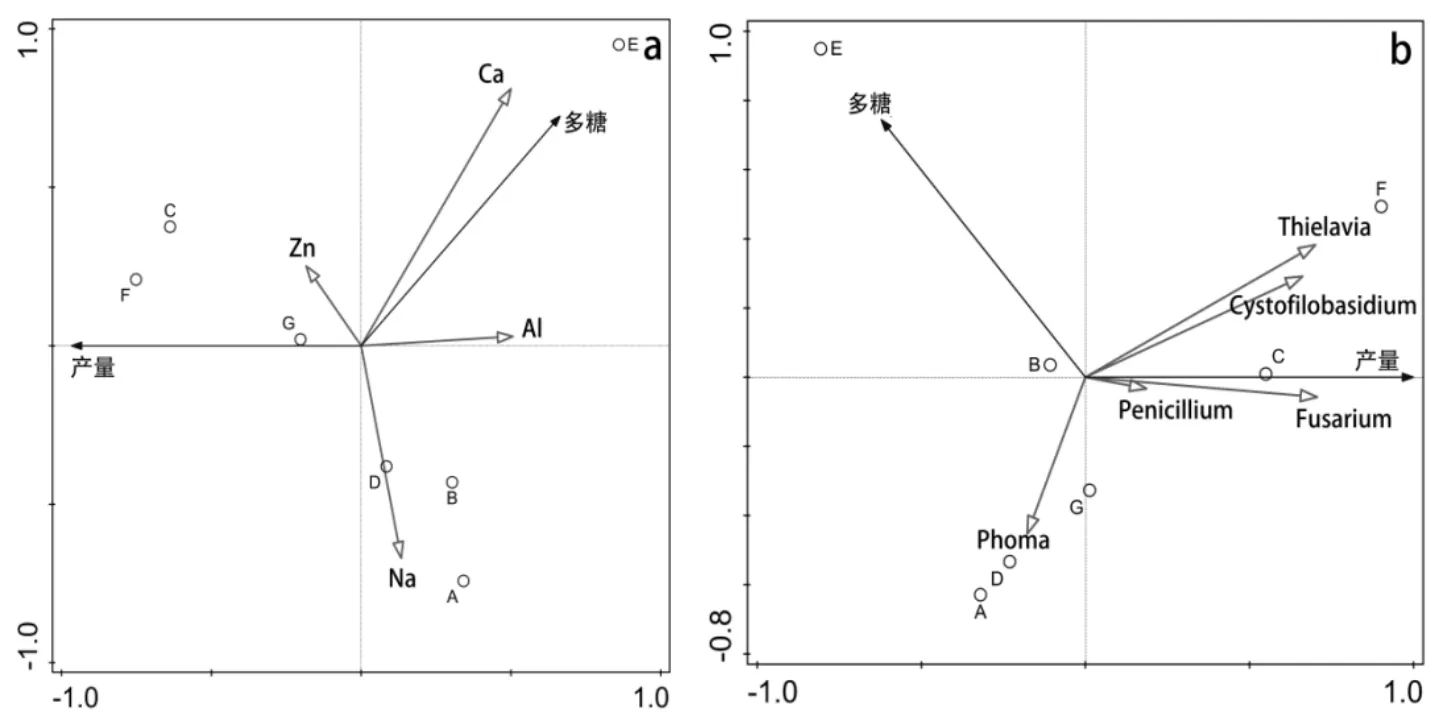
图5 白及根际土壤真菌及理化因子与产量相关性分析
3 结果与讨论
多糖是白及的主要活性成分,具有很强的抗菌性和抗癌特性。可以增强血管内皮细胞的增殖和血管内皮生长因子的表达的[13]。已有研究表明,植物遗传特性、根际土壤理化因子、土壤真菌群落结构会影响白及多糖的积累及产量[14]。然而,影响白及多糖及产量具体的理化因子与土壤真菌尚不明确,本研究对不同产地白及进行研究发现,部分理化因子、真菌与白及多糖积累及产量密切相关。
次生代谢产物通过调控植物和土壤生物之间的相互作用,在植物演替或凋落物分解等生态系统过程中发挥着重要作用[15]。部分根际土壤真菌能促进植物吸收矿质养分,提高植物抗性,调节植物次生代谢产物的产生[16]。笔者研究结果表明,白及产量、根际土壤理化因子含量在不同产地间差异较大,而白及多糖含量和根际土壤真菌多样性指数在不同产地间差异不大,但根际土壤真菌属水平上丰度较高的真菌属在不同产地差异较大。由此可初步推测,根际土壤理化因子及真菌群落结构与白及产量、多糖含量可能密切相关。
相关性分析结果显示,诸多土壤理化因子中,白及多糖含量与Zn2+和Ca2+含量正相关,与Na+含量负相关,而产量与Zn2+含量正相关,与Al3+负相关。类似的研究结果已有报道。Zn2+能提高玉米(ZeamaysL.)和豌豆(PisumsativumL.)的产量属性及产量[17],改善辣椒发育、产量和品质特性,有助于辣椒(CapsicumannuumL.)的栽培[18]。Na+可提升甜菜(BetavulgarisL.)土壤pH,增加土壤结皮并降低渗透率,降低甜菜蔗糖含量,从而降低甜菜质量与产量[19]。土壤中铝能够降低植物根伸长率和枝条生长、减少生物量产量、导致养分失衡以及生理和代谢过程改变,降低作物产量和质量[20]。而Ca2+能有效改善土壤盐分,降低铝毒性,促进植物成长,提高产量和增强抗病性[21]。此外,土壤理化因子还可通过影响土壤真菌群落,进而改变植物的生长和影响植物次生代谢物的积累[22]。本研究结果表明,白及多糖及产量与木拉克酵母属(Cystofilobasidium)、梭孢壳属(Thielavia)正相关,与茎点霉属(Phoma)负相关,产量与青霉菌属(Penicillium)正相关,多糖含量与镰刀菌属(Fusarium)负相关,虽然不能确定这些菌是否能直接合成多糖类物质,但已有的研究表明,这些属的菌与宿主植物的次生代谢物质的积累关系密切。土壤中的木拉克酵母属(Cystofilobasidium)能够促进南瓜(Cucurbitamoschata(Duch. ex Lam.) Duch. ex Poiret)次生代谢物的合成与积累[23],Cystofilobasidium与Sporobolomyces比例增加,能够提升胡萝卜(DaucuscarotaL. var. sativa Hoffm.)中内胡萝卜素的积累,提升胡萝卜质量与产量[24]。土壤中的梭孢壳属(Thielavia)为植物提供高活性的内切葡聚糖酶,增加植物葡萄糖的积累,促进植物对土壤营养成分的吸收,从而提升苜蓿(MedicagosativaLinn)、玉米的产量[25~26]。茎点霉属(Phoma)是引发植物叶病的主要病原菌[27],能够提升土壤中病原菌Leptosphaeriamaculans和Leptosphaeriabiglobosa比例,提高油菜(BrassicanapusL.)病害率,降低有效成分积累与产量[28]。青霉菌属(Penicillium)对抑制真菌病害方面的功效[29],能够提升樱桃(CerasuspseudocerasusG. Don)与玉米等植物产量[30]。镰刀菌属(Fusarium)引起的镰刀菌枯萎病,严重影响了土壤真菌群落结构组成及土壤酸碱度[31],从而使菠菜(SpinaciaoleraceaL.)、香蕉(MusananaLour.)等作物有效成分积累减少,产量降低[32]。由此说明,通过调节根际土壤中Zn2+、Na+、Ca2+、Al3+的含量及木拉克酵母属(Cystofilobasidium)、梭孢壳属(Thielavia)、茎点霉属(Phoma)、青霉菌属(Penicillium)、镰刀菌属(Fusarium)的丰度,可能可以改变白及产量及多糖含量。
综上所述,白及产量及理化因子在不同产地间差异较大,多糖及真菌群落多样性在不同产地间具有较高的相似性。提高Zn2+、Ca2+含量及木拉克酵母属(Cystofilobasidium)、青霉菌属(Penicillium)、梭孢壳属(Thielavia)的丰度,降低Na+、Al3+的含量及茎点霉属(Phoma)、镰刀菌属(Fusarium)的丰度,可能能够提升白及产量及多糖含量。

